- Писмото до тази статия е публикувано в Critical Care 2019 23: 35
Резюме
Заден план
Органната недостатъчност, включително острото увреждане на бъбреците (AKI), е третата водеща причина за смърт след кървене и мозъчно увреждане при пациенти с травма. Опитахме се да оценим разпространението, рисковите фактори и въздействието на AKI върху резултата след травма.
Методи
Направихме ретроспективен анализ на проспективно събрани данни от многоцентров регистър на травмите. AKI е дефиниран според класификацията на риска, нараняване, неуспех, загуба на бъбречна функция и краен стадий на бъбречно заболяване (RIFLE) само от серумен креатинин. Дохоспиталните и ранните болнични рискови фактори за АКИ са идентифицирани с помощта на логистичен регресионен анализ. Предсказуемите модели бяха валидирани вътрешно с помощта на техниката за повторно вземане на проби.
Резултати
В анализа включихме 3111 пациенти. Честотата на AKI е 13%, включително 7% етап R, 3,7% етап I и 2,3% етап F. Честотата на AKI се повишава до 42,5% при пациенти с хеморагичен шок; 96% от AKI са настъпили през първите 5 дни след травмата. При многовариантния анализ дохоспиталните променливи, включително минималното дохоспитално средно артериално налягане, максималният дохоспитален сърдечен ритъм, вторичното преместване в травматологичния център и данните, събрани рано след постъпване в болница, включително оценка на тежестта на увреждането, бъбречна травма, кръвен лактат и хеморагичен шок са независими рискови фактори в модели, предсказващи AKI. Моделът имаше добра дискриминация с площ под кривата на работната характеристика на приемника от 0,85 (0,82–0,88) за предсказване на AKI етап I или F и 0,80 (0,77–0,83) за предсказване на AKI за всички етапи. Тежестта на рабдомиолизата, оценена по пика на креатин киназата, е допълнителен независим рисков фактор за AKI, когато е принуден да влезе в модела (OR 1.041 (1.015–1.069) на стъпка от 1000 U/mL, стр
Заден план
Органната дисфункция остава третата водеща причина за смърт при пациенти с травма, след кръвоизлив и черепно-мозъчна травма [1]. Сред органна недостатъчност след травма, AKI е често срещана, с докладвана честота до 50% и е независимо свързана с продължителен престой в болница и смъртност [2, 3].
Тежката травма отключва първоначални рискови фактори за AKI, включително кръвоизлив, рабдомиолиза, травматично възпаление и води до втори удар поради спешна операция или инфекции, които могат да причинят допълнителни бъбречни нарушения, водещи до увреждане на бъбречната функция. Идентифицирането на рисковите фактори за AKI след травма е от съществено значение за създаването на стратегия, насочена към предотвратяване на AKI и свързаните с него усложнения. Предишни проучвания, съобщаващи за честотата на AKI след травма, са били фокусирани или върху медицинската история [4, 5], хемодинамичните променливи [6, 7], вида на травмата [8] или рабдомиолизата [9] като потенциални рискови фактори за AKI, но включително всички тях предоставят по-пълен преглед на бъбречната агресия, свързана с бъбречна дисфункция. Нещо повече, доболничният период едва ли се взема предвид, но все пак това е време, през което е вероятно да възникне бъбречна агресия (т.е. хипотония, хипоксемия). Освен това повечето проучвания включват пациенти, които са постъпили в интензивното отделение след травма, като впоследствие се избират тези, които са най-тежко ранени, въпреки че трябва да се обърне внимание и на пациенти с умерени наранявания.
Целите на това проучване бяха (1) да се докладва разпространението на AKI, (2) да се опишат рисковите фактори, свързани с AKI и (3) да се изследва дали AKI е независимо свързан със смъртността в многоцентрова кохорта от пациенти с травма, чиито характеристики и физиологични променливите се събират за перспектива в изследователски регистър.
Методи
Проведохме ретроспективно многоцентрово наблюдателно проучване в три френски регионални травматологични центъра, определени за ниво 1, между май 2011 г. и юли 2014 г. Трите центрове за травма постепенно се присъединиха към регистъра TraumaBase между 2011 и 2012 г. (http://www.traumabase.eu/fr_FR ). Клинични, биологични и анамнестични данни за всеки пациент, приет във всеки от тези три центъра, бяха събрани в базата данни. Групата TraumaBase® получи одобрение за това проучване, включително отказано информирано съгласие от Институционалния съвет за преглед (Comité pour la Protection des Personnes, Париж VI-Pitié-Salpêtrière, Франция). Базата данни е одобрена от Консултативния комитет за обработка на информация в здравните изследвания (Comité Consultatif sur le Traitement de l'Information en matière de Recherche dans le Domaine de la Santé, CCTIRS 11.305 bis) и Френската национална комисия по изчисления и свобода ( Commission Nationale Informatique et Liberté, CNIL 911461).
Проучвайте популация
Всички пациенти с травма на възраст над 16 години, приети в трите участващи центъра, като първичен или вторичен (от друго съоръжение в рамките на 48 часа след травма) транспорт са включени в изследването. Университетските болници Beaujon, Pitié-Salpêtrière и Bicêtre са три травматични центъра в региона на Париж. Те управляват грижите за приблизително 60% от пациентите с тежка травма в региона на Париж (12 милиона жители). Системата за спешна медицинска помощ в Париж и управлението на травми са описани другаде [10]. Пациенти, заподозрени в тежка травма (според наличието на поне един критерий за триаж на Vittel, както е оценен от лекаря на място, вижте Допълнителен файл 1), се приемат директно в отделение за интензивно лечение във всеки от участващите центрове за травма. Нашите записи показват, че систематичното приемане на пациенти със съмнения за тежка травма в отделение за интензивно лечение включва подгрупа пациенти с леки до умерени наранявания, които обикновено не са включени в проучвания за травма AKI [11].
Регистърът на TraumaBase включваше всички пациенти, приети в учебните центрове. Данните се въвеждат ръчно от специализирани изследователски техници. Алгоритмите за последователност и съгласуваност са интегрирани в структурата на базата данни. Основен набор от 35 променливи, за които събирането на данни се счита за задължително, беше създадено преди събирането на данни в регистъра. Пълнотата на данните беше наблюдавана и редовно проверявана във всеки център. Мониторингът на данните се извършва от централен администратор.
В базата данни хеморагичният шок се дефинира чрез преливане на най-малко четири единици опаковани червени кръвни клетки (RBC) в рамките на първите 6 часа [14, 15]. Травматично увреждане на мозъка (TBI) се дефинира от поне една травматична лезия при първоначалното церебрално CT сканиране.
Оценка на бъбречната функция
Бъбречната функция беше оценена с вариации на серумния креатинин според класификацията на риска, нараняване, неуспех, загуба, краен стадий на бъбречно заболяване (RIFLE) [16] и най-лошият RIFLE етап през престоя на интензивното отделение беше регистриран в регистъра. Не са събрани данни за бъбречната функция след изписване от интензивно отделение. Измерването на изходното ниво на креатинин при пациенти с травма рядко се предлага, затова избрахме референтната стойност като най-ниската стойност на плазмения креатинин през първите 5 дни от хоспитализацията [17,18,19,20]. Наскоро беше съобщено, че тази методология е по-точна от стойността на креатинина, изчислена обратно, използвайки формулата за модифицирана диета при формула на бъбречната болест (MDRD) за скорост на гломерулна филтрация от 75 mL ∙ min - 1 на 1,73 m 2 в популация от млада травма пациенти [20]. Определихме ранния AKI като AKI, възникващ през първите 5 дни след приемането, а късния AKI като AKI, възникващ след 5 дни [4].
Статистически анализ
Количествените променливи са изразени като средна стойност (SD) или медиана (25–75-ми интерквартили) според тяхното разпределение и категориалните променливи са изразени като брой (пропорции). Разпространението на всеки стадий на тежест на AKI е отчетено в цялата кохорта и в три субпопулации, които обикновено се съобщават в литературата: (1) тежко ранени пациенти с ISS ≥ 16 [21], (2) пациенти с травма, които се нуждаят от повече от един опакован еритроцит концентрират се по време на престоя им в интензивно отделение [22, 23] и (3) пациенти с травма с хеморагичен шок [24]. В следващата стъпка създадохме двоична променлива на резултата, която имаше или стойност 0, когато нямаше AKI, или стойност 1, когато имаше AKI етап R, I или F. Също така създадохме двоична променлива на резултата, която имаше или стойност 0, когато не е имало AKI или AKI етап R или стойност 1, когато е имало AKI етап I или F. Това разчита на факта, че AKI етап R най-често се появява през първите 24 часа след травма, което прави прогнозния модел за AKI етап R, по-малко подходящ от хронологична гледна точка, когато се включват рискови фактори, които изискват 6-часова трансфузия (хеморагичен шок).
Рисковите фактори за стадий I или F AKI (или за AKI всички етапи) бяха оценени при едномерния анализ (т тест за гауссови променливи, хи-квадрат тест за пропорции и тест на Ман Уитни за ненормално разпределени променливи). Ние избрахме тези фактори, свързани значително с AKI в едномерния анализ (стр 0,8). Ако променливите бяха свързани, ние избрахме най-подходящата от клинична/физиологична гледна точка. Кандидатските променливи бяха въведени в поетапна многомерна логистична регресия, използвайки обратен модел за подбор. За да се оцени по-добре производителността на прогнозния модел, беше използван анализ за първоначално изваждане (10 000 преизбиране) за оценка на нечетни съотношения (OR) и 95% доверителни интервали (CI). Като вътрешно валидиране, bootstrapping предоставя стабилни оценки с ниско пристрастие, като адресира оптимизма и пренастройването [26, 27]. Калибрирането на модела беше оценено с помощта на статистиката на Hosmer-Lemeshow и дискриминацията чрез докладване на площта под кривата на работната характеристика на приемника (AUC-ROC). Изследвани са взаимодействия от първи ред.
Пикът на CK не е включен в предсказуемите многовариантни модели, тъй като е късна променлива, която не е от значение за прогнозиране на AKI. Въпреки това, като маркер за тежестта на рабдомиолизата, той беше включен във втори многовариатен анализ, за да се изследва дали рабдомиолизата е независимо свързана с AKI или не.
Изградихме ROC криви за различни прагове на променливи, свързани с AKI. Чувствителност, специфичност, положителни и отрицателни прогнозни стойности (PPV и NPV), положителни и отрицателни коефициенти на вероятност (PLR и NLR) и изчисляване на AUC-ROC са докладвани за всяка променлива. Най-добрият праг беше определен като стойността, максимизираща индекса на Youden (чувствителност + специфичност - 1). За да се изследва връзката между смъртността на AKI и ICU, факторът AKI е въведен в модел на поетапна логистична регресия с други фактори, свързани с резултата (смъртта) в едномерния анализ. Липсващите данни не бяха заменени и в многомерните модели бяха включени само пълни случаи. Пропорции на липсващи данни и характеристики на пациенти с липсващи данни са докладвани за всеки модел. Двустранното ниво на значимост беше фиксирано на 5%. Резултатите бяха анализирани с помощта на R софтуер с отворен код 3.1.1 (https://www.r-project.org/) (Фондация R за статистически изчисления, Виена, Австрия).
Изчисляване на размера на пробата
Преобладаването на тежкия AKI (стадий I или F) е променливо в кохорта от пациенти с травма, като отчетените проценти варират от 1 до 26% [2,3,4,5,6, 9, 17, 18]. Освен това нямаме оценка на разпространението на AKI в нашата база данни с изследвания. Това изключва изчисляването на размера на извадката, който би осигурил точно необходимия брой събития, установени с помощта на предварително публикувани правила (поне 100 събития) за изграждане на модели за прогнозиране на риска [27]. Поради тази причина включихме всички пациенти, налични в базата данни за периода на проучване (н = 3111), като по този начин се очаква да се предоставят солидни оценки дори в случай на тежко разпространение на AKI до 3%.
Резултати
В нашата база данни са регистрирани 3488 пациенти с травма от юни 2011 г. до юли 2014 г. Данни за бъбречната функция са налични за 3111 пациенти. Характеристиките на 377 изключени пациенти са докладвани в Допълнителен файл 2. Характеристиките на общата кохорта са представени в Таблица 1. Пациентите с травма са млади, на 38 (18) години, със средна ISS от 14 (9-25) и са имали предимно тъпа травма (91%): 31% от пациентите с TBI. Хеморагичен шок се съобщава при 11,4% от пациентите. Общата смъртност е 10,8%.
Честота на AKI
Разпространението на AKI в общата популация е 13% (CI 11,8–14,2), включително 7% (CI 6,1–7,9) от пациентите със стадий R, 3,7% (CI 3,0–4,4) от пациентите със стадий I и 2,3% (CI 1,7–2,8) със стадий F (Таблица 2). Честотата на AKI се повиши до 20,9%, 28,3% и 42,5% в подгрупите на пациенти с травма с ISS> 16, при пациенти, получаващи поне една единица опакован концентрат на червените кръвни клетки и съответно при пациенти с хеморагичен шок (Таблица 2) . AKI възниква рано със средно закъснение на пика на креатинина не повече от 2 дни (Таблица 3): 96% от пациентите с AKI (н = 388) са имали ранен AKI, тъй като са достигнали пика на креатинина в рамките на 5 дни след травма, докато 4% от пациентите с AKI (н = 17) са имали късен AKI (8 пациенти с AKI етап R и 9 пациенти с AKI етап F) и са достигнали пика на креатинина след 5 дни. Заместваща бъбречна терапия се използва при 49 пациенти (1,6%).
Характеристики на пациенти с травма с АКИ
Пациентите с ранен AKI са били по-тежко болни от пациенти без AKI или AKI на етап-R, както е отразено от по-лоши хемодинамични променливи, по-тежка TBI (първоначална GCS) и повече кръвопреливане (Таблица 1, допълнителен файл 3). Сред променливите, свързани с тежък AKI в едномерния анализ, колинеарните променливи са TBI, първоначален GCS и минимални доболнични MAP и SAP. Първоначалният GCS и минималният MAP бяха запазени за крайния анализ. В многофакторния модел бяха включени 2345 пациенти (липсващите стойности ни накараха да изключим 766 пациенти, чиито характеристики са докладвани в Допълнителен файл 2). Следните фактори са свързани с AKI етап I или F (Таблица 4): наличие на хеморагичен шок, кръвен лактат, минимална доболнична MAP, максимална дохоспитална сърдечна честота, ISS и вторичен трансфер в център за травма. AUC-ROC на модела е 0,85 (0,82–0,88). В модела бяха избрани едни и същи предиктори, предсказващи АКИ за всички етапи (R, I или F), с изключение на максималната дохоспитална сърдечна честота, която не беше запазена в крайния модел и бъбречна травма, включена в окончателния модел (Допълнителен файл 3). AUC-ROC на последния модел е 0,80 (0,77–0,83). Нямаше значително взаимодействие.
Рабдомиолиза и AKI
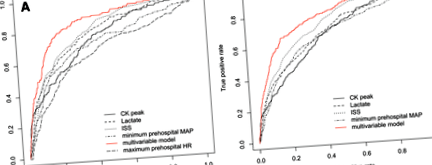
Пикът на CK е наличен при 1382 пациенти (липсващите стойности ни накараха да изключим 963 пациенти, чиито характеристики са докладвани в Допълнителен файл 2). Пиковата стойност на CK достигна 1052 U/L (403–2897) при пациенти без AKI или AKI в стадия R, докато тя достигна 3942 U/L (1481–11,338) при пациенти с AKI етап I или F (стр Фиг. 1
а Криви на работните характеристики на приемника (ROC) за прогнозиране на остро бъбречно увреждане (AKI) (етап I или F) с оценка на тежестта на нараняването (ISS) (AUC = 0,79 (0,75–0,83)), кръвен лактат (AUC = 0,77 (0,73–0,81) )), Пик на креатин киназа (CK) (AUC = 0,73 (0,69–0,78)), минимално догоспитално средно артериално налягане (MAP) (AUC = 0,70 (0,65–0,75)) и максимална дохоспитална сърдечна честота (HR) (AUC = 0,66 (0,61–0,71)). Мултивариантният модел включва следните променливи: наличие на хеморагичен шок, кръвен лактат, минимална дохоспитална MAP, максимална дохоспитална сърдечна честота, ISS и вторичен трансфер в център за травми (Таблица 4). AUC-ROC на многовариантния модел е 0,85 (0,82–0,88). б ROC криви за прогнозиране на AKI (етап R, I или F) с ISS (AUC = 0,76 (0,73–0,78)), кръвен лактат (AUC = 0,70 (0,67–0,73)), пик на CK (AUC = 0,68 (0,65–0,71) )), минимална доболнична MAP (AUC = 0,68 (0,65–0,71)). Мултивариантният модел включва следните променливи: наличие на хеморагичен шок, кръвен лактат, минимална доболнична MAP, ISS, вторичен трансфер в център за травма и наличие на тежка бъбречна травма (Допълнителен файл 3). AUC-ROC на многовариантния модел е 0,80 (0,78–0,83)
AKI и резултат след травма
В поетапен модел на логистична регресия, AKI е независимо свързан с двукратно увеличение на смъртността на интензивно отделение (OR = 2.321 (1.389–3.85) за AKI етап I или F (стр = 0,001) и OR = 1,943 (1,300–2,890) за AKI етап R, I или F (стр = 0,001)) (Допълнителен файл 6).
Дискусия
В това 3-годишно многоцентрово наблюдателно проучване установихме, че АКИ се наблюдава при 13% от пациентите с травма, но това се увеличава до 42% при пациенти с хеморагичен шок. Второ, също така установихме, че АКИ се е случило рано, като 96% от АКИ са диагностицирани през първите 5 дни след травматично увреждане. Трето, моделът, предсказващ AKI, се представи добре и предостави ранни рискови фактори за AKI, които са маркери за хипоперфузия и метаболитна агресия (стойност на лактат при прием, хеморагичен шок, минимална доболнична MAP и максимална предхоспитална сърдечна честота), тежест на нараняване (ISS), бъбречна травма и забавен прием. Четвърто, тежестта на рабдомиолиза (пик на CK) е допълнителен независим рисков фактор за AKI. Пето, AKI е независимо свързано с повишен риск от смъртност на интензивното отделение. Доколкото ни е известно, това е най-голямата многоцентрова кохорта от пациенти с травма, при които са оценени рисковите фактори за AKI. За първи път, заедно с болнични променливи, събрани рано при постъпване, ние докладваме прохоспитални променливи, за да предскажем появата на AKI след травма. Това е още по-уместно, че AKI има ранно начало след травма, като по този начин призовава ранното си предсказване да насочи лечението с цел предотвратяване на AKI.
Що се отнася до прогнозирането на AKI, никоя от променливите, свързани с AKI, не се представя задоволително, за да различи индивидуално появата на AKI етап I или F. Въпреки това, използвайки доболнични и ранни болнични променливи, нашият логистичен регресионен модел се представи добре, за да предскаже AKI етап I или F с AUC-ROC от 0,85. Моделът за AKI на всички етапи (R, I или F) се представи по-лошо, с AUC-ROC от 0,80. За сравнение, в добре проведено проучване, Haines et al. наскоро използва болнични променливи за изграждане на модел, предсказващ AKI на етап 2 или 3 (Класификация на бъбречните заболявания, подобряващ глобалния резултат (KDIGO)) при пациенти с травма, с AUC 0,81, докато техният модел, предсказващ AKI на всички етапи, има AUC 0,77 [35 ]. Взимането под внимание на допълнителни рискови фактори за AKI като биомаркери на AKI или плазмени възпалителни маркери може да помогне за подобряване на прогнозата за AKI в бъдещи проучвания.
Няколко проучвания подчертават, че AKI е независимо свързан с неблагоприятния клиничен изход при пациенти на интензивно отделение [41] или при пациенти с травма [3,4,5, 17, 42]. В настоящото проучване AKI е независимо свързан със смъртността, дори като се вземат предвид стандартните резултати за тежестта на травмата като TRISS. По този начин бъбречната недостатъчност представлява допълнителен маркер за висок риск от смъртност при пациенти с травма.
Заключение
AKI има ранно начало и е независимо свързан със смъртността при пациенти с травма. Разпространението му варира с фактор 3 в зависимост от тежестта на нараняванията и кръвоизлива. Доболничната и данните за рисковите фактори, събрани рано след постъпване в болница, могат да бъдат ефективни при ранното прогнозиране на АКИ след травма. Следователно, проучванията, насочени към предотвратяване на АКИ, трябва да са насочени към пациенти с висок риск от АКИ и да изследват терапиите в началото на лечението при травма.
- Разпространение и свързаните с него рискови фактори за инфекция на лямблия Giardia сред деца, хоспитализирани
- Преобладаване на наднорменото тегло, затлъстяването, коремното затлъстяване и свързаните със затлъстяването рискови фактори в южната част
- Разпространение и рискови фактори за запек при възрастното население на Москва (според
- Разпространение на поднормено тегло, наднормено тегло и затлъстяване и свързаните с тях рискови фактори при непалски
- Рискови фактори за остър хеморагичен синдром на ректална язва и неговата прогноза Контрол на случая на плътност