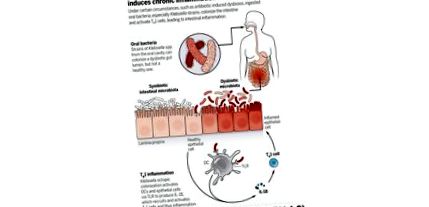
Неотдавнашно проучване установи, че колонизацията на червата на някои бактерии от слюнка, изолирани от пациенти с болестта на Crohn, може да обостри чревното възпаление при мишки.
Последните изследвания започнаха да се фокусират върху ролята на оралната микробиота в здравето на гостоприемника и обострянето на някои системни заболявания. Въпреки че са открити повишени нива на определени микроби, получени през устата, в чревната микробиота на пациенти с възпалително заболяване на червата, вирусна инфекция с човешки имунодефицитен дефицит, чернодробна цироза и рак на дебелото черво, малко е известно дали оралните патобионти-резидентни бактерии, които имат потенциал причиняват заболяване - може да има причинно-следствена роля при обостряне на чревни заболявания.
Неотдавнашно проучване, ръководено от д-р Кения Хонда от Катедрата по микробиология и имунология в Медицинския факултет на Университета Кейо в Токио (Япония), установи, че колонизацията на червата на някои бактерии от слюнка, изолирани от пациенти с болестта на Crohn, може да изостри чревното възпаление при мишки.
Чрез получаване на проби от слюнка от двама пациенти с болестта на Crohn и трансплантацията им в мишки без микроби чрез сондаж, изследователите установяват, че съставът на фекалната микробиота се различава значително между реципиентните мишки в зависимост от натрупването на чревни Т хелперни 1 (Th1) клетки -подмножество от Т лимфоцити със силен провъзпалителен профил.
Съставите на фекалната микробиота се различават значително между реципиентните микробни мишки, в зависимост от натрупването на интерферон-гама (IFN-g) CD4 + Т-клетки (Т-помощник 1 -Th1- клетки) в чревната ламина проприа. Въпреки че пробите от слюнка и на двамата пациенти съдържат сходни микробни съобщества, получените фекални микробиотични състави се различават значително между две групи колонизирани мишки без микроби и повечето от бактериалните видове в тяхната фекална микробиота са второстепенни компоненти на слюнчената микробиота. Тези данни предполагат, че някои орални бактерии могат да колонизират червата и подгрупа от тях може да предизвика натрупване на чревни Th1 клетки.
Klebsiella pneumoniae щам 2H7 (Kp-2H7) е преобладаващият компонент на чревната микробиота на колонизираните микробни мишки и е идентифициран като основен индуктор на Th1 клетъчно медиирани възпалителни имунни отговори. Когато се прилага перорално самостоятелно, той значително индуцира Th1 клетки, специфично в дебелото черво и в по-малка степен в тънките черва - докато смес от седем други щама на K. pneumoniae не успява да индуцира Th1 клетки. Интересното е, че чревната колонизация на Kp-2H7 индуцира преференциално възпалително поколение Th1 клетки в дебелото черво, докато не засяга противовъзпалителните пътища и регулаторното генериране на Т клетки.
Kp-2H7 е устойчив на множество антибиотици, включително ампицилин и тилозин. Въпреки че антибиотик-naïмишки без специфични патогени са били устойчиви на чревна колонизация чрез Kp-2H7, лечението с ампицилин или тилозин е позволило Kp-2H7 да продължи в червата, и това беше придружено от увеличени Th1 клетки на дебелото черво. Освен това, колонизацията на Kp-2H7 не предизвиква никакви възпалителни промени в червата на гостоприемници от див тип, въпреки че индуцира Th1 клетки. въпреки това, моноколонизация на Kp-2H7 в модел на мишки с дефицит на интерлевкин-10 с колит -които спонтанно развиват чревно възпаление със силно поляризиран Th1 отговор- причинени тежки възпаления в проксималната част на дебелото черво. Тези резултати подкрепят известния по-рано факт, че както микробните, така и генетичните фактори на гостоприемника участват в патогенезата на възпалителните заболявания на червата.
Като цяло тези резултати показват, че чревната колонизация и патогенното възпаление, индуцирано от орален Kp-2H7, се появяват само при определени обстоятелства, като индуцирано от антибиотици смущение в микробиотата. В този контекст Kp-2H7 действа като чревен патобионт, който не предизвиква възпаление в устната лигавица, но може да причини тежко възпаление на дебелото черво при генетично чувствителен гостоприемник.
За да се изследват механизмите за Th1-медиираното възпаление от Kp-2H7, изследователите са използвали няколко модела мишки с дефицит в определени вродени и адаптивни имунни отговори. Установено е, че Klebsiella антиген-специфични Th1 отговори са индуцирани от дендритни клетки чрез Toll-подобен рецептор 4 (TLR4) сигнализиране, което показва, че чревните дендритни клетки могат да действат като антиген-представящи клетки, за да усещат сигналите от патобионтите и след това да произвеждат цитокини, за да инициират Т-клетъчни отговори. Освен това, епителните клетки, активирани чрез TLR4 сигнализиране, произвеждат интерлевкин-18, който допълнително усилва Th1 отговора.
Други щамове на Klebsiella, а не Kp-2H7 -Ka-11E12 от проба от слюнка на пациент с активен улцерозен колит и Kp-40B3 от проба от слюнка на здрав индивид- индуцирани също Th1-медиирани възпалителни отговори в червата.
По отношение на клиничната значимост на това проучване, изследователите установиха, че агрегираното относително изобилие от видове Klebsiella е значително по-високо при пациенти с Crohn’s болест и първичен склерозиращ холангит в сравнение със здрави контроли. В допълнение, няколко гена, за които по-рано се съобщава, че са били увеличени във фекалните микробиоми на пациенти с възпалителни заболявания на червата - гени, които включват протеин с коренгулиран хемолизин и ензими, участващи във фруктоза, галактитол, маноза и дълговерижни мастни киселини -свързани поглъщащи и метаболитни пътища- са обогатени в повечето фекални проби от пациентите с възпалително заболяване, носещи видове Klebsiella.
В заключение, оралната микробиота може да бъде източник на потенциални патобионти, които могат да влошат чревното възпаление при генетично чувствителни гостоприемници при индуцирана от антибиотици дисбиоза. Необходими са допълнителни проучвания при хора, за да се изследват терапевтични подходи за управление на хронични чревни възпалителни заболявания чрез насочване към перорално извлечени бактерии.
- Мнение Не забранявайте снимки на слаби модели - The New York Times
- Средиземноморска диета №1 в US News; Класиране на световните доклади Texas Heart Institute
- Трябва ли да имате плодове на празен стомах NDTV храна
- Картофени котлети със аспержи и яйца - хранене по европейски
- Трябва ли наистина да ядете на всеки два часа Times of India