Mersedyes D. Boatman, бакалавър, кандидат за PharmD
Иван Хуарес, кандидат за PharmD
Университет за въплътено слово
Фармацевтично училище Фейк
Сан Антонио, Тексас
Юджийн Талатала, бакалавър, кандидат за PharmD
Университет на Хавай-Хило
Колеж по фармация
Здравей, Хаваи
Моника Литцингер BSc, BSc Pharm, RPh
Амбулаторен фармацевт
Суване, Джорджия
Синдромът на Fanconi е заболяване, което е свързано с дисфункция на проксималния бъбречен канал. Характеризира се с разхищаването на фосфат, аминокиселини, глюкоза и бикарбонат в различна степен. 1 Клиничните прояви произтичат от директни или индиректни нарушения на тубулната система. 2 Fanconi при деца и възрастни популации често се проявява с костни заболявания като последици от синдрома.
Емил Абдерхалден за първи път разследва синдрома на Фанкони през 1903 г. Намирайки цистеинови кристали при новородено, той го нарича „фамилна циститна диатеза“. 3 Гуидо Фанкони, швейцарски педиатър, по-късно даде своя принос за разбирането на болестта, когато отбеляза сходство в случаите, с които се е сблъсквал. Субектите в тези случаи се проявяват с нанизъм, хипофосфатемия и екскреция на органична киселина в урината. 3
Напредъкът в разкриването на механизмите, отговорни за това заболяване, продължава да убягва на разследващите. Фармацевтите в институционална обстановка могат да окажат дълбоко въздействие, като се запознаят с възможностите за лечение, налични за пациенти, които имат синдром на Fanconi.
Епидемиология и патофизиология
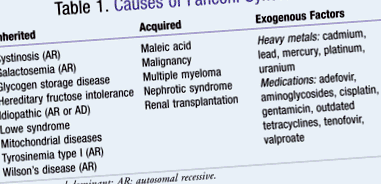
Синдромът на Fanconi е рядко заболяване със спорадична честота и докладване на новодиагностицирани случаи. 4 Синдромът на Fanconi може да бъде причинен от наследствени, придобити или екзогенни фактори (МАСА 1). 5 Неговата заболеваемост е вторична по отношение на метаболитните аномалии, които генерира. 3 Например, фосфатурия, гликозурия и бъбречна тубулна ацидоза са аномалии, които могат да се развият в резултат на заболяването. Те могат да повлияят развитието на костния растеж, което може да стимулира проявите на костно заболяване. В разгледаните проучвания хората в риск са най-често малки кавказки деца. 3 При други форми на синдром на Fanconi, както придобити, така и екзогенни, няма значителни популации, засегнати неблагоприятно. Възрастта на засегнатите варира, тъй като етиологията е разнообразна. Ако заболяването е придобито от лекарства, токсичност на метали или излагане на други вредни агенти, то може да се прояви на всяка възраст. Въпреки това, ако синдромът на Fanconi е наследен по автозомно-рецесивен модел, началото обикновено е очевидно в ранното развитие. 3
Протеините и разтворените вещества се реабсорбират от проксималните тубули с помощта на специализирани транспортери и канали (ФИГУРА 1). Те са локализирани в тръбните клетъчни мембрани, разположени върху луминалната или базолатералната мембрана. 5 Каналчетата също са отговорни за регулирането на киселинно-алкалния баланс, минералната хомеостаза и елиминирането на лекарството. При синдрома на Fanconi разтворените вещества не могат да преминат през апикалната мрежа на проксималната бъбречна тубулна клетка. 5 Пациентите имат значителни биохимични и транспортни аномалии, които водят до загуба на значителни протеини, електролити и други разтворени вещества. Аминокиселините, глюкозата, фосфатът и бикарбонатът се транспортират от тези носители. Понастоящем няма добре дефиниран модел или механизъм, който да подчертава разбирането на патофизиологията. Неотдавнашните доказателства обаче подкрепят популярната теория, според която множеството дефектни транспортери обяснява загубата на разтворени вещества. Много по-правдоподобно е, че сумата от метаболитните нарушения намалява наличността на аденозин трифосфат (ATP) за ензима Na/K ATPase. 6 Това намалява градиента за транспортиране на разтворено вещество, което води до тежка дисфункция на разтвореното вещество.
Цистинозата е най-честата генетична причина за синдрома на Fanconi поради дефектната функция на цистинозина в резултат на мутацията на гена CTNS, което води до интрализозомно натрупване на цистин. 7 Това след това води до ранно начало на инфантилния тип цистиноза, който се характеризира с тежка бъбречна проксимална тубулна дисфункция през първата година от развитието. Цистинозинът функционира като задвижван от протон транспортер, отговорен за износа на цистин от лизозомите. 8 Липсват адекватни доказателства за връзката между интрализозомното натрупване на цистин и синдрома на Fanconi. 7 Наследственият синдром на Фанкони обикновено е придружен от цистиноза, въпреки че състоянието може да придружава и други предавани наследствени метаболитни заболявания като болест на Уилсън и синдром на Лоу. 8
Лекарствата, които индуцират митохондриална дисфункция, имат потенциал да причинят синдром на Fanconi. 9,10 Най-често срещаните лекарства са остарели тетрациклинови антибиотици, химиотерапевтични агенти, антивирусни лекарства, аминогликозиди и антиконвулсанти. Тези лекарства могат да индуцират синдрома на Fanconi по множество различни механизми. Метаболитите на тетрациклин могат да причинят бъбречно тубулно заболяване с електролитен дисбаланс и да предизвикат тубулно увреждане в рамките на 2 до 8 дни след започване на лечението. Обръщането на синдрома на Fanconi може да отнеме до една година. 9 Неотдавнашни опити с животни предполагат, че ифосфамид, цисплатин и карбоплатин намаляват бъбречния кръвоток, причинен от съдово съпротивление. 9 Цисплатинът е директен токсин към проксималните тубуларни клетки, което води до повишаване на b2-микроглобулина и/или аминоацидурия и/или протеинурия. 9
Тенофовир и адефовир индуцират синдрома на Fanconi при пациенти със СПИН/ХИВ. 10-12 СПИН/ХИВ не води пряко до синдром на Fanconi; по-скоро, антивирусните лекарствени метаболити са отговорни за медикаментозния синдром на Fanconi. 13 Хистологично, индуцираната от ХИВ нефропатия се характеризира с апоптоза на тубуларни клетки. Клинични и експериментални данни показват, че бъбречното увреждане може да се дължи на вирусна инфекция, тъй като проксималните тубуларни клетки експресират специфични за ХИВ рецептори и корецептори. 9 Установена е митохондриалната токсичност; обаче броят на пациентите, използващи тенофовир, е особено нисък. 14.
Нефротоксичността е следствие от приложението на аминогликозиди при хоспитализирани пациенти. 15 Въпреки че индуцираният от аминогликозиди синдром на Fanconi е рядък, здравните специалисти трябва внимателно да наблюдават употребата на тези антибиотици при критично болни пациенти; мониторингът е особено по-важен при управление на течности, електролити и хранене. Аминогликозидите се реабсорбират в проксималния канал, причинявайки намалена скорост на гломерулна филтрация. Патофизиологията е несигурна, но се смята, че аминогликозидите необратимо се свързват с клетъчните мембрани, причинявайки лизозомно подуване. 15,16
Синдромът на Fanconi представлява крайния край на спектъра на бъбречно увреждане, предизвикано от валпроева киселина. 17 Предишни проучвания показват, че бъбречното увреждане произтича от самата епилепсия, а не от лекарството. Освен това, индуцираният от валпроева киселина синдром на Fanconi изглежда е изключително за деца и обикновено намалява при прекратяване на лечението. 17
Клинично представяне
Клиничните прояви на синдрома на Fanconi се дължат на различни дефекти в проксималния тръбен транспорт. Те включват нарушена реабсорбция на глюкоза, фосфат, аминокиселини, бикарбонат, пикочна киселина, вода, калий и натрий. 18 Наследственият синдром на Фанкони се характеризира с проксимална тубулна бъбречна ацидоза, хипофосфатемичен рахит, хипокалиемия, полиурия и полидипсия (обикновено в ранна детска възраст). 18 Fanconi е резултат от цистиноза, забавяне на растежа, депигментация на ретината, интерстициален нефрит и прогресираща бъбречна недостатъчност. Придобитият синдром на Fanconi се проявява с малко по-различни аномалии като бъбречна тубулна ацидоза, хипофосфатемия, хипокалиемия, остеомалация и мускулна слабост (ТАБЛИЦА 2). 18.
Лечение
Основната терапия на синдрома на Fanconi е да се лекуват основните причини и да се заменят отпадъците в урината. Течности и електролити се прилагат по орален или парентерален път поради дехидратация в резултат на полиурия, която може да надвишава 2 до 6 литра на ден разредена урина при пациенти с цистиноза. 19 В остра обстановка пациентът може да се нуждае от големи болусни обеми, за да възстанови първоначално общата телесна вода и трябва да се наблюдава често. Решението за перорална или родителска рехидратация зависи от способността на пациента да приема орални течности, общия прогнозен обем, необходим за възстановяване на загубите, и предполагаемата тежест на дехидратацията.
Метаболитната ацидоза се причинява от нарушената способност на бъбреците да абсорбират нормалните нива на бикарбонат. В остра обстановка могат да се използват малки болуси на IV натриев бикарбонат за повишаване на рН на кръвта. 20 За хронична терапия бикарбонат се прилага перорално в границите от 3 до 15 mEq/kg/ден; обаче има горчив вкус и може да причини стомашно-чревни (GI) разстройства. 20-24 Цитратните соли се дозират въз основа на количеството бикарбонатни еквиваленти, което генерират. Например, Cytra-K, който съдържа калиев цитрат и лимонена киселина, генерира 2 mEq калий и 2 mEq бикарбонат на ml. 25 Добавянето на бикарбонат към кръвта може да доведе до увеличаване на усвояването на калий; следователно наблюдението на серумните електролити е наложително при пациенти, вече предразположени към хипокалиемия поради синдром на Fanconi. За да се сведе до минимум обемното разширяване и отделянето на бикарбонат, се използва слаб диуретик като хидрохлоротиазид в доза от 1 до 3 mg/kg/ден. Този диуретик обаче не е щадящ калий; следователно трябва да се предписва калиева добавка.
Метаболитната ацидоза трябва да бъде коригирана от бикарбонатната заместваща течност, но само тя няма да коригира патогенезата на костните заболявания. Поради значителната загуба на фосфат, допълването му, заедно с витамин D, също е необходимо. Оптималните серумни нива на фосфат могат да бъдат постигнати с 1 до 3 g/ден допълнителен фосфат. Пациентът трябва да започне с най-ниската доза, след което да се титрира до оптимални граници, за да се избегне дразнене на стомашно-чревния тракт. За профилактика срещу хипокалиемия може да започне перорално 20 mEq дневно и след това да се титрира при необходимост до 100 mEq, дадено пет пъти на ден за възрастни. 26,27 Децата могат да получават 3 до 8 mEq/kg/ден перорално, разделени на дози един до пет пъти дневно. 27 Добавките на витамин D трябва да се прилагат в неговата активна форма поради възможни нарушения на чернодробната функция.
Основните генетични причини обикновено включват дефектен ензим в метаболизма на хранителните вещества, което води до увреждане на проксималния канал. Пациентите с наследствена галактоземия, непоносимост към фруктоза и тирозинемия биха се възползвали от ограничаването на количеството галактоза, фруктоза и тирозин или фенилаланин, съответно, от диетата си. 21 Пациентите с болестта на Уилсън трябва да бъдат насърчавани да приемат диета с ниско съдържание на мед (като ограничаване на месото от органи, черупчести мекотели и пълнозърнести храни) и да приемат D-пенициламин поради проучвания, които предполагат благоприятни резултати. 4,28 Упражненията също трябва да бъдат ограничени, тъй като органна недостатъчност или значително намаляване на мускулната сила може да са резултат от генетични заболявания.
Цистеаминът (Cystagon) е одобрено от FDA лекарство, използвано за лечение на цистиноза. 27,28 Той функционира, като реагира и след това изнася цистина, попаднал в лизозомите, като по този начин намалява наличното натоварване, за да предизвика клетъчно увреждане. Началните дози са една четвърт до една шеста от поддържащата доза и трябва да се титрират до първоначалната поддържаща доза в продължение на 4 до 6 седмици. За педиатрични пациенти началната поддържаща доза е 1,3 g/m 2/ден, разделена четири пъти на ден. За пациенти над 12 години и над 110 lb първоначалната поддържаща доза е 500 mg четири пъти на ден. Целта на терапията е да поддържа нивата на левкоцитния цистин под 1 nmol половин цистин/mg протеин, когато се измерва 5 до 6 часа след приложението на лекарството. Дозите за двете възрастови групи могат да бъдат титрирани до максимална доза от 1,95 g/m 2/ден, за да се постигне тази цел. Страничните ефекти включват летаргия, диария, гърчове, GI токсичност, анемия и тремор. Не са известни лекарствени взаимодействия с цистеамин. Пациентите с алергия към пенициламин трябва да бъдат внимателно наблюдавани за нежелани събития, когато им се дава цистеамин. 27
Мониторинг
Наблюдението на пациенти със синдром на Fanconi е решаваща част от терапията, независимо от патогенезата или етиологията на заболяването (ТАБЛИЦА 3). Вътрешни и външни фактори, влияещи върху синдрома на Fanconi, са честотата на посещенията на пациента, степента на тежест, балансът на течности и електролити, както и ефикасността и страничните ефекти на лекарствата. 5 Пациентите с придобит синдром на Fanconi могат да бъдат управлявани чрез предотвратяване на излагане на токсини (напр. Олово, остарели тетрациклини, аминогликозиди) и облекчаване на симптомите при деца с диетични промени. Прогнозата за пациента зависи от причината за синдрома и тежестта на бъбречните и извънбъбречните прояви. Генетичните форми са трудни за управление, обикновено са свързани с нарушения в растежа и включват други органи. 5
Родителите на малки деца трябва да бъдат съветвани относно стратегии за предотвратяване или намаляване на симптомите на заболяването. Съветването на родителите да предотвратяват излагането на децата на олово и избягването на остарели антибиотици е важна част от грижите за децата. Децата със синдром на Fanconi, който е вторичен за галактоземия или тирозинемия, трябва да получават специални диетични указания за премахване на непоносимите хранителни вещества от диетата си. 5
Заключение
Широките клинични презентации на синдрома на Fanconi създават многобройни трудности за здравните специалисти. Ефективното диагностициране и лечение на пациенти е притеснително поради ограничената налична информация относно патофизиологията на заболяването. Въпреки че лечението на основните усложнения и електролитния дисбаланс има достатъчно възможности, все още трябва да се постигне терапевтичен напредък. Необходими са допълнителни изследвания, включващи това рядко заболяване, за да се развие съвременната практика. Изключително важно е фармацевтите да са наясно с ролята, която медикаментите играят както за причината, така и за лечението на синдрома на Fanconi. Разбирането на наличните фармакологични лечения може да помогне за подобряване на симптомите на пациента и общите резултати.
- Установено е, че упражненията, диетите подобряват плодовитостта при жени със синдром на поликистозните яйчници
- Екстремно затлъстяване, свързано с алвеоларна хиповентилация - синдром на Пиквик - ScienceDirect
- Характеристики на метаболитния синдром при пациенти със затлъстяване - PubMed
- Диета при синдром на раздразнените черва
- Crigler Najjar синдром тип 2 (CNS тип 2) Неоправдана причина за жълтеница при възрастни