От Адела Рамирес-Торес, Клара Габас-Ривера и Хесус Осада
Изпратено на: 23 ноември 2015 г. Преглед: 24 май 2016 г. Публикувано: 26 октомври 2016 г.
Резюме
Ключови думи
- Аполипопротеинови Е-дефицитни мишки
- Необработен зехтин
- Сквален
- Lpin1
- Thrsp
- Mat1a
- Акад
- Txndc5
информация за глава и автор
Автори
Адела Рамирес-Торес
- Департамент по биохимия и молекулярна и клетъчна биология, Ветеринарно училище, Институт за здравни изследвания на Арагон-Университет в Сарагоса, Сарагоса, Испания
Клара Габас-Ривера
- Департамент по биохимия и молекулярна и клетъчна биология, Ветеринарно училище, Институт за здравни изследвания на Арагон-Университет в Сарагоса, Сарагоса, Испания
Хесус Осада *
- Департамент по биохимия и молекулярна и клетъчна биология, Ветеринарно училище, Институт за здравни изследвания на Арагон-Университет в Сарагоса, Сарагоса, Испания
- Институт по земеделие и храни в Арагон, CITA-университет в Сарагоса, Сарагоса, Испания
- CIBER по физиопатология на затлъстяването и храненето, Здравен институт Карлос III, Мадрид, Испания
* Адресирайте цялата кореспонденция на: [email protected]
От редактирания том
Редактирани от Димитриос Боску и Мария Лиза Клодовео
1. Въведение
Проучването „Седем държави“ показва, че сърдечно-съдовата смъртност е най-ниската в средиземноморските страни в сравнение с други региони, участващи в изследването [1]. Средиземноморският хранителен режим е свързан не само с по-ниска сърдечно-съдова смъртност, но и с обща смъртност [2]. Диетичните интервенции, използващи средиземноморски диети, доведоха до благоприятни резултати както при първичната [3], така и при вторичната профилактика чрез намаляване на броя на коронарните събития и смъртните случаи [4]. Всички тези доказателства предоставиха научна основа за предлагане на средиземноморската диета като нематериално културно наследство на човечеството (http://www.unesco.org/culture/ich/es/RL/00394).
В традиционната средиземноморска диета основният източник на мазнини е зехтинът [5]. Вирджинският зехтин, пример за масло, извлечено по физически начин, е функционална храна, тъй като съдържа няколко компонента, които могат да допринесат за цялостните му биологични свойства. Известен с високите си нива на триацилглицероли, съдържащи мононенаситени мастни киселини, той е добър източник на фитохимикали като сквален [6], фенолни съединения [7, 8], терпени, фитостероли и алфа-токоферол [9, 10]. Съдържанието на сквален в необработеното маслиново масло показва голяма променливост, от 1,5 до 9,6 g/kg [11], и може да варира в зависимост от сортовете горички [12]. Въпреки тази вариация, скваленът е вторият най-разпространен компонент на необработени маслинови масла и най-високият в често консумираните растителни масла [13]. При някои процеси на рафиниране загубата на сквален може да достигне 20% [6]. Тази молекула обаче остава стабилна в девствения зехтин, нагрят при 180 ° C в продължение на 36 часа [14]. Термичната му стабилност прави сквален подходящ за осигуряване на приема му, когато се консумира както в готвена, така и в сурова храна. In vitro той е високоефективен агент за почистване на кислород и е доказано, че е химиопрофилактичен срещу няколко тумора [подробен преглед на описаните му свойства се намира в Ref. [13]].
Средният прием на сквален е 30 mg/ден в САЩ. Когато обаче консумацията на зехтин е висока, приемът на сквален може да достигне от 200 до 400 mg/ден, както се наблюдава в средиземноморските страни [15], или дори може да достигне до 1 g дневно [16]. Въпреки факта, че плазмените нива на сквален идват от ендогенна биосинтеза в допълнение към хранителните източници, концентрацията му е по-висока при тези човешки популации, консумиращи необработен зехтин или черен дроб на акула [17]. Неговата стабилност и бионаличност правят сквалена привлекателно съединение, което характеризира неговите биологични свойства.
2. Черният дроб: орган, чувствителен към хранителните вещества в диетата
Черният дроб секретира фосфолипиди, холестерол и триацилглицероли в плазмата като липопротеинови комплекси, които позволяват транспортирането на тези липиди във водната среда на кръвта. Аполипопротеините като APOB100, APOA1, APOA2 и APOE са основните протеинови съставки на липопротеините. Освен това този орган също секретира ензимите (чернодробна липаза, лецитин-холестерол ацилтрансфераза и фосфолипиден трансферен протеин), участващи в плазмената трансформация на липопротеините [18].
3. Методологичен работен процес
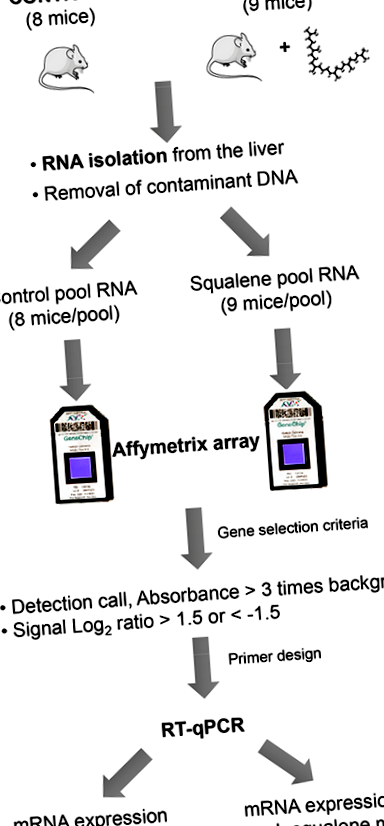
Бяха използвани двумесечни мъжки хомозиготни мишки с дефицит на Apoe с генетичен произход C57BL/6J × Ola129. Установени са две проучвателни групи с равен холестерол в плазмата: (а) едната е получила чау диета и нейната напитка съдържа 1% (v/v) разтвор на глицерол (n = 8), а (b) другата е получила същата чау диета, но неговият разтвор за пиене е допълнен със сквален, за да се осигури доза от 1 g/kg/ден (n = 9). В продължение на 10 седмици мишките се хранеха с експериментални диети, които се понасяха добре, тъй като нямаше случаи на оцеляване, външен вид и прием на твърди и течни вещества, както беше описано по-рано [22]. След това време животните са били жертвани и черният дроб е отстранен. Една аликвотна част, съхранявана в неутрален формалдехид, беше използвана за оценка на степента на липидните капчици, изразена като процент от общия дял на черния дроб, а останалата, замразена в течен азот, беше използвана за извличане на общата му РНК и за изолиране на субклетъчни фракции.
Промените в експресията на 22 690 транскрипти, представени в масива на Affymetrix GeneChip Murine Genome MOE430A, бяха анализирани, за да се открие ефектът от сквален. За да се направи това, обединени чернодробни проби от осем мишки на диетата с чау бяха сравнени с тези, получаващи съединението, както е показано на Фигура 1.
Огромното количество информация, предоставена от микрочипове, изисква по-нататъшна обработка, за да се получат смислени и управляеми данни, с които да се работи, като например избиране само на гените с най-високи промени в експресията или тези, участващи в определен метаболитен път [23]. В настоящата работа е приет първият подход и само онези гени, чиято експресия е силно модифицирана (съотношение на сигнала log2 ≥ 1,5 или ≤1,5), се считат за силно реагиращи на приема на сквален. По-късно генната експресия беше потвърдена чрез количествена верижна реакция с обратна транскриптаза-полимераза (RT-qPCR), за да се засили валидността на резултатите.
За приготвянето на митохондриални и микрозомални фракции, черният дроб се хомогенизира в PBS (4 ml/g тъкан) с коктейлни таблетки с инхибитор на протеаза (Roche). Отпадъците от тъкани се отстраняват чрез центрофугиране при 200 × g за 10 минути при 4 ° С. Хомогенатът се отделя при 1000 х g за 15 минути. Митохондриите, съдържащи супернатант, се центрофугират с пълна скорост, 13 000 х g за 2 минути. След това митохондриалните пелети се промиват два пъти, гранулират се, ресуспендират се в PBS и се въртят в продължение на 1 минута. Микрозомните фракции са резултат от центрофугиране на пост митохондриалната супернатанта при 105 000 х g за 90 минути. Тези пелети се измиват два пъти, завъртат се със същата скорост и накрая се суспендират отново в 0,5 ml PBS [24, 25].
Фигура 1.
Графично представяне на използвания подход. Процесът включва подготовка на РНК, обработка на микрочипове за избор на промени в експресията и потвърждение чрез количествена обратна транскриптаза-полимеразна верижна реакция (RT-qPCR) на отделни проби.
Диференциалната експресия на протеин се анализира чрез DIGE анализ. Петна, чиято плътност значително се различава при обработките, се изрязват от препаративния гел и се подлагат на триптично разграждане и идентифициране чрез масова спектрометрия, както е описано [24, 25].
4. Индуцирани от сквален глобални промени в чернодробната генна експресия
маса 1.
Чернодробни гени, диференцирано регулирани от прилагането на сквален на нивото на сигнал log2 съотношение ≥ 1,5 или ≤ 1,5 при мъжки мишки с дефицит на Apoe.
Данните представляват интензивност на сигнала за всяко условие с чип Affymetrix.
За да се изберат най-подходящите, са взети предвид само диференцирано регулирани гени със съотношение на сигнала log2 ≥ 1,5 (за тези гени, регулирани по-горе) или ≤ 1,5 (за тези, които са репресирани). Таблица 1 изброява гените, чиито иРНК отразяват тези промени. Пет гена, показващи повишена експресия като отговор на приложението на сквален. Два от тези гени, кодирани за транскрипционни фактори (Dbp и Tff3) и три за протеини с различни функции (единият от тях участва в липидния метаболизъм [Lpin1], вторият е сигнална молекула [Rgs16], а третият е ядрен протеин [Thrsp]). Пет гена отговарят на критерия за показване на намалена експресия като отговор на приложението на сквален (Таблица 1). От тях двама участват в имунитета (H2-Aa и H2-Eb1), един е транскрипционен фактор (Arntl), един участва в клетъчния цикъл (G0s2) и накрая един кодиран за ензим, участващ в клетъчната сигнализация (Pde -4б).
| Урегулирани гени | ||||
| Rgs16 | 0,91 ± 0,16 | 11,64 ± 1,5 ** | 12.8 | 3.7 |
| Thrsp | 0,92 ± 0,13 | 4,00 ± 0,65 ** | 4.3 | 2.1 |
| Lpin1 | 0,96 ± 0,19 | 9,77 ± 2,00 ** | 10.2 | 3.3 |
| Tff3 | 0,85 ± 0,11 | 1,26 ± 0,29 | 1.6 | 0.6 |
| Dbp | 0,92 ± 0,20 | 3,76 ± 0,72 ** | 4.08 | 2.0 |
| Понижени регулирани гени | ||||
| G0s2 | 0,56 ± 0,19 | 0,13 ± 0,02 * | 0.2 | -2,3 |
| Arntl | 1,19 ± 0,25 | 0,46 ± 0,07 ** | 0,4 | -1,3 |
| Pde4b | 1,11 ± 0,17 | 1,22 ± 0,27 | 1.1 | 0,1 |
| Н2-Аа | 0,94 ± 0,18 | 0,92 ± 0,18 | 1.0 | 0,0 |
| H2-Eb1 | 1,01 ± 0,16 | 0,75 ± 0,23 | 0.7 | -0,5 |
Таблица 2.
Ефект на сквален върху експресията на чернодробния ген при мъжки мишки с дефицит на Апое.
Данните (означава ± SEM) представляват произволни единици, нормализирани към експресията на циклофилин В за всяко условие с RT-qPCR. Статистическият анализ беше извършен чрез U-теста на Mann-Whitney. ** P ≤ 0,01 срещу чау, * P ≥ 0,05 срещу чау.
За потвърждаване на резултатите, получени с микрочипа, експресиите на горните гени - Arntl, Dbp, G0s2, H2-Aa, H2-Eb1, Lpin1, Pde-4b, Rgs16, Tff3 и Thrsp - които бяха нагоре или надолу регулирани бяха индивидуално анализирани чрез специфични RT-qPCR анализи. Циклофилин В е референтният ген, използван за нормализиране на резултатите (Таблица 2).
Четири от петте регулирани гена, включени в анализа за валидиране - Rgs16, Thrsp, Lpin1 и Dbp - бяха потвърдени, че са значително увеличени в тяхната експресия от прилагането на сквален. Два от петте избрани надолу регулирани гена - G0s2 и Arntl - са значително намалени при мъжки мишки, получаващи сквален. Получено е добро съгласие между тези процедури (r = 0,94, P
Фигура 2.
Анализ на асоциацията между съдържанието на мазнини в черния дроб и нивата на чернодробната иРНК при мъжки мишки с дефицит на ApoE. Корелациите са изчислени съгласно теста на Спиърман и са включени стойности, съответстващи на всички експериментални групи. Квадратите и триъгълниците съответстват съответно на групите чау и сквален.
Семейство ацил-CoA дехидрогенази, включително ACADS, чиято функция се упражнява върху късоверижния ацил-CoA [35], катализира началния етап в β-окисляването на мастните киселини. Проучване за асоцииране в целия геном установи, че някои варианти на този ген са свързани с нарушено β-окисление на мастните киселини и изглежда са маркер за чернодробна стеатоза [36]. По този начин промените в ACADS могат да играят роля в подобряването на състоянието, предизвикано от сквален. Тези открития относно тези два протеина, MAT1A и ACADS, като цели на действие на сквален и тяхната роля при напреднали чернодробни заболявания предполагат, че скваленът може да има роля за предотвратяване на тези патологии.
Фигура 3.
Ефект на сквален върху чернодробните нива на mRNA Mat1a и Acads при мъжки мишки с дефицит на ApoE. (А) Чернодробни нива на иРНК. Данните, изразени като произволни единици на абсорбция, отнасящи се до генната експресия на циклофилин В, получени чрез RT-qPCR анализ, са представени като средна стойност ± SEM. Статистическите анализи бяха проведени с помощта на U-теста на Mann-Whitney. ** Р
6. Сквален-индуцирани промени в микрозомалните протеини
Анализът на микрозомния протеом показа, че скваленът индуцира експресията на протеини, участващи в липиди (MUP8 и SCP2) и везикуларен транспорт (NIPSNAP1 и VCP), контрол на качеството на протеините (PSMA7, PDIA3, HYOU1 и HSPA5), съхранение на калций (CALR), и редокс хомеостаза (TXNDC5 и PYROXD2). Въпреки че ролята на PDIA3 в вътреклетъчната динамика на VLDL е доказана, това не важи за протеини като GRP78/HSPA5 и TXNDC5 [25]. Въпреки това, нивата на протеин и mRNA на TXNDC5 показват обратна и статистически значима корелация с площта на липидните капчици, както е отразено на Фигура 4.
Фигура 4.
Анализи на асоциацията между съдържанието на мазнини в черния дроб и нивата на чернодробна иРНК и протеини на контролни и лекувани със сквален мишки с дефицит на Apoe (A) Корелационен анализ между съдържанието на мазнини в черния дроб и нивата на протеини, (B) корелационен анализ между нивата на иРНК Txndc5 и съдържанието на мазнини в черния дроб. Черните квадратчета означават мишки, хранени с чау, а мишки, третирани със сквален, със сиви триъгълници.
Счита се, че TXNDC5, член на семейството на тиоредоксините, катализира образуването на дисулфид при сгъване на протеини, за защита на протеините срещу окислително увреждане и за предотвратяване на ендоплазмен стрес на ретикулума [37]. Намаление на оксидативния стрес, оценено като 8-изопростагландин F2α, е установено след прилагане на сквален при мишки [22], в съгласие с други автори [38]. В това проучване наблюдаваните промени в TXNDC5 могат да допринесат за по-нисък оксидативен стрес. Като се има предвид, че последният е фактор, индуциращ разграждането на APOB [39] и следователно намалява секрецията на VLDL, увеличаването на TXNDC5 може да стабилизира APOB и да благоприятства секрецията на VLDL. Този хипотетичен механизъм може да обясни наблюдаваната връзка между нивата на TXNDC5 и степента на затлъстяване на черния дроб и представлява нова роля за този протеин. Освен това действието на сквален се упражнява на ниво иРНК. TXNDC5 изглежда е маркер на чернодробната стеатоза, развита в отсъствието на APOE и може да играе роля в подобряването на състоянието, индуцирано от сквален. Тази роля на TXNDC5 по отношение на липидния метаболизъм и липидните капчици трябва да бъде определена.
7. Приблизителен модел на действие на сквален
Като цяло скваленът намалява чернодробното съдържание на липиди, като улеснява производството на триацилглицероли във VLDL и насърчава окисляването на мастните киселини, както е показано на Фигура 5. Тези механизми са наблюдавани при мъжки мишки, показващи базална чернодробна стеатоза, какъвто е случаят с дефицит на аполипопротеин Е.
Фигура 5.
Действие на сквален в хепатоцити на мишки с дефицит на Apoe. Скваленът намалява степента на затлъстяване на черния дроб, като благоприятства секрецията на VLDL и стимулира митохондриалното β-окисление.
В допълнение, сложната роля на хранителния сквален допринася за по-доброто разбиране на чернодробната липидна динамика. Действието на сквален може да помогне да се обясни защитната роля на необработеното зехтин, където стеатоза се наблюдава с по-нисък оксидативен стрес [40] и по-малко развитие на атеросклероза в сравнение с мишки, получаващи палмово масло [41].
При остра токсикология се установява липса на наблюдаван неблагоприятен ефект (NOAEL) от 58 g/kg след еднократна перорална доза и от 29 g/kg след интрамускулно приложение при мишки [42]. Използвайки 20 g/kg/ден в продължение на четири дни, Gajkowska et al. съобщава за развитието на енцефалоневропатия при плъхове [43]. При мишки леталната доза 50 се счита за 5 g/kg/ден [44], а NOAEL от 2 g/kg/ден е открит при 10-дневен режим на приложение [42]. Дозата сквален от 1 g/kg/ден, използвана в нашата работа, е напълно безопасна и всъщност не са отбелязани вторични ефекти. Тъй като мишките показват по-висока скорост на метаболизма от хората [45], тази доза би съответствала на доза за хора от 100 mg/kg/ден. Ясно е, че тази доза е по-висока от отчетената в хранителни проучвания при хора (15 mg/kg/ден) [46], но не достига дозите от 185 и 385 mg/kg/ден, използвани при жени [47]. Следователно, настоящото проучване изследва привлекателна доза, която може да бъде достигната в обогатени храни и предлага потенциална доза сквален, която да се използва като функционална храна или терапия при затлъстяване на черния дроб.
Благодарности
Това изследване е финансирано от безвъзмездни средства: 2013-41651-R от испанския Ministerio de Economía y Competitividad, Европейски фонд за регионално развитие; B-69 от Европейския социален фонд, Gobierno de Aragón; и CB06/03/1012 от CIBER Fisiopatología de la Obesidad y Nutrición (CIBEROBN), инициатива на ISCIII.
- Успокояване на вашите домашни любимци; Холистични действия при храносмилателни смущения! Форум
- Алкалният път Десет съвета за обръщане на метаболитна ацидоза - цялостна първична грижа
- 5-те метаболитни мита с д-р
- Базалната скорост на метаболизма - GFM Управление на теглото и директна първична грижа
- Ново проучване предполага, че хроничната употреба на кокаин причинява дълбоки метаболитни промени, намалявайки телесните s