Франк Турняр
1 Училище по селско стопанство, храна и развитие на селските райони, Университет Нюкасъл, King’s Road, NE2 1PN Нюкасъл на Тайн, Великобритания
Ерван Гурантон
2 INRA, UMR1260 Nutriments Lipidiques et Prévention des Maladies Métaboliques, Марсилия, 13385 Франция
3 INSERM, U476, 13385 Марсилия, Франция
4 Univ Aix-Marseille 1, Univ Aix-Marseille 2, Faculté de Médecine, IPHM-IFR 125, 13385 Марсилия, Франция
Йоханес фон Линтиг
5 Катедра по фармакология, Университет Case Western Reserve, Кливланд, Охайо, САЩ
Яап Кейер
6 Физиология на хората и животните, Университет Вагенинген, Вагенинген, Холандия
М. Луиза Бонет
7 Лаборатория по молекулярна биология, хранене и биотехнологии и CIBER Fisiopatología de la Obesidad y Nutrición, Universitat de les Illes Balears, Палма де Майорка, Испания
Жауме Аменгуал
7 Лаборатория по молекулярна биология, хранене и биотехнологии и CIBER Fisiopatología de la Obesidad y Nutrición, Universitat de les Illes Balears, Палма де Майорка, Испания
Георг Лиц
1 Училище по селско стопанство, храна и развитие на селските райони, Университет Нюкасъл, King’s Road, NE2 1PN Нюкасъл на Тайн, Великобритания
Жан-Франсоа Ландрие
2 INRA, UMR1260 Nutriments Lipidiques et Prévention des Maladies Métaboliques, Марсилия, 13385 Франция
3 INSERM, U476, 13385 Марсилия, Франция
4 Univ Aix-Marseille 1, Univ Aix-Marseille 2, Faculté de Médecine, IPHM-IFR 125, 13385 Марсилия, Франция
Резюме
Последните епидемиологични данни показват, че β-каротинът може да бъде защитен срещу метаболитни заболявания, при които мастната тъкан играе ключова роля. Мастната тъкан представлява основната тъкан за съхранение на β-каротин и е показано, че нейните функции са модулирани в отговор на продуктите на разграждането на β-каротин, особено ретината, получена след разцепване от β-каротин 15,15′-монооксигеназа (BCMO1) и ретиноева киселина произтичащи от окисляване на ретината. Съществува обаче възможността β-каротинът в неговата непокътната форма също да повлияе на функцията на адипоцитите. Разработването на нокаут модел и идентифициране на мутация със загуба на функция посочи BCMO1 като вероятно единствения ензим, отговорен за превръщането на провитамин А в ретината при бозайници. Използването на BCMO1 -/- мишки трябва да предостави информация за ефекта на β-каротина в бъдеще. При хората интервенционните проучвания подчертават огромната вариация на индивидуалната ефективност на превръщането на β-каротина, вероятно поради генетични полиморфизми, които могат да повлияят на отговора на β-каротина. Този кратък преглед обсъжда процесите, свързани с превръщането на β-каротина и ефекта от продуктите на разцепване върху телесните мазнини и функцията на мастната тъкан.
Каротеноиди и провитамин А
Каротеноидите са липофилни пигменти С40, произведени от фотосинтетични организми. До момента са идентифицирани около 600 различни съединения, от които 50 могат да бъдат намерени в човешката диета. Въпреки това, само около 10 присъстват в значителни количества в човешката плазма [54]. Каротеноидите могат да бъдат разделени на две групи според тяхната химическа структура: каротините, които са въглеводороди, и ксантофилите, които също съдържат кислород и следователно са по-полярни от каротините. Разликата в полярността има последици върху тяхното тъканно разпределение и също така влияе върху преразпределението и обмена между липопротеините [46, 70]. Каротеноидите, съдържащи незаместен β-пръстен и С11 полиенова верига, се наричат провитамин А, тъй като те могат да бъдат разцепени от животни, за да освободят ретината, която впоследствие може да бъде превърната в ретинол (витамин А, вижте по-долу). β-каротинът е основният източник на провитамин А с дневна консумация от около 1-3 mg [23, 24, 27, 64].
Високата диетична консумация или висок плазмен каротеноиден статус обикновено се свързват с намален риск от хронични заболявания (като сърдечно-съдови заболявания, някои видове рак и очни заболявания) в наблюдателни проучвания [2, 40]. Освен това, няколко проучвания са установили по-нисък статус на β-каротин при пациенти, страдащи от диабет тип II или метаболитен синдром, отколкото при съответните контроли [10, 19, 20, 55, 56, 65, 82]. Оксидативният стрес е замесен в задействането и/или продължаването на хроничните и метаболитни заболявания и е разработена хипотезата, че увеличеният прием на антиоксиданти (каротеноиди, полифеноли, токофероли) ще предотврати оксидативен стрес и поява на болести. Доскоро полезните ефекти върху здравето, приписвани на каротеноидите, бяха свързани с тяхната способност да действат като „директни“ антиоксиданти (напр. Като чистачи на свободни радикали) в липофилна среда като биомембрани и липопротеини [45]. Настоящите изследвания обаче изследват възможността полезните ефекти върху здравето на фитохимикалите да бъдат причинени от модулация на генната експресия и индуцирани ендогенни защитни механизми [13].
Интересното е, че няколко интервенционни проучвания не успяха да покажат някакви превантивни ефекти на каротеноидите върху честотата на заболяванията, а в някои случаи дългосрочното надфизиологично дозиране дори се оказа вредно при хора в риск от заболяване [5, 21]. Тези данни предполагат съществуването на полезен ефект за β-каротина и че трябва да се постигне оптимален статус на каротеноиди чрез подходящ прием на храна, за да се избегне развитието на заболяването. Освен това този прозорец на полза може да варира при отделните индивиди, в зависимост от техния начин на живот и генетичен произход, като и двамата са податливи на модулиращ отговор на каротеноиди, както е обсъдено по-долу. Човешката мастна тъкан представлява основният запас на β-каротин в тялото [37] и има ключова роля в метаболитните патологии [34]. Следователно би могло да се мисли, че предполагаемият β-каротинов ефект също ще се появи в или ще бъде медииран от мастната тъкан. Въпреки това, основните ефекти на β-каротина върху здравето все още са неясни и могат да включват антиоксидантни свойства, но също така и модулация на генната експресия и/или клетъчна комуникация от β-каротин и/или негови производни [13].
Каротиноидни оксигенази
Каротеноиден/ретиноиден път и липиден метаболизъм
Ефект на β-каротина и неговите метаболити върху биологията на мастната тъкан
Диференциация на адипоцитите
Мастната тъкан е силно пластична. Той има огромен капацитет да се разширява чрез хипертрофия и хиперплазия на адипоцитите. Преадипоцитите могат да се диференцират до адипоцитите. Тази диференциация се предизвиква от хранителни и хормонални сигнали, които активират каскада от транскрипционни фактори, включително CCAAT/енхансер-свързващи протеини (C/EBPs) и активиран от пероксизома пролифератор рецептор γ (PPARγ), като последният се счита за главен регулатор на адипогенезата ( за преглед вижте [14]).
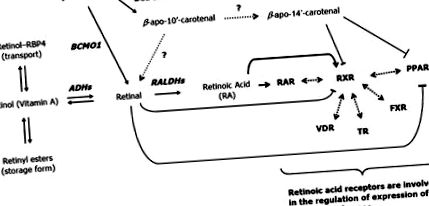
Ефектът на β-каротина е изобразен върху диференциацията на 3T3-L1 преадипоцити, прототипният модел за такива изследвания [38]. Резултатите показват, че β-каротинът силно инхибира мастната конверсия на 3T3-L1 клетки. Въз основа на тези резултати обаче не може да се изключи витамин А, а не β-каротинов ефект. Всъщност е добре известно, че производни на витамин А са силни репресори на диференциацията на адипоцитите. Това беше установено отдавна за RA [42] и скорошна статия елегантно демонстрира, че физиологичната концентрация на ретината потиска адипогенезата in vitro и in vivo [85] чрез инхибиране на RXRα (ретиноиден X рецептор α) и PPARγ-активиране от съответните им лиганди (Фиг. 2). Същата група също е показала, че асиметричният продукт на разцепване β-апо-14'-каротенал (но не и β-апо-8'каротенал и β-апо-12'-каротенал) има инхибиторни свойства върху преадипоцитната диференциация чрез потискане на PPARα, PPARγ и RXR-активиране от съответните им лиганди [86].
RA е изследван до голяма степен като модулатор на експресията на гени на бозайници. Основните ефекти се медиират от два вида ядрени хормонални рецептори: ретиноидните X рецептори (RXRα, RXRβ и RXRγ), които реагират на 9-цис RA и рецепторите на ретиноевата киселина (RARα, RARβ и RARγ), реагират на всички транс и 9-цис RA. Тези ядрени рецептори имат много широки последици за общата хомеостаза. RXR действат като партньори на други ядрени рецептори от клас II, включително рецептор на тиреоиден хормон, рецептор на витамин D, PPAR, рецептор за фарнезоид X и рецептор на черния дроб, което води до множество биологични ефекти [22]. По същия начин RAR с RXRs като партньори за хетеродимеризация имат биологични ефекти, вариращи от морфогенеза и органогенеза, до клетъчен растеж, диференциация и апоптоза [22].
В специфичния контекст на диференциацията на адипоцитите, ефектът на all-trans RA е свързан с няколко събития (прегледани в [6]). Сред тях RAs пречат на C/EBP протеините, което води до блокиране на индукцията на целеви гени надолу по веригата, включително PPARy. Демонстриран е ефект върху експресията на RARy (регулиране нагоре) и RXRα (регулиране надолу), което модифицира сглобяването на хетеродимери на ядрените рецептори, участващи в адипогенезата. И накрая, ефектите на RA върху протеина на ретинобластома могат да благоприятстват пролиферативната способност и по този начин да намалят диференциращата способност на преадипоцитите. Интересното е, че ниските концентрации (1–10 nM) на RAs, за разлика от високите концентрации (0,1–1 μM), изглежда имат стимулиращ ефект върху адипогенезата (прегледано в [6]).
И накрая, трябва също така да се вземе предвид, че както in vivo, така и in vitro RA (all-trans и 9-cis) е показано, че индуцира експресията на разединяващ протеин-1 (UCP1), молекулярният маркер на кафявите адипоцити. Каротеноидите от провитамин А също индуцират експресия на UCP1 в първични кафяви адипоцити, диференцирани в културата [61]. Тази индукция се обяснява със съществуването на RA и PPAR елементи на отговор в UCP1 генния промотор. Съобщава се и за индуциране на други членове на семейството на UCP от all-trans RA (виж [6]).
Производство на адипокин
Липиден метаболизъм
Данните за липидния метаболизъм на адипоцитите, третирани с β-каротин или апокаротенали, са оскъдни. Доколкото ни е известно, са публикувани само проучвания, занимаващи се с all-trans RA. Тези проучвания показват, че както in vivo (при лекувани мишки), така и зрели 3T3-L1 адипоцити, all-trans RA задейства ремоделиране за намаляване на липогенезата и повишен окислителен метаболизъм, както е показано от промени в генната експресия, хистологични промени и в случай на култивирани клетки, увеличава липолизата и окисляването на мастните киселини [50, 51].
Бъдещи
Признание
Авторите признават Европейската мрежа за нутригеномика NuGO за финансирането на фокусния екип „Каротеноиди“. Те са благодарни на д-р Aldona Dembiska-Kiec (JUMC Краков, Полша), Patrick Borel (INRA 1260 Марсилия, Франция), Chris Evelo (BiGCat Maastricht, Холандия), Andreu Palou и Joan Ribot (UIB, Испания) за техните коментари относно ръкописа.
Изявление за конфликт на интереси Авторите заявяват, че нямат конфликт на интереси.
Бележки под линия
Георг Лиц и Жан-Франсоа Ландрие допринасят еднакво за тази работа.
- Ефекти от бързото отслабване върху системно и мастно възпаление и метаболизъм при затлъстяване
- Ефекти от умереното и последващо прогресивно отслабване върху метаболитната функция и мастната тъкан
- Факултативното селезиране на протеини регулира редокс чувствителността, термогенезата на мастната тъкан и
- Сравнимо намаляване на депото на висцералната мастна тъкан след индуцирано отслабване отслабване с или
- Бързо отслабване 🍡 Продукти за отслабване на Amway Странични ефекти - Орхидеи Kultana