Субекти
Резюме
Кетогенната диета е потенциална адювантна терапия за рак, която ограничава наличието на глюкоза в туморите, като същевременно зарежда нормалните тъкани с кетонни тела. Изследвахме ефекта от нисковъглехидратната кетогенна диета (LCKD) (80% kcal от мазнини, кетогенно съотношение 1,75: 1, w/w) в сравнение с обща болнична диета (GD) върху серумните метаболитни профили при пациенти (н = 18, ≥ 19 години), които са претърпели панкреатектомия за рак на панкреатобилиарната жлеза. Серумните проби, събрани преди операцията (седмица 0) и след диетичната интервенция (седмица 2), бяха анализирани с нецелеви метаболомичен подход, като се използва течна хроматография - тандемна мас спектрометрия. Серумните нива на β-хидроксибутират и общите кетони значително се повишават след 2 седмици LCKD в сравнение с GD (стр
Въведение
Ракът на панкреаса причинява тежка заболеваемост и има висока смъртност, тъй като ранната му диагностика е трудна и представлява висок риск от метастази 1. Степента на 5-годишна преживяемост (от 2004 до 2010 г.) на пациентите с диагноза рак на панкреаса в Съединените щати е била само 7% 2. Докато само 15–20% от пациентите с рак на панкреаса имат право на резекция на тумор, ранното откриване може да увеличи 5-годишната степен на преживяемост до ≥ 50% 3. Хирургичното лечение на рак на панкреаса често води до недохранване, което може да доведе до лоши хирургични резултати и повишена токсичност на химио-/лъчетерапията; следователно, следоперативната хранителна подкрепа при пациенти с рак на панкреаса е важна за подобряване на прогнозата 4. Недохранването, свързано с рака, се свързва с ниско качество на живот, лоша мускулна функция, увеличена продължителност на болничния престой, висока смъртност и хирургични усложнения 5. La Torre и др. съобщава, че след хирургична резекция на тумор 88% от пациентите с рак на панкреаса са имали средно висок риск от недохранване 6. Тези пациенти са имали значително по-дълго време за възстановяване и повишена заболеваемост в сравнение с пациентите, които са били с нисък риск от недохранване 6 .
Целта на това пилотно проучване беше да се изследват следоперативните ефекти на нисковъглехидратната кетогенна диета (LCKD) върху серумните метаболитни профили при пациенти, подложени на панкреатектомия за рак на панкреатобилиарната жлеза, в сравнение с диета с общо болнично лечение.
Материали и методи
Учебни предмети
Това проучване е одобрено и проведено в съответствие с насоките и разпоредбите на Институционалния съвет за преглед на болницата Severance (Зададен номер: 4-2016-0799) в Сеул, Корея. Всички субекти предоставиха информирано съгласие. Възрастни пациенти (≥ 19 години) с рак на панкреатобилиарната жлеза (т.е. рак на панкреаса, рак на дванадесетопръстника, дистален рак на жлъчните пътища или ампуларен рак), които са претърпели панкреатикодуоденектомия или дистална панкреатектомия, са били записани в клиника по панкреатична хирургия между ноември 2016 г. и май 2017 г. Изключихме пациенти, които са били бременни, неграмотни, от чужда страна или са имали тежки диабетни усложнения, хиперлипидемия със сърдечно-съдови усложнения или бъбречна недостатъчност с нормална скорост на гломерулна филтрация 2 състояния са както следва: FTMS, ESI-позитивен режим с масова резолюция на 70 000; пълен обхват на сканиране: 80–1000 m/z; dd-MS 2 (Топ 10) резолюция от 17 500 с енергия на сблъсък 30; дебит на азотен обвивен газ и спомагателен газ: 40 (произволни единици) и 10 (произволни единици); напрежение на пръскане: 3,5 kV; капилярна температура: 320 ° C; S- обективRF ниво: 50; температура на спомагателния газов нагревател: 300 ° C. QC проби се инжектират във всяка десета проба, за да се проверят качеството и надеждността на данните.
Обработка на данни и идентификация на метаболитите
Необработените LC-MS файлове с данни (.raw) бяха импортирани в онлайн платформата XCMS (https://xcmsonline.scripps.edu/) за нелинейно подравняване на данните във времевата област и за извличане на пиковите интензитети 21. Настройките на параметрите бяха 10 сек ширина на лентата, толеранс 15 ppm за търсене в базата данни и стойности по подразбиране за стойности, които не са показани. Извлечените данни включват време на задържане, m/z и интензитет на йона. Точните маси на диференциалните йони бяха проверени в онлайн бази данни, включително HMDB (www.hmdb.ca) и MycompoundID (www.mycompoundid.org). Масите и интензивността на масивите на заявката бяха сравнени с тези в базата данни, като се използва резултат за ≥ 0,9. MetaboAnalyst 4.0 (www.metaboanalyst.ca/) е използван за провеждане на йерархичен клъстер анализ и изготвяне на топлинни карти за проверка на способността за класификация на метаболитите. Корелационният анализ на Пиърсън е извършен с помощта на същия инструмент. MetaboAnalyst 4.0 е онлайн инструмент с отворен достъп, който поддържа статистически анализ, визуализация и интерпретация на метаболомични данни 22 .
Анализ на пътя
MetaboAnalyst 4.0 е използван за извършване на анализ на пътя, като се вземат предвид концентрациите на идентифицираните метаболити с многовариантна променлива значимост при прогнозната стойност (VIP)> 1,0 и стр 23. Пътищата бяха определени като значително обогатени с помощта на отсечки от стр 0,1 за оценка на въздействието на пътя. Базата данни KEGG Pathway (https://www.kegg.jp/kegg/pathway.html) и SMPDB (http://smpdb.ca/) бяха използвани за търсене на суперпътеката и пътеката, съдържаща всеки отделен метаболит. В случай, че метаболитите са включени в множество метаболитни пътища, е посочен най-изложеният път.
Статистически анализ
Едномерна непараметрична Ман – Уитни U бяха проведени тестове за всички метаболити и бяха извършени многовариантни анализи на основни компоненти (PCA) и ортогонален частичен анализ на най-малките квадрати (OPLS-DA) за всички групи, използващи SIMCA версия 14.1 (Umetrics Inc., Швеция) 24,25,26. Интензитетите на метаболитните пикове бяха трансформирани и скалирани, използвайки скалиране на Pareto 27 преди многовариантния анализ, използвайки SIMCA 14.1 (Umetrics, Inc., Швеция) 28. Трансформацията на лога се използва за нормализиране на дясно изкривеното разпределение на стойностите на интензитета на метаболитите Мащабиране по Парето, коригирано за относителната важност на големите стойности 27. Устойчивостта и валидността на резултатите бяха оценени с параметри R 2 X, R 2 Y и Q 2 Y, както и с кръстосано валидиран дисперсионен анализ (CV-ANOVA). Метаболитите бяха филтрирани като едномерни статистически стр-стойност 30 и VIP стойност> 1,0. Информацията за медицинските и антропометричните мерки на пациента е изразена като средно ± стандартно отклонение (SD).
Резултати
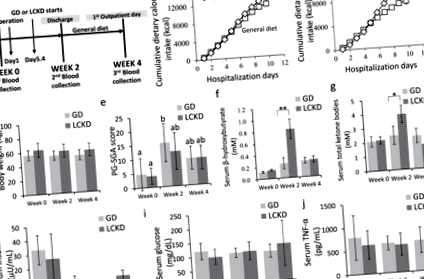
Характеристики на пациента, хранителен прием и биохимия на кръвта
Нецелеви метаболомичен анализ от LC-MS/MS
Общо 11 657 йонизирани съединения в режим ESI + бяха открити, използвайки LC-MS/MS. Докато QC пробите бяха тясно групирани (фиг. 2а), резултатите за GD и LCKD бяха ясно разделени на седмица 2 в двуизмерен анализ на графика на PCA резултат (фиг. 2б). Анализът на графика на OPLS-DA във всеки момент от време (седмици 0, 2 и 4) показва, че базовите профили между групите не са различни (Таблица 2). Един добър модел на класификация е открит само между GD и LCKD групи на седмица 2 (Таблица 2 и Фиг. 2в). Извършена е статистическа валидация на OPLS-DA модела с помощта на 500 пермутационни теста (Фиг. 2г). Карта на топлината на общите пикове, извлечени от XCMS, е представена на фиг. 2д. Тези резултати предполагат, че диференциалният метаболитен профил между GD и LCKD групи е открит едва на 2 седмица.
График на резултатите от PCA, графики за триизмерни точки на OPLS-DA и график за валидиране на резултатите от метаболитно профилиране между GD и LCKD (седмица 2). Сравнени графики за PCA резултат (а) проба и QC и (б) GD и LCKD групи на седмица 2 (° С) График за оценка на OPLS-DA (три латентни променливи, стр = 0,024, R 2 Y = 0,964, Q 2 = 0,555) и (д) 500-пермутационният график валидира GD спрямо LCKD в режим ESI +. Всички пермутирани стойности на R2 и Q2 вляво бяха по-ниски от точката вдясно и Q2 регресионната линия имаше отрицателно пресичане. (R2 = 0.933959, Q2 = -0.174472). (д) Общата пикова интензивност между GD и LCKD през седмица 2 се визуализира с йерархичен клъстер анализ на топлинната карта. OPLS-DA, ортогонален частичен анализ на най-малките квадрати; PCA, анализ на основните компоненти; QC, контрол на качеството.
Диференциални метаболити между GD и LCKD
Лека повишена регулация на β-хидроксибутират беше открита чрез целенасочен количествен анализ с LCKD на седмица 2 в сравнение с GD (стр = 0,05) (Фиг. 3а). За сравнение на метаболомичните данни за GD и LCKD през седмица 2, граничните стойности на OPLS-DA VIP резултат> 1.0 и стр 31, беше значително понижено, докато lysoPC (18: 2) 15,18, пикочна киселина 16, цитрулин 32 и инозин 15 бяха значително регулирани в групата на LCKD на седмица 2 (Фиг. 3b). След изключване на лекарствата (n = 20), ксенобиотиците (n = 82), оценка за пригодност Фигура 3
Анализ на пътя
За анализ на метаболитните пътища избрахме по-строга гранична стойност на VIP оценка> 1,0 и стр 1.0, стр
Дискусия
Данните демонстрират, че нашият LCKD е кетогенен и предизвиква метаболитни промени при следоперативни пациенти с панкреатобилиарен (периампуларен и дистален панкреатичен) рак, които са претърпели панкреатектомия. Кетогенната диета обикновено е с високо съдържание на мазнини, при кетогенно съотношение 3: 1 до 4: 1, F: C + P (w/w) 7. Лечение с нисък гликемичен индекс и модифицирана диета на Аткинс с кетогенно съотношение 1: 1 също се използват в протокола на Джон Хопкинс, който предизвиква кетоза чрез ограничаване на въглехидратите до 10–20 g/ден, като същевременно не ограничава протеините, течностите или енергията 33. Нашият LCKD е насочен към кетогенно съотношение 1,75: 1 и хранителен състав от 15,95 g (4% kcal), 60,00 g (16% kcal) и 132,91 g (80% kcal) от C, P и F, съответно. За да се предотврати загубата на протеини в тялото, минимум 20
Осигурени са 25 kcal/kg и 1,0 g протеин на kg, въз основа на насоките на Европейското общество за клинично хранене и метаболизъм (ESPEN) 34 .
Значителни промени в серумните метаболити от LCKD са наблюдавани постоперативно при пациенти с панкреатобилиарен рак. Сред значително променените метаболити 48,8%, 27,5%, 10,8%, 8,8% и 2,9% са участвали съответно в метаболизма на липидите, аминокиселините, нуклеотидите, кофакторите и витамините и въглехидратите. Нашият анализ на пътищата предполага, че е възможно да са настъпили промени в метаболитните пътища за сфинголипиди, триптофан, аскорбат и алдарат, GPL, тиамин, цистеин и метионин, ретинол и нишесте и захароза.
Сфинголипидите участват като биоактивни липиди в мрежите за трансдукция на сигнали на ракови клетки, за да регулират растежа на тумора, разпространението, миграцията и метастазите 38. LCKD изглежда намалява серумните нива на C22: 1-керамид, C18-церамид фосфат, галабиозилцерамиди и глюкозилцерамиди в сравнение с GD. Преди това се съобщава за значително повишаване на специфичните отделни керамиди, които са метаболити на сфинголипидния път, в кръвта на пациенти с рак 18,31,39,40. Серум C24: 6-церамид 18 и серумна екзозома C22: 1-ceramide 31 нива са увеличени при рак на панкреаса. С18-керамид фосфат е вид керамид 1-фосфат (С1Р), класифициран като сфинголипид. C1P е ключов регулатор в миграцията и инвазията на клетки на рак на панкреаса при човека 41. Съобщава се, че галабиозилцерамидът (d18: 1/18: 1) е увеличен при рак на яйчниците 42. В нашето проучване беше установено, че нивата на галабиозилцерамид (d18: 1/24: 0) и галабиозилцерамид (d18: 1/24: 1) са понижени от LCKD. Няколко глюкозилцерамиди са тясно свързани с противоракова лекарствена резистентност 43,44. За разлика от GD, LCKD може да предизвика промени в нивата на церамид в кръвта срещу свързаната с рака на панкреаса дисрегулация на кръвните метаболити.
Известно е, че диетата с ниско съдържание на въглехидрати и високо съдържание на мазнини намалява доставките на глюкоза и АТФ за раковите клетки на панкреаса, като потиска растежа и разпространението им Като алтернатива може да възникне кетогенеза при изчерпване на чернодробния гликоген и окисляване на мастните киселини 53. Търсихме индуцирани от LCKD промени в метаболитите на метаболизма на глюкозата. Беше открито повишено регулиране на G1P в групата LCKD, което може да предполага разграждане на гликогена чрез повишаване на кетогенната диета в кетонни тела. G1P, получен от гликоген чрез гликоген фосфорилаза, играе важна роля в гликолизата, синтеза на пентоза, генерирането на АТФ и синтеза на мастни киселини 54. Друг метаболит, 2-изопропилмалова киселина, междинен продукт на метаболизма на пируват, синтезиран от ацетил-КоА, е увеличен от LCKD, въпреки че е регулиран надолу в клетките, иницииращи рак на дебелото черво 55 .
Проучванията при животни показват повишен процент на преживяемост с кетогенна спрямо некетогенна диета; обаче малко клинични проучвания при хора са изследвали това 61. Противораковите ефекти на кетогенните диети са доказани при проучвания върху животни чрез ясно намаляване на туморната маса 61. Кетогенна диета (C: P: F = 0,76%: 8,36%: 78,8%) намалява растежа на тумора и подобрява преживяемостта в сравнение със стандартна диета с чау (състав неизвестен) при мишки, имплантирани в клетъчен рак на глиома (средни дни на оцеляване: кетогенна диета = 25 дни, стандартна диета = 19 дни) 62. Кетогенна диета, допълнена с омега-3 мастни киселини и MCT (C: P: F = 0,2%: 13,0%: 35,5%), забавя образуването на тумор при мишки, имплантирани от човешки стомашен рак, в сравнение със стандартна диета (C: P: F = 36,4%: 23,8%: 7,0%) (g/100 g диета) 63. LCKD може да осигури противоракови ефекти чрез намаляване на разпространението на остатъчни следоперативни ракови клетки. Въз основа на настоящото проучване е необходимо проспективно рандомизирано клинично проучване, оценяващо въздействието на LCKD върху преживяемостта при пациенти с панкреатобилиарни ракови заболявания.
Въпреки че настоящото проучване е фаза I проспективно клинично изпитване, демонстриращо безопасността и осъществимостта на следоперативната употреба на LCKD и неговите ефекти върху метаболомиката на пациенти с панкреатобилиарен рак, има няколко ограничения за това проучване. Първо, изследваната популация е малка поради високия процент на изключване и оттегляне. Измерването на кетонни тела може да е осигурило по-голяма представа, ако е по-често и използвайки други източници (напр. Урина). Настоящият метаболомичен анализ беше силно валидиран от модела OPLS-DA, което предполага, че нашите резултати показват значителни разлики между GD и LCKD. Като ново метаболомично проучване за прилагането на диетична интервенция след операция при пациенти с рак, нашите резултати могат да предоставят полезни данни за по-нататъшни изследвания.
В обобщение, нашето проучване успешно демонстрира, че LCKD с 80% kcal от мазнини индуцира умерена кетоза чрез увеличаване на следоперативните серумни общи кетони и β-хидроксибутират при пациенти с рак. В допълнение, LCKD може да върне някои биомаркери на метаболит на рак на панкреаса, като C22: 1-керамид, lysoPC (18: 2), пикочна киселина, цитрулин и инозин и може също да повлияе на метаболизма на въглехидратите, аминокиселините и витамините . LCKD, използван в нашето проучване, може да осигури потенциални ползи за пациенти с панкреатобилиарен рак, които са подложени на панкреатектомия. По-нататъшни изследвания са задължителни, за да се установят ефектите от промените в серумния метаболит, индуцирани от LCKD.
Наличност на данни
Всички данни, генерирани или анализирани по време на това проучване, са включени в тази публикувана статия и нейния допълнителен информационен файл.
- Захароза в диетата на пациенти с диабет - просто още един въглехидрат SpringerLink
- Пълнотекстово въздействие на хранителни вещества от кетогенна диета върху метаболитни параметри при пациенти с
- Странични ефекти на кетогенната диета
- Средиземноморска диета при пациенти с остър исхемичен инсулт Връзки между средиземноморската диета
- Размисли за проблемно раждане - би ли могло да бъде избегнато с кетогенно хранене Diet Doctor