Резюме
Заден план
Нарушеният миокарден перфузионен резерв (MPR) е преобладаващ при затлъстяване и диабет, дори при липса на обструктивна коронарна артериална болест (CAD) и е прогностичен за нежелани събития. Опитахме се да установим времевия ход на намалената MPR и да изследваме свързаните съдови и тъканни свойства при мишки, хранени с високомаслена диета (HFD), тъй като те са нововъзникващ модел на човешко затлъстяване, диабет и намален MPR без обструктивна CAD.
Методи
Мишки C57Bl/6, хранени с HFD или диета с ниско съдържание на мазнини (контрола), са изобразени на 6, 12, 18 и 24 седмици след диетата. Протоколът за сърдечно-съдов магнитен резонанс (CMR) включва многослойно киноизображение за оценка на фракцията на изтласкване (EF), маса на лявата камера (LV), дебелина на стената на LV (LVWT) и LV обеми и CMR за първо преминаване за количествено определяне на MPR . Оценяват се също коронарна съдова реактивност, аортна атеросклероза, капилярна плътност на миокарда и фиброза на тъканите.
Резултати
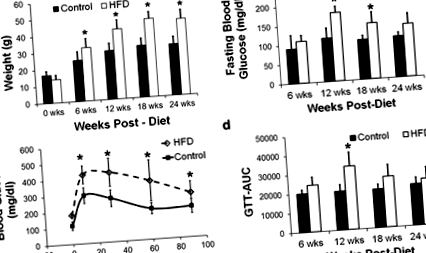
Телесното тегло се повишава при HFD мишки на 6–24 седмици след диетата (стр
Заден план
В продължение на няколко десетилетия преобладаващата практика за лечение на исхемична болест на сърцето приравнява миокардната исхемия към обструктивна коронарна артериална болест (ИБС) [1]. Съответно, повечето терапии за миокардна исхемия имат за цел да премахнат коронарните стенози. Съществуват обаче все повече доказателства, че не всички пациенти с исхемия имат обструктивна ИБС и е предложена промяна на парадигмата [1]. Възникващата концепция е, че множество фактори, включително микроваскуларно заболяване, коронарен вазоспазъм и други, могат да допринесат значително за исхемията на миокарда и че обструктивната ИБС е една от многото потенциални причини [1]. Всъщност проучванията показват, че миокардната исхемия при липса на обструктивна ИБС се среща със значително разпространение при определени популации пациенти, включително диабетици [2], затлъстяване [3], метаболитен синдром [4] и жени [5].
Наличието и тежестта на миокардната исхемия могат да бъдат оценени количествено чрез изобразяване на миокарден перфузионен резерв (MPR) с помощта на PET или сърдечно-съдов магнитен резонанс (CMR). Доказано е, че намалената MPR е прогностична за неблагоприятни сърдечно-съдови събития и независим предиктор за сърдечната смъртност при пациенти със и без обструктивна ИБС [6]. Едно скорошно проучване с повече от 1000 пациенти с диабет и 1600 пациенти без диабет показа, че пациентите с диабет без обструктивна ИБС, но с нарушена MPR имат същата честота на събитията като пациенти без диабет с предишна ИБС [2]. При липса на обструктивна CAD, нарушената MPR до голяма степен отразява дисфункцията на съдовите съдове на микроваскулатурата. Докато микроваскуларната дисфункция води до намален MPR и повишен сърдечносъдов риск, механизмите, лежащи в основата на микроваскуларната дисфункция, не са напълно изяснени и не са установени съответни стратегии за лечение.
Моделите на мишки се използват широко в сърдечно-съдовите изследвания за изследване на основните молекулярни механизми, а мишките, хранени с диета с високо съдържание на мазнини (HFD), се появяват като общ модел на човешко затлъстяване и диабет. Неотдавнашно проучване характеризира дългосрочните ефекти на HFD върху сърдечно-съдовата система при мишки и установи, че мишките, хранени с HFD за 8-16 месеца, развиват затлъстяване, хипергликемия, хиперинсулинемия, инсулинова резистентност, кардиомиоцитна хипертрофия и дезадаптации в сърдечния метаболизъм [7]. Друго скорошно проучване използва CMR, за да покаже, че HFD мишките развиват диастолна дисфункция след 20 седмици диета [8]. В допълнение, наскоро използвахме CMR с перфузионно усилване за първи път, за да демонстрираме, че HFD мишките са нарушили MPR на 24 седмици след започване на диетата [9]. В настоящото проучване ние се опитахме да установим времевия ход и да изследваме съдовите и тъканните свойства, лежащи в основата на прогресията на увеличената маса на LV и намалената MPR при HFD мишки.
Методи
Експериментален дизайн
Работа с животни
Всички проучвания върху животни са извършени по протоколи, които отговарят на Ръководството за грижа и използване на лабораторни животни (публикация NIH № 85–23, Ревизирана 1996 г.) и са одобрени от Комитета по грижа и употреба на животните в нашата институция. Създаден е постоянен катетър на опашната вена за доставяне на Gd-DTPA (Magnevist, 0,1 mM/kg телесно тегло) и Regadenoson (Lexiscan, Astellas Pharmis, 0,1 μg/g телесно тегло) по време на CMR. Телесната температура се поддържа на 36 ± 0,5 ° C и анестезията се поддържа, като се използва 1,1–1,25% изофлуран в O2. Телесното тегло се записва за всички животни преди започване на диетите и в началото на всяко образно изследване.
Тестове за толерантност към глюкоза
За GTTs [12], мишките се инжектират интраперитонеално с 1 g/kg глюкоза в milli-Q вода след гладуване през нощта за 15-16 часа. Взема се кръвна проба от опашната вена преди инжектиране на глюкоза за измерване на кръвната глюкоза на гладно и 10, 30, 60 и 90 минути след инжектирането на глюкозния разтвор. Площта под кривата (AUC) беше изчислена, за да се оцени толерантността към глюкозата, като се използва трапецовидното правило [7].
Придобиване на CMR
Съдова реактивност
След 26 седмици на диета, подгрупа от HFD и контролни мишки бяха евтаназирани и коронарните артерии (н ≥ 4) от втория арборизиран клон от лявата коронарна артерия бяха изолирани (диаметърът на лумена = 90,9 ± 9,5 μm). Артериите бяха освободени от околните сърдечни миоцити и бяха поставени в артериограф (Danish MyoTechnology, DMT, Ann Harbor, MI), където бяха канюлирани в двата края и под налягане до 40 mmHg, както беше описано по-рано [16–18]. Кумулативните дозови реакции към аденозин и ацетилхолин и постепенно повишаване на налягането за оценка на пасивния тонус бяха измерени, както е описано по-рано [16–18].
Хистология
Мишките бяха евтаназирани за хистология (н = 5, всяка група), сърцата бяха събрани и средната част на вентрикуларните късоосни секции (с дебелина 3 mm) бяха фиксирани в 4% параформалдехид за 4 часа и след това вградени в парафин. Секции (с дебелина 5 μm) бяха оцветени с анти-CD31 антитяло (Santa Cruz Biotechnology) за количествено определяне на капилярната плътност и Masson’s Trichrome за количествено определяне на интерстициална фиброза и периваскуларна фиброза. За оценка на системната атеросклероза възходящите аорти бяха изрязани и оцветени със Судан IV.
За хистология се извършва анализ на изображението, като се използва ImageJv1,49 g (NIH). Количественото определяне на плътността на капилярите беше извършено на 6 произволни полета (40x) и капилярите и кардиомиоцитите бяха преброени с помощта на функцията „анализиране на частици“ в ImageJ. Количествено определяне на интерстициалната фиброза беше извършено на 15 произволни полета (40x) (без кръвоносните съдове) и беше използван метод за определяне на прага за количествено определяне на площта, заета от колаген като процент [19]. Количествено определяне на периваскуларна фиброза се извършва на 2 артерии на мишка (40x) и се записва средната периваскуларна колагенна площ, нормализирана към луминалната зона на съда. Площта на аортната плака, количествено определена с помощта на ImageJ, се изразява като процент от площта на аортния съд.
Анализ на MR изображения
Статистически анализ
Статистическият анализ беше извършен с помощта на SigmaPlot (Systat Software Inc., Point Richmond, CA). Разликите в телесното тегло, EDV, ESV, EF, LV маса, LV EDWT, LV ESWT, перфузия в покой, перфузия на стрес, MPR, глобална Ecc, Ecc-subepi, Ecc-subendo и CURE бяха анализирани с помощта на двупосочен анализ на многократни измервания на дисперсия (ANOVA). Всички стойности в текста, таблиците и графиките са представени като средно ± стандартно отклонение.
Резултати
Тестове за телесна маса и глюкозен толеранс
Телесното тегло беше значително по-високо при HFD мишките на 6 седмици след диетата и постепенно се увеличаваше с времето (Фиг. 1а, стр Фиг. 1
Перфузия
Фигура 2а показва примерни перфузионни изображения, получени от сърце на мишка. Няма разлика в измерванията на перфузията на останалите между двете групи мишки в нито една от точките от времето (фиг. 2б). Въпреки това, перфузията на стреса при HFD мишките е намалена в сравнение с контролните мишки на 18 и 24 седмици след диетата (Фиг. 2в, стр Фиг. 2
Структура и функция на НН
Фигура 3а показва примерни изображения на черноморска кинематография, получени от контролна и HFD мишка при ED и ES на 18 седмици след диетата. LV масата е значително по-висока при HFD мишки в сравнение с контролните мишки на 18 и 24 седмици след диетата (Фиг. 3b, стр Фиг. 3
Кръвно налягане и сърдечна честота
Установено е, че систоличното кръвно налягане на 25 седмици след диетата е 106 ± 7 mmHg в контролната група и 110 ± 7 mmHg в групата с HFD. Установено е, че диастоличното кръвно налягане на 25 седмици след диетата е 81 ± 8 mmHg в контролната група и 80 ± 9 mmHg в групата с HFD. Тези разлики не са статистически значими. Също така няма значителни разлики в сърдечната честота между двете групи мишки за целия период на проучването (Таблица 1).
Съдова реактивност
Кривите на кумулативната доза-отговор към аденозин показват значително намалена способност на артериолите да се разширяват при мишки, хранени с HFD в продължение на 26 седмици (Фиг. 4а, стр Фиг. 4
Хистология
Фигура 5 показва примерни CD31 оцветени изображения от контрола (фиг. 5а) и HFD сърце на мишка (фиг. 5б). Няма значителни разлики в броя на капилярите на кардиомиоцит между двете групи мишки (фиг. 5в). Освен това не е имало аортна атеросклероза нито при контролни, нито при HFD мишки. Установено е, че аортната плака е 3,7 ± 1,8% при контролните мишки и 3,2 ± 1,4% при HFD мишките. Фигура 5 показва оцветени от Trichrome участъци на миокарда на Masson, получени от контролна мишка (фиг. 5г) и HFD мишка (фиг. 5д). Установихме повишена интерстициална фиброза при HFD мишки (Фиг. 5е, стр Фиг. 5
Дискусия
Резултатите от нашата съдова реактивност са в съответствие с предишни проучвания на Yamamoto et al. [32] и Calligaris et al. [7], които са показали нарушена ендотел-зависима релаксация при изрязани гръдни аорти в отговор на ацетилхолин при HFD мишки на 17 седмици и на 8-16 месеца след диетата. Освен това, тези резултати са в съответствие с предишни проучвания, които съобщават за нарушена коронарна ендотелна функция при пациенти със затлъстяване [3, 33].
Предишни проучвания са използвали мишки C57Bl/6 с различни специфични диетични състави за изследване на ефектите на затлъстяването, диабета и метаболитния синдром върху сърдечната функция [7, 8, 11, 32, 34–37]. Диетите се различават по отношение на процента калории от мазнини (30–78%), както и по отношение на количествата въглехидрати, протеини, мастни киселини и захар [38]. Специфичният хранителен състав може да промени степента на наддаване на тегло и метаболитната патофизиология. Отчасти поради разнообразието от диети, предишни проучвания, изследващи ефекта на HFD върху сърдечната функция, са дали противоречиви резултати [8, 26, 34].
С течение на времето на настоящото проучване три HFD мишки и една контролна мишка умряха. Мишките са умрели между сесиите за изображения, а не по време на CMR или тестове за толерантност към глюкоза. Една от умрелите диети с високо съдържание на мазнини е развила коремен тумор, а другите две диети с високо съдържание на мазнини са имали малки коремни лезии. Включително настоящото проучване, както и други проучвания в нашата лаборатория, имаме повече от 60 мишки в протоколи с 24 седмици HFD хранене и тези три са единствените смъртни случаи. Също така много рядко мишките на контролната диета умират. Освен умрелите мишки, всички останали мишки в настоящото проучване обикновено са здрави, с изключение на това, че HFD мишките са със затлъстяване.
Заключение
Използвайки CMR, GTT, съдова реактивност и хистологични проучвания, ние показахме, че мишките C57Bl/6, хранени с HFD в продължение на 18–24 седмици, са със затлъстяване и прогресивно увеличават LV масата, постепенно намаляват MPR, непоносимост към глюкоза, интерстициална фиброза и намалена коронарна артериола реактивност с нормална капилярна плътност и без аортна плака. Тези проучвания установяват мишки, хранени с HFD като моделна система за клиничния сценарий на пациенти със затлъстяване и диабет с намален MPR при липса на значима коронарна артериална болест. Бъдещи проучвания, използващи CMR и генно модифицирани мишки, хранени с HFD, могат да хвърлят светлина върху ключовите молекулярни механизми, които са в основата на миокардната исхемия при затлъстяване и свързана с диабета кардиомиопатия.
- Асоциация между развода и рисковете за остър миокарден инфаркт, сърдечно-съдова циркулация
- Благоприятни сърдечно-съдови плейотропни ефекти на циркулацията на статини
- Асоциации между централното затлъстяване с нормално тегло и рисковите фактори за сърдечно-съдови заболявания в
- Асоциация на тютюнопушенето, алкохола и затлъстяването със сърдечно-съдовата смърт и исхемичния инсулт в
- Диетата с умерени въглехидрати с растителен протеин е обратно свързана със сърдечно-съдовия риск