Резюме
Заден план
Затлъстяването е основен рисков фактор за крайния стадий на бъбречно заболяване. Използвайки мишки с преходен потенциален ванилоид 1 с нокаут (TRPV1 -/-), тествахме хипотезата, че TRPV1 предпазва от затлъстяване, причинено от обостряне на увреждане на бъбречната исхемия и реперфузия (I/R).
Методи
TRPV1 -/- и мишки от див тип (WT) бяха хранени с чау или западна диета (WD) в продължение на 22–23 седмици. След това мишките бяха подложени на увреждане на бъбреците I/R и бяха измерени бъбречно-кортикален кръвен поток (CBF) и медуларен кръвен поток (MBF).
Резултати
Западната диета значително увеличи телесното тегло и нивата на кръвната захар на гладно както при TRPV1 -/-, така и при WT мишки. Индуцираното от WD увреждане на глюкозния толеранс се влошава при TRPV1 -/- мишки в сравнение с WT мишки. Приемът на WD удължава времето, необходимо за достигане на пикова реперфузия в кората и медулата (и двете P -/- мишки (всички P -/- мишки и WD атенюирано освобождаване на CGRP при WT мишки. Освен това, блокадата на CGRP рецепторите нарушава регионалния бъбречен кръвен поток и бъбречната функция при WT мишки, ранени от WT.
Заключение
Тези резултати показват, че TRPV1 играе защитна роля при обостряне на WD при бъбречно увреждане I/R, вероятно чрез засилване на освобождаването на CGRP и увеличаване на бъбречния кръвоток.
Въведение
Затлъстяването е основен рисков фактор за диабет и хипертония (Hall, 2003; Steinberger & Daniels, 2003), които заедно представляват 70% от всички случаи на краен стадий на бъбречно заболяване (Collins et al., 2005; Griffin, Kramer & Bidani, 2008). Нараняването с исхемия-реперфузия (I/R) е често срещана причина за остро увреждане на бъбреците (AKI) в различни клинични условия (Lameire, Van Biesen & Vanholder, 2006). AKI се среща при приблизително 7% от хоспитализираните пациенти (Nash, Hafeez & Hou, 2002) и е свързан с обща смъртност от 40–60% при критично болни пациенти (Uchino et al., 2005). Приемът на западна диета (WD) води до затлъстяване, влошава хроничното възпаление и засилва острото бъбречно исхемично увреждане (Kelly, Burford & Dominguez, 2009).
Преходният рецепторен потенциал ванилоид 1 (TRPV1) е лиганд-неселективен йонен канал, който може да се активира от множество дразнители, включително вредна топлина, ниско рН и химични дразнители като капсаицин (Caterina et al., 2000; Julius & Basbaum, 2001). TRPV1 се експресира предимно в немиелинизирани С-влакна и тънко миелинизирани A-аферентни нервни влакна, които инервират вътрешни органи, включително бъбреците (Caterina et al., 2000; Julius & Basbaum, 2001). Активирането на TRPV1 причинява освобождаване на невропептиди, включително свързан с калцитонин ген пептид (CGRP) и вещество Р с мощни съдоразширяващи ефекти (Wang, 2005), както и натриуретични и диуретични ефекти (Arendshorst, Cook & Mills, 1976; Shekhar et al., 1991 ). Бъбрекът се инервира от гъста мрежа от CGRP-положителни сензорни нерви (Chai et al., 1998). За разлика от много други вазодилататори, CGRP увеличава бъбречния кръвоток и гломерулната филтрация (Shekhar et al., 1991). Дефицитът на TRPV1 води до засилено I/R нараняване (Huang et al., 2009), което предполага, че TRPV1 играе важна роля при бъбречно увреждане (Levite et al., 1998, Okajima & Harada, 2006).
Преходният рецепторен потенциал ванилоид 1 е тясно свързан и взаимодейства със затлъстяването (Gram, Holst & Szallasi, 2017). Затлъстяването уврежда вазодилатацията, медиирана от сензорни нерви (Davidson et al., 2010, Haddock & Hill, 2011). Баскаран и др. (2017) съобщават, че индуцираното от диетата затлъстяване потиска експресията на TRPV1 в мастната тъкан. В допълнение, Kentish et al. (2015) демонстрира, че ганглиозният TRPV1 е инактивиран при затлъстели мишки, индуцирани от диета с високо съдържание на мазнини. Освен това, дефицитът на TRPV1 изостря индуцираното от диетата затлъстяване и инсулиновата резистентност (Lee et al., 2015). По този начин приемът на WD може да наруши експресията или функцията на TRPV1, което води до по-тежко бъбречно увреждане I/R, а дефицитът на TRPV1 може да влоши бъбречното увреждане I/R. В това проучване тествахме хипотезата, че индуцираното от приема на WD затлъстяване влошава възстановяването на бъбреците I/R и че аблацията TRPV1 усилва бъбречното увреждане на перфузията и впоследствие влошава възстановяването на бъбречната функция.
Материали и методи
Изследвания за хранене и лекарства
Използвани са мъжки TRPV1 ген нокаут (TRPV1 -/-) щам B6.129S4-TRPV1 tm1Jul и див тип (WT) щам C57BL/6J мишки (Jackson Laboratory, Bar Harbor, Maine). Телесното тегло се наблюдава от 3 до 23 седмична възраст, докато и двата щама на мишките имат свободен достъп до диета с чау (con; 8664; Harlan Teklad, Madison, WI, USA) или (WD; 42% kcal от мазнини; 88,137, Harlan Teklad ) и чешмяна вода по време на експериментите. Мишките се поддържат в нормален цикъл светлина/тъмнина. Приемът на храна и телесното тегло се измерват веднъж седмично. Всички експериментални процедури са одобрени от Институционалния комитет по грижа и употреба на животните на Мичиганския държавен университет (08/14-141-00).
Интраперитонеално тестване на глюкозен толеранс
Експерименталните мишки бяха на гладно (лишени от храна, но даваха вода) в продължение на 15 часа, след което глюкоза (два g/kg телесно тегло) беше приложена чрез интраперитонеална инжекция на съзнателни мишки. Кръв от опашка на вените се взема за определяне на глюкоза с помощта на глюкометър Accu-Chek (Roche Diagnostics, Mannheim, Германия) на 0, 30, 60 и 120 минути след прилагане на глюкоза. Площите под кривата (AUC) за глюкозен толеранс се изчисляват според трапецовидното правило от измервания на глюкозата при 0, 30, 60 и 120 минути. Глюкозният толеранс се определя като AUC срещу крива на времето, изчислена с правилото на трапеца.
Western blot анализ
Протеините се екстрахират от бъбречни тъкани с лизисен буфер, съдържащ протеазни инхибитори (Sigma, St. Louis, MA, USA). Общите протеини се разделят върху 10% натриев додецил сулфат-полиакриламиден гел и се прехвърлят в мембрана от поливинилиден дифлуорид. Мембраните бяха блокирани 1 h при стайна температура в 5% обезмаслен млечен разтвор за измиване (50 mM Tris-HCl, 100 mM NaCl, 0.1% Tween 20, pH 7.5). След това мембраните бяха инкубирани със заешки анти-TRPV1 поликлонален IgG (1: 1,000, ab6166; Abcam, Кеймбридж, МА, САЩ) и анти-заешки IgG-HRP (1: 5,000, Santa Cruz Biotechnology, Dallas, TX, USA). Мембраните бяха визуализирани с подобрена система за откриване на хемилуминесценция (ECL; Amersham Biosciences, Piscataway, NJ, USA) и изложени на филми (Hyperfilm-ECL; Amersham Pharmacia Biotech, Little Chalfont, UK). Плътностите бяха определени с помощта на Image J 1.46 (NIH) и нормализирани до общото количество глицералдехид 3-фосфат дехидрогеназа, заредено във всяка ямка.
Анализ на 8-изопростан в урината
В края на 23-седмичното диетично лечение, мишките бяха поставени в клетки за метаболизъм на мишки за 24 часа събиране на урина. Нивата на 8-изопростан в урината бяха определени с помощта на комплект (Cayman Chemical, Ann Arbor, MI, USA).
Модел на бъбречна исхемия-реперфузия
Измерване на лактат дехидрогеназа в урината
След реперфузия урината се събира чрез катетър, поставен в пикочния мехур, и пробите се държат при -80 ° C до анализ. Лактат дехидрогеназата (LDH) беше измерена с помощта на комплект за анализ на активността на LDH (Biovision, Сан Франциско, Калифорния, САЩ).
Оценка на бъбречната функция
Бъбречната функция се оценява чрез измерване на плазмената концентрация на креатинин и урея. Плазмените проби бяха събрани и измерени с помощта на стандартни комплекти за анализ (Биовизия).
Измерване на CGRP
Плазмата се събира и след това CGRP се пречиства и анализира, използвайки комплект за радиоимуноанализ на плъх CGRP. Анализът е извършен според препоръките на доставчика (Peninsula Laboratories Inc., Belmont, CA, USA).
Статистически анализ
Всички стойности са изразени като средна стойност ± SEM. Различията между групите бяха извършени чрез еднопосочен дисперсионен анализ, последван от тест за множество сравнения на Tukey-Kramer. Разликите между две групи бяха извършени от т-тестове. Резултатите се считат за статистически значими при P
Резултати
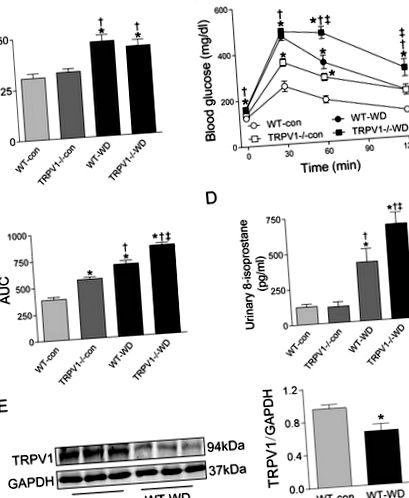
Нокаутът на TRPV1 изостри WD-индуцирана глюкозна непоносимост и оксидативен стрес
На 23 седмици приемът на WD увеличава телесното тегло както при WT, така и при TRPV1 -/- мишки, в сравнение с групите с диу чау (и двете P -/- мишки, хранени или с чау, или с WD (фиг. 1А). По същия начин нивата на глюкозата на гладно са значително по-високи в групите с WD и в двата щама (P -/- мишки (фиг. 1В). За разлика от това, индуцираното от WD увреждане на глюкозния толеранс се изостря при TRPV1 -/- мишки в сравнение с WT мишки (P -/- мишки в сравнение с WT мишки (P
Фигура 1: Телесно тегло, глюкозен толеранс, оксидативен стрес и експресия на TRPV1.
Нокаут на TRPV1 изостри предизвиканото от WD увреждане на възстановяването на бъбречния кръвен поток
След I/R, TRPV1 -/- мишките на чау диета значително намаляват степента на възстановяване на CBF и MBF и увеличават времето до пикова реперфузия в сравнение с WT мишки на чау диета, което предполага, че TRPV1 аблация намалява бъбречното I/R възстановяване (Фиг. 2 ). Както се очаква, приемът на WD намалява степента на възстановяване на CBF и MBF и увеличава времето до пикова реперфузия след увреждане на бъбречната I/R и при двата щама, с по-голямо намаляване на скоростта на възстановяване и допълнително увеличаване на времето до пикова реперфузия при TRPV1 -/- мишки (Фиг. 2).
Фигура 2: Скорост на възстановяване на бъбречния кръвен поток и време до пикова реперфузия.
Нокаут на TRPV1 изостри WD-индуцирана бъбречна дисфункция
При мишки, подложени на бъбречно увреждане I/R, приемът на WD повишава LDH активността, плазмения креатинин и азота на уреята в кръвта (BUN) и в двата щама (всички P -/- мишки в сравнение с WT мишки (всички P
Фигура 3: Бъбречно увреждане и функция.
CGRP допринася за възстановяване на бъбречната I/R
Нивата на CGRP в плазмата нямат значителни разлики между WT и TRPV1 -/- мишки с чау или WD диета. Бъбречната I/R увеличава освобождаването на CGRP при WT мишки, но не и при TRPV1 -/- мишки. Освен това WD отслабва I/R-индуцираното освобождаване на CGRP при WT мишки (Фиг. 4А). При WT мишки на чау диета CGRP8–37 доведе до значително намаляване на степента на възстановяване на CBF и MBF и забележително увеличение на времето до пикова реперфузия. Освен това лечението с CGRP8–37 повишава нивата на LDH, BUN и плазмения креатинин в урината при WT мишки (Фиг. 4B – 4F).
Фигура 4: Ефекти на CGRP 8–37 върху бъбречния кръвоток и функция.
Дискусия
В настоящото проучване установихме, че приемът на WD причинява глюкозна непоносимост, оксидативен стрес и нарушава възстановяването на бъбречния кръвоток и бъбречната функция след I/R увреждане, които се изострят при TRPV1 -/- мишки в сравнение с WT мишки. Бъбречната I/R увеличава освобождаването на CGRP при WT мишки, което е притъпено от приема на WD. Блокадата на CGRP рецепторите нарушава бъбречния регионален кръвен поток и бъбречната функция след I/R при WT мишки. За разлика от това, освобождаването на CGRP не се променя при мишки TRPV1 -/- след бъбречно увреждане I/R.
Преходният рецепторен потенциал ванилоид 1 играе важна роля при индуцирано от диетата затлъстяване и непоносимост към глюкоза (Lee et al., 2015). Установихме, че TRPV1 -/- мишките имат непоносимост към глюкоза дори на контролна диета, докато 8-изопростанът в урината е нормален в сравнение с WT мишките. Предишни проучвания демонстрират, че активирането на TRPV1 може да предизвика секреция на инсулин (Mori et al., 2018). Следователно, индуцирана от TRPV1 дефицит на глюкозна непоносимост вероятно се дължи на нарушена секреция на инсулин, а не на оксидативен стрес. Това може да е и причина, поради която индуцираната от диетата непоносимост към глюкоза се засилва при TRPV1 -/- мишки.
Общото намаляване на бъбречния кръвен поток допринася за намалена скорост на гломерулна филтрация (GFR) при исхемичен AKI (Alejandro et al., 1995). Нашите предишни проучвания показаха, че активирането на TRPV1 повишава GFR и бъбречната екскреторна функция (Li & Wang, 2008), което предполага, че TRPV1 аблация може допълнително да намали GFR и бъбречната екскреторна функция по време на I/R. Други проучвания показват, че активирането на TRPV1 засилва съдовата релаксация, зависима от ендотел (Yang et al., 2010) и приемът на WD нарушава ендотелната функция (Vogel, Corretti & Plotnick, 1997), което предполага, че аблация TRPV1 може да намали възстановяването на бъбречния кръвоток след бъбречна I/R чрез директно увреждане на зависимата от ендотел релаксация.
Респирацията на исхемия може да увеличи ендогенните TRPV1 агонисти, като 20-HETE аналози, за които е доказано, че увеличават бъбречния кръвоток по зависим от дозата начин (Oyekan, 2005). Освен това, аналозите на 20-HETE имат защитни ефекти при експериментален бъбречен I/R (Regner et al., 2009). Аблация на TRPV1 или прием на WD може да наруши благоприятните ефекти на ендогенните TRPV1 агонисти по време на I/R, което води до намален бъбречен кръвоток и бъбречна дисфункция.
Заключение
В обобщение, тези резултати предполагат, че TRPV1 може да играе защитна роля при увреждане на бъбреците I/R при затлъстяване, вероятно чрез засилване на бъбречния кръвоток чрез увеличаване на освобождаването на CGRP.
- Схемата на хранене на генетично затлъстели (obob) мишки - ScienceDirect
- Установено е, че динените добавки са в полза на затлъстели мишки
- Динените добавки носят ползи за здравето на затлъстелите мишки - ScienceDaily
- Седмичното приложение на рапамицин подобрява преживяемостта и биомаркерите при затлъстели мъжки мишки с високо съдържание на мазнини
- Развитието на диета, предизвикано от затлъстяване и непоносимост към глюкоза при мишки C57Bl6 при диета с високо съдържание на мазнини