Теодор ДеМартини
отдел по медицина за критични грижи, Катедра по педиатрия, Медицински център за детска болница в Синсинати, Медицински колеж на Университета в Синсинати, Синсинати, Охайо
Марчеле Ноуъл
отдел по медицина за критични грижи, Катедра по педиатрия, Медицински център за детска болница в Синсинати, Медицински колеж на Университета в Синсинати, Синсинати, Охайо
Жана Джеймс
b Отдел по молекулярна сърдечно-съдова биология, Катедра по педиатрия, Медицински център за детска болница в Синсинати, Медицински колеж на Университета в Синсинати, Синсинати, Охайо 3333 Burnet Avenue, MLC 2005, Синсинати, Охайо, САЩ 45229
Лорън Уилямсън
отдел по медицина за критични грижи, Катедра по педиатрия, Медицински център за детска болница в Синсинати, Медицински колеж на Университета в Синсинати, Синсинати, Охайо
Патрик Лахни
отдел по медицина за критични грижи, Катедра по педиатрия, Медицински център за детска болница в Синсинати, Медицински колеж на Университета в Синсинати, Синсинати, Охайо
Хуей Шен
отдел по медицина за критични грижи, Катедра по педиатрия, Медицински център за детска болница в Синсинати, Медицински колеж на Университета в Синсинати, Синсинати, Охайо
Дженифър М. Каплан
отдел по медицина за критични грижи, Катедра по педиатрия, Медицински център за детска болница в Синсинати, Медицински колеж на Университета в Синсинати, Синсинати, Охайо
Резюме
1. Въведение
Сепсисът е водеща причина за смърт при пациенти в интензивното отделение (интензивно отделение) с до 50% смъртност [1, 2]. Сепсисът включва дисфункционален имунен отговор, който може да доведе до нараняване на тъканите и органна недостатъчност [3]. Съпътстващите заболявания, като затлъстяването, усложняват сепсиса чрез увеличаване на хоспитализацията и реадмисиите [4]. Затлъстяването е свързано с хронично възпаление, но в отговор на остра обида като травма, хората със затлъстяване имат депресиран отговор на цитокините в сравнение с лица без затлъстяване [5]. Данните от нашата лаборатория също показват намален отговор на цитокините при затлъстели мишки след сепсис [6]. Освен това мишките със затлъстяване имат по-висока смъртност след сепсис [6, 7].
Повишеното затлъстяване може да промени сърдечната структура и да има вредни ефекти върху сърцето [8]. Mitra et al. показа, че затлъстелите мишки са по-податливи на индуцирана от доксорубицин кардиотоксичност в сравнение с контролите с нормално тегло [9]. В други проучвания обаче затлъстяването е кардиозащитно и мишките със затлъстяване имат намален размер на инфаркта след инфаркт на миокарда в сравнение с мишки без затлъстяване [10]. Освен това, проучвания при хора със затлъстяване и сърдечни заболявания показват по-ниска смъртност при пациенти със затлъстяване, концепция, наречена „парадокс на затлъстяването“ [11, 12]. Малко се знае за ефектите върху сърцето, предизвикани от затлъстяването, които се появяват по време на сепсис.
Преобразувателят на сигнала и активаторът на транскрипцията (STAT) -3 е важен реагент на острата фаза при сепсис. И лептинът, и интерлевкинът (IL) -6 активират сигналния път на STAT3 и водят до фосфорилиране в едно от двете места, тирозин 705 или серин 727. STAT3 също е важен за индуцирания от стреса отговор на сърцето. Ранното активиране на STAT3 е очевидно в сърцето в отговор на лечението с β-адренергичен рецептор агонист и сърдечно специфично делеция на STAT3 доведе до повишена сърдечна хипертрофия, некроза и апоптоза след хронична β-адренергична стимулация [13]. Затлъстяването също има ефекти върху сърдечната експресия на STAT3, тъй като експресията на STAT3 в сърцето е диференцирано регулирана при миниатюрни прасета Бама, хранени с дългосрочна високоенергийна диета в сравнение с контролите [14]. Супресорът на семейството на сигнализиране за цитокини (SOCS3) действа като отрицателен регулатор на STAT3 [15]. SOCS3 се увеличава при затлъстяване, което води до намаляване на регулирането на фосфорилирането на STAT3 [9]. Тези проучвания предполагат, че пътят STAT3 е важен за сърцето по време на стрес, но се променя при затлъстяване. Като се има предвид значението на STAT3 в реакцията на острата фаза на нараняване, ние се опитахме да определим дали пътят на STAT3 е променен в сърцето по време на сепсис и засегнат от затлъстяване.
2. Материали и методи
2.1 Мишки и диети
Разследването е в съответствие с Ръководството за грижа и използване на лабораторни животни, публикувано от Националния здравен институт на САЩ [16] и е одобрено от Институционалния комитет по грижа и употреба на животните в Медицинския център за детска болница в Синсинати. Експерименталните групи се състоят от мъжки мишки C57BL/6 на шестседмична възраст, доставени от Charles River Laboratories International, Inc. (Wilmington, MA). Мишките бяха настанени в съоръжението за животни в Фондацията за изследване на децата в Синсинати (CCRF). Храната и водата бяха осигурени по желание. Животните бяха рандомизирани на диета с високо съдържание на мазнини (HFD) (TestDiet - 58Y1) (60% kcal, осигурена от мазнини) или нормална диета (ND) (Formulab - 5008) (16% kcal, осигурена от мазнини) в продължение на 6 седмици.
2.2. Тегло и състав на тялото
Теглото на тялото се проследява веднъж седмично по време на диетичната фаза на проучването. За да определим количествено мастната маса, анализирахме телесния състав в края на 6-седмичната фаза на диетата, използвайки ЯМР изображения от анализатори на телесния състав на EchoMRI (EchoMRI, Houston, Tx).
2.3. Модел на мишка за лигиране и пункция на целуса (CLP)
Мишките бяха хранени с HFD или ND в продължение на 6 седмици и след това бяха подложени на CLP, за да предизвикат полимикробен сепсис, както беше описано по-горе [17]. Мишките бяха упоени с изофлуран. Коремът беше отворен и цекумът екстериоризиран и лигиран чрез 6,0 лигатура в основата му. Проведена е техника на двойна пункция с 22g игла и фекален материал се експресира в перитонеума. Коремният разрез беше затворен с течно лепило за локално приложение. Животните бяха реанимирани с течност със стерилен физиологичен разтвор (0.6 ml), инжектиран подкожно и получиха имипенем (25 mg/kg) за антимикробно покритие. Плазма и цяла сърдечна тъкан се събират на 6 часа след CLP за биохимични изследвания, описани по-долу.
2.4. Тропонин I
Плазма е получена от мишки по време на жертвоприношение. Плазменият сърдечен тропонин I (cTnI) е количествено определен с помощта на високочувствителния сърдечен тропонин-I ELISA комплект (Life Diagnostics, West Chester, PA).
2.5. Измерване на активността на миелопероксидазата
Активността на миелопероксидазата се определя като индекс на натрупване на неутрофили, както беше описано по-рано [18]. Тъканите се хомогенизират в разтвор, съдържащ 0,5% хекса-децил-триметил-амониев бромид, разтворен в 10 mM калиев фосфатен буфер (рН7) и се центрофугират за 30 минути при 4000 × g при 4 ° С. Аликвотна част от супернатанта се оставя да реагира с разтвор на тетра-метил-бензидин (1.6 тМ) и 0.1 тМ водороден пероксид. Скоростта на промяна в абсорбцията се измерва чрез спектрофотометрия при 650 nm. Активността на миелопероксидазата се определя като количеството ензим, разграждащо 1 μmol водороден пероксид на минута при 37 ° C на 100 mg тегло тъкан.
2.6. Ехокардиографски изследвания
За ехокардиографски анализ беше използвана отделна кохорта мишки. След 6-седмичната диетична интервенция, мишките са упоени с изофлуран и са подложени на CLP. Всички мишки, претърпели CLP, оцеляват до 18 часа и по този начин се подлагат на ехокардиография (п = 8 мишки/група). Ехокардиографията е извършена с помощта на система VisualSonics 2100 (Торонто, Онтарио, Канада), оборудвана с 30-MHz преобразувател, както е описано по-рано [19]. Измерват се директно сърдечната честота, вътрешните размери на лявата камера, включително крайните диастолични и крайните систолични размери, дебелината на интервентрикуларната преграда в диастолата и систолата и дебелината на задната стена на LV в диастолата и систолата.
2.7. Анализ на генната експресия
Анализите RT-qPCR се провеждат съгласно производствения протокол, като се използва PCR анализ на Mouse Prime I-L6/STAT3, който профилира експресията на 96 гена, свързани с IL-6/STAT3 (BioRad каталог # 10034344, Херкулес, Калифорния). Сърдечните проби се хомогенизират в TRIzol (Invitrogen, Grand Island, NY). РНК се транскрибира обратно, като се използва RT 2 First Strand Kit за синтез на cDNA съгласно производствения протокол (Qiagen, Валенсия, Калифорния). Прагът на цикъла е стандартизиран между всички проби. Всяка проба се нормализира до два домакински гена (ΔCT). Нормализирани контролни проби (не-затлъстели несептични мишки) бяха извадени от нормализирани експериментални проби (ΔΔCT). Не-затлъстелите несептични групи бяха определени като контролна група, а не-затлъстелите септични, затлъстели несептични и затлъстели септични групи бяха определени като експериментални групи (n = 4 мишки/група). Промяната на гънките във всяка тъкан се изчислява, използвайки сравнителния CT метод (2-ΔΔ C T). Целостта на анализа се проследява чрез геномна ДНК контрола, 3 контрола за обратна транскрипция и 3 положителни PCR контроли.
2.8. Клетъчно фракциониране и екстракция на ядрен протеин
Проби от сърдечна тъкан се хомогенизират в буфер, съдържащ 0,32 М захароза, 10 mM Tris-HCl, 1 mM етиленгликол тетраоцетна киселина (EGTA), 2 mM етилендиаминтетраоцетна киселина (EDTA), 5 mM NaN3, 10 mM β-меркаптоетанол, 50 mM NaF, 20 μM левпептин, 0,15 μM пепстатин А и 0,2 mM фенилметилсулфонил флуорид (PMSF), 1 mM натриев ортованадат, 0,4 nM микроцистин [20]. Хомогенатите се центрофугират (1000 х g при 4 ° С, 10 минути). Супернатантата (цитозол + мембранен екстракт) се събира и съхранява. Пелетите се разтварят в буфер Triton (1% Triton X-100, 150 mM NaCl, 10 mM Tris-HCl (pH7.4), 1 mM EGTA, 1 mM EDTA, 0.2 mM натриев ортованадат, 20 μM левпептин А и 0.2 mM PMSF). Лизатите се центрофугират (15 000 х g, при 4 ° С, 30 минути) и супернатантата (ядрен екстракт) се събира. Количеството протеин се определя количествено чрез Брадфорд.
2.9. Western blot анализ
Извършен е анализ на ядрени екстракти, освен когато е посочено. Системата за гел електрофореза Invitrogen NuPAGE (Invitrogen) се използва за всички вестерни блотове. NuPAGE 10% Bis-Tris гелове бяха използвани с NuPAGE MOPS буфер и Invitrogen Novex Mini-Cell, BioRad PowerPac 300. Мембрани, изобразени с помощта на BioRad ChemiDoc XRS + система за документиране на гел и анализирани с помощта на ImageLab v5.1 софтуер (BioRad, Hercules, CA). Следните антитела бяха използвани за сондиране на протеини от интерес: STAT3 (Cell Signaling Technologies, Danvers, MA), pSTAT3 (Tyrosine 705) (Cell Signaling Technologies), pSTAT3 (Serine 727) (Cell Signaling Technologies), SOCS3 (Santa Cruz Biotechnology, Inc., Далас, Тексас), gp130 (цитозол) (клетъчни сигнални технологии), бета-актин (ядрен и цитозол) (Santa Cruz Biotechnology, Inc., Далас, Тексас).
2.10. Статистически анализ
Данните бяха анализирани с помощта на Sigmaplot (Systat Systems, Сан Хосе, Калифорния). Стойностите в текста и фигурите се изразяват като средна стойност и стандартна грешка на средната стойност (SEM) за параметрични данни и като среден и интерквартилен диапазон за непараметрични данни. Данните бяха анализирани чрез ANOVA и t-тест за параметрични данни и тест на Ман-Уитни за непараметрични данни. Данните от ехокардиографията бяха анализирани с GraphPad InStat 3 за Macintosh, използвайки несдвоени и сдвоени t-тестове. Значимостта е определена като P ≤ 0,05.
3. Резултати
3.1. Диетичното хранене с високо съдържание на мазнини води до напълняване и увеличаване на мастната маса
След шест седмици хранене с диета с 60% ккал, осигурена от мазнини (срещу 16% при нормална диета), мишките имат значително по-голямо общо наддаване на тегло (11,7 ± 1,9 g срещу 5,0 ± 1,3 g, p Фигура 1) е значително по-високо групата, хранена с HFD (8,0 ± 2,6 g срещу 0,6 ± 0,5 g, p Таблица 1). Мишките претърпяха CLP и оцеляха до 18 часа след CLP и по този начин претърпяха повторна ехокардиография. След сепсис мишките без затлъстяване са имали по-ниски сърдечни честоти в сравнение с изходните и затлъстелите мишки. След сепсис, затлъстелите мишки имат подобрена сърдечна функция, както се доказва от увеличаване на фракционното скъсяване. По този начин, въпреки че мишките със затлъстяване показват лоша функция в началото, сърдечната функция се увеличава в отговор на сепсис.
маса 1
HR = сърдечна честота; IVSd = дебелина на диастолната интервентрикуларна преграда; LVIDs = систолно вътрешно измерение на лявата камера; LVIDd = диастолно вътрешно измерение на лявата камера; FS = фракционно скъсяване на лявата камера; LVM = маса на лявата камера; LVPWd = диастолна дебелина на задната стена на лявата камера.
| HR (bpm) | 442 ± 85 | 437 ± 24 | 325 ± 46 * | 430 ± 25 # |
| IVSd (mm) | 0,85 ± 0,1 | 0,78 ± 0,02 | 1 ± 0,16 | 0,86 ± 0,15 |
| LVID (mm) | 2,53 ± 0,35 | 3.17 ± 0.41 # | 2,27 ± 0,85 | 2,54 ± 0,34 * |
| LVIDd (mm) | 4 ± 0,41 | 4,20 ± 0,35 | 3,51 ± 0,76 | 3,68 ± 0,4 * |
| FS (%) | 34 ± 4 | 25 ± 5 # | 37 ± 10 | 31 ± 4 * |
| LVM (mg) | 96 ± 14,1 | 95,2 ± 14,8 | 91 ± 8 | 84 ± 7 * |
| LVPWd (mm) | 0,74 ± 0,07 | 0,73 ± 0,1 | 0,88 ± 0,23 | 0,77 ± 0,07 |
HR = сърдечна честота; IVSd = дебелина на диастолната интервентрикуларна преграда; LVIDs = систолно вътрешно измерение на лявата камера; LVIDd = диастолно вътрешно измерение на лявата камера; F5 = фракционно скъсяване на лявата камера; LVM = маса на лявата камера; LVPWd = диастолна дебелина на задната стена на лявата камера;.
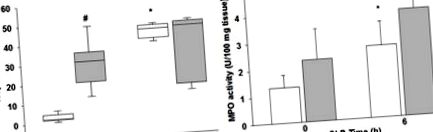
(A) Плазмен сърдечен тропонин I и (B) сърдечна неутрофилна инфилтрация, определена чрез анализ на миелопероксидазата (MPO), бели стълбове/кутии = мишки без затлъстяване, сиви ленти/кутии = мишки със затлъстяване. * p Фигура 3А, централните точки представляват непроменена генна експресия, граничните линии показват 4-кратно прекъсване на генната регулация между пробите със септично затлъстяване и септично затлъстяване. Червената линия показва четирикратно регулиране, а зелената линия - четирикратно регулиране надолу. Изследването на диференциално експресирани гени на 6 часа след CLP показва, че IL-17a е най-регулираният ген (26,5-кратно увеличение) при септично затлъстели мишки в сравнение с септични не-затлъстели мишки (Фигура 3 A&B). IL-17a, Csf2 и IL-10 показват разлики, които представляват повече от удвояване (log 2 промени> 1,0) и които са били статистически значими при P≤0,05 (Фигура 3).
Профилът на генна експресия на 90 гена, свързани с сигнализирането на IL-6/STAT3, се оценява на 6 часа след CLP при затлъстели и не-затлъстели мишки. (А) Централните точки представляват непроменена генна експресия. Граничните линии показват 4-кратно прекъсване на генната регулация между проби със септично затлъстяване и септични не-затлъстявания (червена линия, 4-кратно регулиране; зелена линия 4-кратно понижаване). IL-17a, Csf2 и IL-10 показват разлики, които представляват повече от удвояване (log 2 промени от> 1) и които са били статистически значими при P≤0.05. (B) Относителна експресия на IL-17a, Csf2 и IL-10 при затлъстели септични мишки, нормализирани до не-затлъстели септични мишки. Сива лента = септични мишки със затлъстяване, Бяла лента = септични мишки без затлъстяване. Прекъснатата линия е поставена на 1 за справка. n = 4 мишки/група.
3.5. Затлъстяването променя фосфорилирането на STAT3 при сепсис
Тъй като производството на IL-17 се влияе от активността на STAT3, ние се опитахме да определим дали активирането на STAT3 е диференцирано регулирано при затлъстели и не-затлъстели мишки по време на сепсис. Уестърн блот експресията разкрива, че фосфорилирането на STAT3 при серин 727 е по-високо в ядрените сърдечни екстракти при затлъстели мишки на изходно ниво (0.79 ± 0.15 относителни единици) в сравнение с не-затлъстели мишки (0.3 ± 0.15 относителни единици, p Фигура 4 A&C). След сепсис фосфорилирането на STAT3 при серин 727 се увеличава при затлъстели и не-затлъстели мишки в сравнение с изходното ниво и фосфорилирането на STAT3 при серин 727 остава по-високо при затлъстели мишки в сравнение с не-затлъстели мишки. Western blot анализ, оценяващ ядрено фосфорилиране на STAT3 при тирозин 705, демонстрира сходна експресия на протеин при затлъстели и не-затлъстели мишки на изходно ниво. Фосфорилирането на STAT3 при тирозин 705 се е увеличило значително както при затлъстели, така и при затлъстели мишки след сепсис (0.6 ± 0.4 срещу 11.1 ± 1.7 относителни единици, p Фигура 4 B&D).
- Затлъстяването, предизвикано от диета с високо съдържание на мазнини, увеличава образуването на полипи на дебелото черво, индуцирано от азоксиметан в
- Глутенът изостря образуването на атеросклеротична плака при ApoE– - мишки с диета, индуцирано затлъстяване -
- Как затлъстяването увеличава риска от диабет - ScienceDaily
- Как затлъстяването увеличава увреждането на ставите
- Високо въглехидратната диета може да предизвика затлъстяване и диабет; Храни с ниско съдържание на въглехидрати