Департамент по педиатрия, Университет във Вашингтон и Детски изследователски институт в Сиатъл, Сиатъл, Вашингтон, САЩ
Департамент по педиатрия, Университет във Вашингтон и Детски изследователски институт в Сиатъл, Сиатъл, Вашингтон, САЩ
Катедра за глобално здраве, Университет във Вашингтон, Сиатъл, Вашингтон, САЩ
Институт по инфекциозни болести и молекулярна медицина, Катедра по патология, Отдел по имунология, Университет в Кейптаун, Кейптаун, Южна Африка
Кореспонденция: H. B. Jaspan, Катедра по педиатрия, Университет във Вашингтон и Детски изследователски институт в Сиатъл, Сиатъл, Вашингтон, САЩ.
Департамент по педиатрия, Университет във Вашингтон и Детски изследователски институт в Сиатъл, Сиатъл, Вашингтон, САЩ
Департамент по педиатрия, Университет във Вашингтон и Детски изследователски институт в Сиатъл, Сиатъл, Вашингтон, САЩ
Катедра за глобално здраве, Университет във Вашингтон, Сиатъл, Вашингтон, САЩ
Институт по инфекциозни болести и молекулярна медицина, Катедра по патология, Отдел по имунология, Университет в Кейптаун, Кейптаун, Южна Африка
Кореспонденция: H. B. Jaspan, Катедра по педиатрия, Университет във Вашингтон и Детски изследователски институт в Сиатъл, Сиатъл, Вашингтон, САЩ.
ДРУГИ СТАТИИ, ПУБЛИКУВАНИ В ТОЗИ ПРЕГЛЕД СЕРИЯ:
Имунологията на фетално-плацентарната единица навършва пълнолетие. Клинична и експериментална имунология 2019, 198: 11–14.
Ембрионални извънклетъчни везикули като информатори за имунните клетки в интерфейса между майката и плода. Клинична и експериментална имунология 2019, 198: 15–23.
Ролята на активирането на неутрофилите при определяне на резултата от бременността и модулация от хормони и/или цитокини. Клинична и експериментална имунология 2019, 198: 24–36.
Преглед на прокалцитонин по време на бременност и при прееклампсия. Клинична и експериментална имунология 2019, 198: 37–46.
Обобщение
Известно е, че микробиотата от различни майчини места, включително червата, вагината и кърмата, влияе върху колонизацията при кърмачета. Новите доказателства сочат, че тези места могат да упражнят своето влияние преди раждането, от своя страна да повлияят на развитието на имунната система на плода. Догмата за стерилна утроба продължава да бъде оспорвана. Независимо от това, има убедителни доказателства, че съставът на майчините черва преди раждането влияе върху новородения имунитет. Следователно, докато присъствието и функцията на плацентарния микробиом не са ясни, съществува консенсус, че чревната микробиота по време на бременност е критичен фактор за здравето на потомството. Появяват се данни, подкрепящи идеята за бактериална транслокация от майчините черва в извън чревни участъци по време на бременност и потенциално обясняват наличието на бактерии в кърмата. Много доказателства сочат, че микробиотата на майчините черва по време на бременност потенциално определя развитието на атопия и автоимунни фенотипи при потомството. Тук подчертаваме ролята на майчината микробиота преди раждането върху бебешкия имунитет и предразположението към заболявания. Освен това обсъждаме потенциалните механизми, които стоят в основата на това явление.
Въведение
Човешкото тяло е дом на редица микроорганизми, включително вируси, бактерии, гъбички, археи и едноклетъчни еукариоти. Известно е, че бактериалният контингент на тази общност, микробиотата, влияе дълбоко на нашето здраве, извеждайки на преден план симбиотичната връзка, която съществува между тези микроби и техния човешки гостоприемник. Вертикалното предаване на микроби от различни места на майчиното тяло допринася за развиващата се микробиота на бебето, включително червата, вагината, кожата и кърмата 1, 2. Много от тях упражняват своето влияние по време на раждането или след раждането, след излагане на влагалището на майката, изпражненията и кожата 3, но появяващите се данни показват, че тяхното влияние може да започне вътреутробно. В исторически план се приема, че маточната среда е стерилна 4. Оттогава тази догма е била предизвикана 5-8, с уникален плацентарен микробиом в някои проучвания 5, 9, но не и в други 7, 10 .
Независимо дали има фетален или плацентарен микробиом, има данни за силно влияние на микробиотата на майчините черва по време на бременност върху микробиотата на бебето. Доказано е, че щамовете на майчините черва са по-устойчиви в червата на бебето и са по-добре екологично адаптирани в сравнение с тези от други източници 11. При мишки генетично белязани бактерии присъстваха в проби от меконий, които съответстваха на онези, приложени перорално на майката 8. Освен това бременните язовири без микроби, преходно колонизирани с модифициран Ешерихия коли щам и се върнаха в състояние, свободно от зародиши преди раждането. 12 са имали малки с променени вродени лимфоидни и мононуклеарни клетки, което предполага, че преходните промени в майчината микробиота по време на бременност стимулират имунното програмиране на плода. Следователно дали плодът наистина е колонизиран или не вътреутробно, периодът по време на бременността е първата точка на майчините микроби, влияещи върху имунитета на плода. Механизмите, чрез които майчината микробиота преди програмата за раждане на новородения имунитет тепърва ще бъдат изяснени. Тук правим преглед на актуалната литература за въздействието на майчината микробиота по време на бременност върху имунитета на бебето.
Пренатален чревен микробиом и имунитет на плода
Индуцирани от антибиотици промени в микробиотата
Бактериална ос на червата и кърмата
Вагинална микробиота по време на бременност и бебешки имунитет
Майчината микробиота по време на бременност и имунни нарушения, свързани с потомството
Алергия и астма
Доказано е също, че модулацията на микробиоми чрез пробиотици влияе върху развитието на детската алергия 53. Показано е, че комбинираните добавки преди и след раждането с пробиотици са от решаващо значение за превантивните ефекти на пробиотиците върху екзема при кърмачета; само пренаталното или постнаталното добавяне е неефективно 53, 54. Други обаче установяват, че пренаталният компонент е по-влиятелен 55. Въпреки че предизвиканите от пробиотици промени в микробиотата на майчините черва по време на бременност и кърмене могат да намалят честотата на педиатрични алергии, по-нататъшни изследвания са оправдани за определяне на оптимално време и дозировка.
Диабет тип 1
Възпалително заболяване на червата
Освен T1D, микробиотата е замесена и в възпалителни заболявания на червата (IBD) 67-69. Доказано е, че съставът на червата по време на бременност влияе върху резултатите от IBD при потомството. Например, излагането на антибиотици по време на бременност, но не и по време на ранна детска възраст е свързано с повишен риск от много ранно възникване на IBD, независимо дали е имало предшестващ гастроентерит 70. В проучване на мишки, използващо IL-10 модел на нокаут колит, излагането на язовири на антибиотици от третата гестационна седмица до отбиването доведе до повишена чувствителност към химически индуциран колит натриев декстран сулфат (DSS) и възпаление в нейното потомство, траещо до зряла възраст 71. Това предполага, че микробиотата на майката по време на бременност е критичен фактор за развитието на IBD. Взети заедно, обсъдените проучвания T1D и IBD показват, че дисбиозата на майката по време на бременност има имунологични последици при потомството и е определящ фактор за предразположението на бебето към автоимунни заболявания.
Потенциален механизъм на кръстосани разговори между майчината микробиота и имунитета на потомството
Въпреки че точните механизми остават да бъдат разкрити, се смята, че микробиотата по време на бременност инициира имунно програмиране на потомството по различни донякъде взаимосвързани начини, които не са непременно взаимно изключващи се (Таблица 1, Фиг. 2).
- 1. Майчините чревни бактерии се транслоцират в меконий при потомството
- 2. Феталните черва се колонизират с бактерии по време на бременност
- 3. Плацентата съдържа уникален микробиом
- 2. Майчината микробиота по време на бременността влияе върху микробиотата на потомството и имунитета
- 3. Потомците, родени от майки с променена микробиота, са податливи на вирусни и бактериални инфекции
- 4. Микробиотата на майчините черва индиректно влияе върху извън чревната микробиота
- 2. SCFA, произведени по време на бременност, оказват влияние върху имунитета на плода
- 2. Имуноглобулините участват в микробното опсонизиране
Майчината микробиота влияе върху феталната микробиота
Има данни, подкрепящи възможността феталната микробиота да се развие вътреутробно през плацентарната бариера или чрез поглъщане на околоплодни течности 72 и следователно може да повлияе на развиващата се имунна система на плода. Различни проучвания показват, че някои бактерии от майчините черва могат да се транслоцират в екстрадигестивни места при здрави гостоприемници 73-75. Проучванията върху мишки и хора показват, че меконият се колонизира с бактерии по време на бременност 76-78. Хименес и др. 8 изолирани маркирани Enterococcus faecium от мекония на потомството след орално инокулиране на щама на бременни язовири, което показва, че микробите на майчините черва потенциално преминават през плацентата към червата на потомството.
На теория червата на плода могат да бъдат изложени на коменсални микроби и техните продукти в погълнатата околоплодна течност, което следователно може да бъде важен фактор за ранното имунно развитие. Например CD4 + и CD8 + Т клетки с памет могат да бъдат идентифицирани към края на първия триместър в човешкото фетално черво. Доказано е, че CD4 Т клетките на паметта във феталните черва се локализират съвместно с APC и произвеждат IFN-γ, IL-2 или фактор на туморна некроза (TNF) -α, насърчавайки чревното развитие 80, 81. Като цяло това предполага, че ранното излагане на плода на микробни антигени може да повлияе на имунитета. Въпреки че не е ясно какъв е относителният принос на майката срещу феталният микробиом е за имунитета на потомството, правдоподобно е, че и двете тези микробиоти са от решаващо значение при програмирането на феталния имунитет преди раждането.
Майчината микробиота по време на бременност влияе върху ранната детска микробиота и имунитета
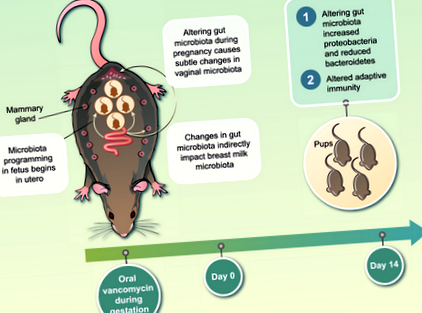
Макар че не е пряк ефект по време на бременност, майчината микробиота по време на бременност оформя микробиотата на вагината и майчиното мляко, което ще промени пионерската микробиота по време на критичен прозорец в имунното развитие. Всъщност наскоро демонстрирахме, че промяната на майчините чревни общности само по време на бременността индиректно влияе върху майчиното мляко и в по-малка степен върху вагиналната микробиота 1 (фиг. 1). В допълнение, индуцираните от ванкомицин промени в микробиотата на майчините черва оказват силно влияние върху микробиотата на бебето в червата 14 дни след раждането. Малките, родени от язовири, лекувани с ванкомицин по време на бременността, са имали значително по-голям брой CD4 + Т и В клетки в сравнение с контролите 1. Заедно нашите открития разкриват многофакторна връзка между микробиотата на майчините черва по време на бременност, микробиотата на майчиното мляко, чревната микробиота на бебето и постнаталното имунно развитие.
Бактериални метаболити
Епигенетика
Имуноглобулини на майката
Заключения
Тук ние подчертаваме актуалната литература за ролята на майчината микробиота по време на бременност върху развиващия се имунитет на плода и бебето, включително развитието на имунно-медиирани заболявания като автоимунитет и атопия. Описваме потенциалните механизми, чрез които микробите на майчините черва по време на бременност въздействат върху имунитета на бебето. Ясно е, че имунното развитие на плода започва преди раждането и вероятно се дължи на транслокация на микробиота или техните метаболити от майчиното черво в майчино-феталната единица или други повърхности на лигавицата. Въпреки че се оценява, че най-голямата инфузия на микроби се случва при раждането, когато новороденото влезе в контакт с външна микробиота, данните са ограничени за ролята на вагиналната микробиота по време на бременност върху феталния имунитет. Майчините имуноглобулини на тези места увеличават трансфера на тези компоненти към плода, допринасяйки за микробиота или имунно препрограмиране. Като цяло гестационната микробиота предизвиква имунен отпечатък в плода, който има трайни постнатални имунологични последици.
- Съвети за добра клинична практика Желязодефицитна анемия по време на бременност - 2019 - International Journal of
- Общ преглед на бременността, усложнен от бариатричните времена на майчиното затлъстяване
- Как храненето и майчината микробиота оформят новородената имунна система Nature Reviews Immunology
- Здрави бременни жени Фарт Лекари за това защо бременността газ е добре бащински
- Здрави бременни жени Фарт лекари за това защо бременността газ е добре