ПРЕГЛЕД СТАТИЯ
Влияние на недохранването върху имунитета и инфекцията
França TGD; ТУО Ishikawa; Zorzella-Pezavento SFG; Chiuso-Minicucci F; da Cunha MLRS; Сартори А
Катедра по микробиология и имунология, Институт по биология на Botucatu, Държавен университет в Сао Пауло, UNESP, Botucatu, Сао Пауло, Бразилия
Недохранването може да е следствие от енергиен дефицит или недостиг на микроелементи. Счита се за най-подходящия рисков фактор за заболяване и смърт, особено в развиващите се страни. В този преглед описахме мащаба на този проблем, както и неговия пряк ефект върху имунната система и как той води до по-висока податливост към инфекции. Специален акцент беше даден на експериментални модели, използвани за изследване на връзката между недохранването и имунитета. Недохранването очевидно е предизвикателство, което трябва да бъде адресирано до здравните власти и научната общност.
Ключови думи: недохранване, инфекция, имунитет, експериментални модели.
ВЪВЕДЕНИЕ
Недохранването може да бъде следствие от енергиен дефицит (протеиново-енергийно недохранване - PEM) или недостиг на микроелементи. Във всеки случай тя все още е основна тежест в развиващите се страни и се счита за най-важния рисков фактор за заболяване и смърт, засягаща особено стотици милиони бременни жени и малки деца (1). Тази пряка връзка между недохранването и смъртта се дължи главно на произтичащия от това имунодефицит и следователно по-голяма податливост към инфекциозни агенти.
Смята се, че 852 милиона души са били недохранени между 2000 и 2002 г., като повечето (815 милиона) живеят в развиващите се страни, особено в Южна Азия и Африка на юг от Сахара (2-4).
Недохранването само по себе си може да причини смърт; епидемиологичните данни обаче разкриват, че той значително увеличава податливостта и тежестта на инфекциите и е основна причина за заболявания и смърт, съпътстващи многобройни заболявания (5-7). Това е пряката причина за около 300 000 смъртни случая годишно и косвено е причина за около половината от всички смъртни случаи при малки деца (8). Пряка връзка между по-висока степен на недохранване и по-висок риск от смърт се подкрепя от наблюдението, че тежко недохранените деца изпитват значително по-висок риск от смъртност (9, 10).
Много фактори влияят върху степента и разпространението на ПЕМ и дефицита на микроелементи по света, като бедността е на върха на списъка. Други фактори, при които е трудно да се установи връзката между причина и следствие, също са дълбоко замесени в недохранването, включително: социално-икономическа и политическа нестабилност; нарушено образователно развитие; антисанитарни условия; лоши хранителни практики; навици за кърмене и недостиг или неефективност на хранителните програми (1, 11).
Причинно-следствената връзка на недохранването с имунната супресия и инфекция също се влошава от дълбокия ефект на много инфекции върху самото хранене. Например, стомашно-чревните паразити могат да доведат до диария, анемия и лишаване от хранителни вещества (12, 13). Също така е добре установено, че СПИН, туберкулоза и други хронични инфекции причиняват кахексия и анемия (12, 14).
PEM се дефинира при деца чрез мерки, които падат повече от две стандартни отклонения под нормалното тегло спрямо възрастта (поднормено тегло), нормалната височина спрямо възрастта (закъснение) и теглото за ръст (загуба). Сред децата на възраст под 5 години в развиващите се страни около 31% са с поднормено тегло, 38% имат забавен растеж и 9% показват загуба (1). Тежкото недохранване се среща почти изключително при деца и се проявява като маразъм (тежко изхабяване), маразмичен квашиоркор (тежко изхабяване с оток) и квашиоркор (недохранване с отоци) (15). Маразъм се диагностицира, когато подкожната мастна тъкан и мускулите се загубят поради ендогенна мобилизация на цялата налична енергия и хранителни вещества. Клиничните аспекти включват триъгълно лице, първична или вторична аменорея, удължен корем и анален или ректален пролапс (16). Kwashiorkor обикновено се проявява като оток, промени в цвета на косата и кожата, анемия, хепатомегалия, летаргия, тежка имунна недостатъчност и ранна смърт (17, 18).
Тежката PEM обикновено се характеризира с появата на дегенерация на мазнини в различни органи, включително черния дроб и сърцето. В сърцето причинява субклинична или дори явна сърдечна недостатъчност, която изисква спешна корекция. Загубата на подкожна мазнина, която значително намалява телесната способност за регулиране на температурата, а също и за съхранение на вода, също може да настъпи, провокирайки дехидратация, хипотермия и хипогликемия (19-21). Освен това, PEM се свързва с атрофия на тънките черва, която предизвиква загуба както на абсорбция, така и на храносмилателен капацитет (22, 23).
МАЛНУТРУЦИЯТА ОТРАЖАВА ИМУНИТЕТА
Състояние, което е резултат от генетичен дефект в развитието на имунната система, се нарича първичен имунодефицит. Вторичен или придобит имунодефицит е загубата на имунна функция, която е резултат от различни външни фактори. Най-добре познатият вторичен имунодефицит се причинява от инфекция с вируса на човешкия имунодефицит (ХИВ); обаче най-разпространената причина за имунодефицит в световен мащаб е тежкото недохранване, което засяга до 50% от населението в някои обеднели общности (24). Последвалите аномалии на имунната система засягат както вродения, така и адаптивния имунитет.
От практическа гледна точка е невъзможно да се разграничат вродените и специфични ръце на имунитета, тъй като те работят по вътрешно присъщ начин в тялото. За по-голяма яснота обаче първо ще се обърнем към някои механизми, считани за вродени, т.е. тези, използвани срещу всякакъв вид патоген. Например, наличността на компоненти на комплемента и функцията на фагоцитите са нарушени по време на недохранване, което пряко ще повлияе на елиминирането на патогена. Това се случва, тъй като системата на комплемента сама по себе си може да унищожи бактерии или вируси или защото рецепторите на комплемента, присъстващи на повърхността на фагоцитите, медиират улавянето на патогени. Значително по-ниски нива на комплемента, особено C3, който е основният опсоничен компонент, са описани от Sakamoto и др. (25). Освен това способността на фагоцитите да поглъщат и убиват патогени също е намалена (26).
Антиген-представящите клетки (APC) играят основна роля по време на индукцията, регулирането и поддържането на вродени и придобити имунни отговори (27). Поредица от проучвания демонстрират, че биологичната функция на различни клетъчни типове (В лимфоцити, макрофаги и клетки на Купфер) е ясно намалена по време на хранителни дефицити (28-31).
Най-важните имунологични промени, открити при хора или в експериментални модели на недохранване, които засягат механизмите, свързани с адаптивния имунитет, ще бъдат описани накратко по-долу. Силното протеиново недохранване при новородени и кърмачета е ясно свързано с атрофия в така наречените първични лимфоидни органи, т.е. костен мозък и тимус. Последиците са опустошителни, тъй като тези органи са генератори на репертоари на В и Т клетки. Освен това, недохранването явно засяга хематопоезата, определяйки анемия, левкопения и силно намаляване на костния мозък. Производството на IL-6 и TNF-a от клетките на костния мозък също е значително по-ниско при недохранени животни (32). Капацитетът на недохранена хемопоетична строма да поддържа растежа на хематопоетични стволови клетки (CD34 +) инвитро също се намалява (33). Това е много подходящо откритие, тъй като CD34 + клетките са способни да генерират множество лимфохемопоетични линии като миелоидни, еритроидни и лимфоидни (В и Т) (34).
Тежкото недохранване с протеини, главно при новородени и малки деца, също провокира атрофия на тимуса, което от своя страна намалява броя на тимусните клетки и също така силно влияе върху развитието на периферните лимфоидни органи (35). Непосредствената последица от тази атрофия е левкопения, намалено съотношение CD4/CD8 и увеличен брой незрели Т клетки в периферията. Наскоро Кортес-Барберена и др. (36) отбелязват, че значително по-малък брой CD3 + лимфоцити присъстват в далака на умерено и силно недохранени плъхове. Те също така откриха значително увреждане на активирането на Т-клетки, характеризиращо се с намалена експресия на CD25 и CD71 в тези клетки.
Тези нарушения в тимуса са изследвани по-интензивно в експериментални модели за недохранване. Например, беше демонстрирано, че патентната атрофия се дължи на намаляване на пролиферацията на Т-клетки и повишено изчерпване чрез апоптоза, засягайки предимно незрели TCD4 + и TCD8 + клетки. Това поне частично се дължи на по-ниските нива на лептин по време на глад или недохранване (37, 35). Морфологични промени в тимусните епителни клетки, свързани с намалено производство на тимусен хормон, също са описани по време на недохранване. Тази характеристика очевидно е свързана с хормонален дисбаланс, включващ намаляване на лептина и последващо повишаване на нивата на глюкокортикоидния хормон в серума.
Имунните реакции от епителната бариера също са дълбоко засегнати от недохранването. Тези промени се характеризират главно с промени в архитектурата на чревната лигавица, включително сплескана хипотрофия микровили, намален брой лимфоцити в пластирите на Пайер и намалена секреция на имуноглобулин А (38, 39).
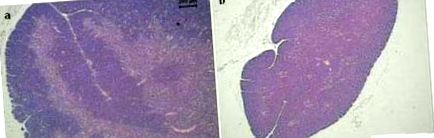
Според нашия опит мишките BALB/c, подложени на диетични ограничения (80% от количеството храна, консумирана от контролна група) през 40 дни, показват подобни промени. Заедно със значителна загуба на тегло на тялото и далака (Фигура 1), тези животни също са представили модификации в лимфоидните органи (Фигура 2). В сравнение с нормалния тимус, представен на фигура 2а, в този орган се наблюдава тежка атрофия при недохранени животни. Освен това, разграничението между кортикалната и медуларната област е загубено в диетично ограничената група (Фигура 2b). Поразителни промени се наблюдават и в лигавицата, свързана с тънките черва. Освен че са по-малки и неправилни, червата на червата също губи своите четки. Тези промени могат да се наблюдават на фигура 2г, в сравнение с нормалните кореспондентни структури, показани на фигура 2в.
Представянето на антиген на Т-клетките е основно събитие, което предшества развитието на хуморален и клетъчен имунитет. Три различни типа клетки (В лимфоцити, макрофаги и дендритни клетки) са описани като основен APC. Сред тях само дендритни клетки (DC) са били по-задълбочено проучени по време на недохранване. Съществува общ консенсус, че различните аспекти на DC като брой, производство на цитокини и способност да предизвикат пролиферация на антиген-специфични Т-лимфоцити с памет са значително засегнати от недохранването (40). Съвсем наскоро беше демонстрирано, че приемно прехвърлените DC също са в състояние да възстановят първичната клетъчно-медиирана възпалителна компетентност на остро недохранени мишки отбиващи (41).
Съществува общо съгласие, че дефицитът на протеини, енергия или дори и двете предизвикват дълбока депресия в придобитата клетъчно-медиирана имунна компетентност, докато хуморалната компетентност е по-малко предсказуемо засегната. Това се подкрепя от наблюдението, че Th2-тип имуноглобулини (IgG1 и IgE) са били селективно повишени при отбиващи мишки, подложени на остро недохранване, докато нивата на Th1-тип имуноглобулини (IgG2a и IgG3) не са били засегнати (42). Подобна и допълваща информация е получена в модел на мишки с дефицит на витамин А. Недостигът на този витамин по време на първоначалното излагане на антиген значително подобрява развитието на IL-10, продуциращи Th2 или Т регулаторни клетки, като същевременно намалява експресията на Th1 клетки с памет (43). Съвсем наскоро Сакай и др. (44) потвърждават тези констатации, демонстрирайки, че дефицитът на протеин уврежда индукцията на антиген-специфична пролиферация на Т-клетки, но не и отговор на В-клетките при ДНК имунизирани мишки.
Един от основните механизми, който предотвратява или намалява имунитета по време на недохранване, изглежда е свързан с активирането на Т лимфоцитите. Добре установено е, че зависимите от напрежението K (V) калиеви канали са жизненоважни за активирането на Т клетките. Фернандес и др. (45) съобщават за значително намаляване на K + тока и положително активиране на мембранния потенциал с 20 mV в Т лимфоцити, получени от плъхове с тежко недохранване. Доказано е също така, че умерено и тежко недохранени плъхове имат по-нисък абсолютен и относителен брой CD3 + и CD4 + субпопулации на лимфоцитите. Това също е свързано с значително намаляване на експресията на CD25 и CD27, които са молекули, абсолютно необходими за активиране и пролиферация на Т-клетки (36).
Нарушеното активиране на Т клетки е ясно свързано с дефицити в производството на цитокини, които са основните молекулярни медиатори на имунитета. Това е очевидно при недохранени деца, които показват намалено производство на цитокини от тип 1 (IL-2 и IFN-y) (46).
ХРАНИТЕ ХРАНЕНЕ ПОВИШЯВА РИСКА ОТ ИНФЕКЦИЯ
Силната връзка между недохранването и инфекцията първоначално е описана от Скримшоу и др. (47). От тази рамка бяха направени много изследвания в тази област и има пълно съгласие между авторите, че смъртността е значително по-висока при недохранените деца в сравнение със здравите. Изследването на Man и др. (48), която включваше голяма част от хоспитализираните гамбийски деца, ясно илюстрира връзката между недохранването, характеризиращо се с по-ниско тегло спрямо възрастта, и по-високи показатели на смъртност, свързани с много инфекциозни заболявания.
Въпреки че ефективните ваксини са лицензирани за морбили, тя продължава да причинява смърт и тежки заболявания при деца по целия свят. Усложненията от тази вирусна инфекция могат да възникнат в почти всеки орган или система, включително пневмония, крупа и енцефалит. Наред с други фактори, недохранването и дефицитът на витамин А увеличават степента на усложнения (58). Има експериментални доказателства, че добавянето на витамин А при деца е свързано с намаляване на риска от смъртност от 23 на 30% и отслабване на тежестта на заболяването (59). Поради тази причина Световната здравна организация препоръчва приемане на перорална доза витамин А на деца с морбили, които живеят в зони с дефицит на витамин А (60).
Недохранването и чревният паразитизъм споделят сходно географско разпределение, като едни и същи индивиди изпитват едновременно и двете заболявания (61). Съвместното съществуване между недохранване и инфекция с нематоди включва два причинно-следствени пътя, недохранване, което увеличава податливостта към инфекция, и самата инфекция, която води до по-подчертано недохранване (62). Чревните нематоди могат да провокират недохранване, тъй като причиняват анорексия и различни патофизиологични реакции в стомашно-чревния тракт като повръщане, диария и малабсорбция. Заедно тези промени влияят пагубно върху способността на приемника да получава достатъчно хранителни вещества от диетата (63). Паразитите, които ясно влияят върху хранителния статус, са хелминти, предавани от почвата, Giardia duodenalis, Entamoeba histolytica, кокцидии и Шистозома sp. (64).
Съществува и общ консенсус, че PEM е свързан с по-голяма заболеваемост и смъртност от малария при хората (65). В подкрепа на това наблюдение, контролираните клинични изпитвания на добавки с витамин А или цинк показват, че тези хранителни вещества могат значително да намалят клиничните огнища на малария (66, 67). Мненията относно ефекта на някои микроелементи, като например желязото, все още са противоречиви (68, 56).
Noma е опортюнистична инфекция, насърчавана от крайна бедност, която еволюира бързо от възпаление на венците до осакатяваща орофациална гангрена. Дори да се смята, че може да се наблюдава в цял свят, той е много по-често срещан в Африка на юг от Сахара. Това е резултат от много сложни взаимодействия между недохранване, инфекции и нарушен имунитет и много често се предшества от малария, морбили и тежък некрозиращ язвен гингивит (69).
ЕКСПЕРИМЕНТАЛНИ МОДЕЛИ
Много проучвания, проведени върху популации от хора от развиващите се страни, показват важни дефицити на макронутриенти (протеини, въглехидрати и мазнини, водещи до дефицит на протеини и енергия), микроелементи (електролити, минерали и витамини, водещи до специфични дефицити на микроелементи) или и двете (70-72). Тези произведения бяха много подходящи, тъй като позволяват идентифициране на най-силно засегнатите региони и последваща намеса от хуманитарни организации и местни правителства. Въпреки това лабораторните животни са били много полезни при изучаването на ефектите от различните нива на недохранване, тъй като нехранителните фактори, които засягат хората, могат да бъдат контролирани при този тип оценка. Използването на животински модели при недохранване донесе много информация за молекулярните механизми, участващи в по-високата податливост към инфекции, а също и за имунодефицита, вторичен от недохранването (73, 13).
Най-използваните модели са възрастни мишки и плъхове (без хляб или изогенни) фуражи с намалено количество протеини, витамини или микроелементи. Процентът на диетични ограничения варира от 10 до 70%, според различни автори. Тъй като имунодефицитът, свързан с недохранването в предпубертетна възраст, е в основата на зашеметяващата тежест на заболеваемостта, свързана с инфекцията, също са изследвани остри мишки за отбиване, за да се изследват ефектите от недохранването (41). По-рядко се използват и котки и кучета. Съвсем наскоро се използват трансгенни и нокаутиращи мишки, за да се разберат по-добре механизмите, свързани с по-висока чувствителност към инфекциозни агенти при недохранени мишки (72, 74).
Тези многобройни животински модели позволяват нарастващо разбиране и характеризиране на имунологичните нарушения, предизвикани от недохранване. Някои примери за най-важните открития в тази област на изследване са представени в таблица 1.
- Влияние на диетата върху индуцирането на инфекция с кисти на Giardia lamblia при плъхове Sprague-Dawley -
- Усилвателят на имунитета 5 причини, включително амла или индийско цариградско грозде във вашата диета, ще ви помогнат да останете
- Listique; s Choice Увеличете имунитета си с тези невероятни добавки
- Влияние на замърсителите на въздуха върху оксидативния стрес при често срещани стареещи заболявания, медиирани от автофагия
- Влияние на индекса на телесна маса върху нивото на хемоглобина и кръвопреливането при обща артропластика на коляното А