Тази статия е по-конкретна дискусия за CML. Моля, не забравяйте първо да прочетете Всичко за левкемията, за да имате разбиране за левкемия.
Какво е CML?
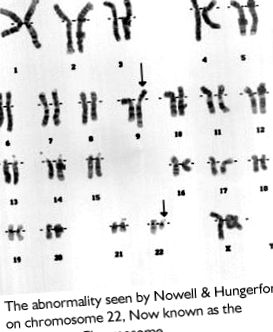
ХМЛ е хроничен рак на кръвта, по-специално левкемия. Започва с дефект в две хромозоми, който води до свръхрастеж на бели кръвни клетки. Клетките, изграждащи човешкото тяло, съдържат по 23 двойки хромозоми, което съставлява вашата ДНК. ХМЛ се появява, когато ДНК от хромозома 9 се открие в хромозома 22 и обратно. Това води до по-къса хромозома 22, което е ненормално. Тази анормална хромозома се нарича хромозома Филаделфия и се намира в левкемичните клетки на почти всички хора, които имат ХМЛ. Движението на ДНК от една хромозома към друга образува нов ген, онкоген, наречен BCR-ABL. Сега той прави BCR-ABL протеин, тирозин киназа, което кара раковите клетки да растат извън контрол.
ХМЛ представлява около 15% от всички случаи на левкемия. Всяка година се диагностицират около 8 990 нови случая. Средната възраст при поставяне на диагнозата е 64 г. Тя е по-често при мъжете, отколкото при жените.
Какво причинява ХМЛ и изложен ли съм на риск?
В повечето случаи причината за ХМЛ не е известна. Въпреки че е идентифицирана генетична мутация (BCR-ABL пренареждане), не е ясно какво причинява тази мутация. Излагането на високи дози радиация (като тези след атомна бомба или по-стари методи за лечение на радиация при рак) повишава риска от заболяване. Не е доказано, че химическата експозиция причинява ХМЛ, нито има наследствена връзка. Въпреки че генът BCR-ABL понякога се среща при други левкемии, при човек с клинични признаци на ХМЛ, откритието за пренареждане на гена BCR-ABL потвърждава диагнозата.
Как мога да предотвратя CML?
В повечето случаи на ХМЛ не знаем причината за диагнозата. По този начин няма начини да се предотврати развитието на CML. Също така е важно да спортувате, да избягвате пушенето и да поддържате хранителна диета, за да намалите риска от рак като цяло.
Какви скринингови тестове се използват за ХМЛ?
Няма стандартни скринингови тестове, препоръчани за ХМЛ.
Какви са признаците на ХМЛ?
Признаците и симптомите на ХМЛ не са специфични за заболяването. Най-честите симптоми са резултат от необичайни кръвни показатели и увеличен далак (спленомегалия). Ненормалната кръвна картина може да причини умора, задух, инфекция, натъртване и кървене. Спленомегалията, която има тенденция да присъства във фазата на взрива (подробно описана по-долу), причинява пълнота или дискомфорт в корема, усещане за пълнота по-рано при хранене (далакът притиска стомаха) и загуба на тегло. Болки в костите, треска и нощно изпотяване са други симптоми, които може да изпитате.
Как се диагностицира ХМЛ?
Ако вашият доставчик подозира, че имате ХМЛ, първата стъпка вероятно ще бъде да се извърши кръвна работа. Ще се направи кръвен тест, наречен пълна кръвна картина (CBC), за да се проверят нивата на червените кръвни клетки, белите кръвни клетки и тромбоцитите. Може да се направи и тест, наречен намазка, за да се видят кръвните Ви клетки с микроскоп. Ще бъде направено и генно тестване, за да се търси хромозомата на Филаделфия. Заедно с кръвните изследвания вероятно ще ви бъде направена биопсия на костния мозък. Може да се направят образни тестове, като КТ, за да се види дали левкемията се е разпространила в някой орган в тялото ви.
Как се организира CML?
ХМЛ не се организира като други видове рак. Разделя се на три фази: хронична, ускорена и взривна. Фазите се идентифицират по броя на незрелите бели кръвни клетки (наречени бласти), които присъстват в кръвния поток. Това също е знак за това колко агресивна е болестта в този момент.
- Хроничната фаза се определя като по-малко от 10% взривни клетки в кръвта и е най-малко агресивната от фазите.
- Ускорената фаза се определя като съдържаща между 10-19% бластни клетки в кръвта.
- Бластната фаза се определя като 20% или повече бластни клетки, наблюдавани в кръвта и е най-агресивната фаза на заболяването.
Как се лекува ХМЛ?
Инхибиторите на тирозин киназа (TKI) са стандартното лечение на ХМЛ. Тирозин киназата е вид протеин, наречен ензим. Хромозомата/bcr-abl на Филаделфия, свързана с ХМЛ, произвежда тирозин киназа. TKI блокират функцията на тирозин киназа. Тези лекарства могат също да причинят bcr-abl експресиращи гени да умрат, което е известно като апоптоза.
Тези лекарства включват иматиниб, дазатиниб, нилотиниб, босутиниб и понатиниб. Тези лекарства се приемат, докато болестта реагира на тях и докато страничните ефекти се управляват добре. При много пациенти хромозомата на Филаделфия става неоткриваема чрез настоящите методи за тестване, но проучванията показват, че аномалията ще се върне бързо, ако лекарството бъде спряно. Важно е да се разбере, че тези лекарства не лекуват ХМЛ, но когато работите, предпазвате болестта от прогресиране.
Преди откриването на TKI, на пациентите с ХМЛ често се предлага алогенна трансплантация на стволови клетки (стволови клетки от друго лице), което остава единственият начин за излекуване на ХМЛ. Трансплантациите обаче не винаги поставят пациента в ремисия и те също могат да причинят сериозни странични ефекти, като например присаждане срещу гостоприемник (GVHD). Трансплантацията е запазена за пациенти, които вече не реагират на TKI медикаменти в първата хронична фаза на заболяването или като спасително лечение при напреднало заболяване. Препоръчва се по време на диагностицирането на ХМЛ пациентът да се подложи на "обработка" за алогенна трансплантация на стволови клетки, включително HLA типизиране, оценка на риска от трансплантация и оценка на вероятността да намери донор. Това ще съкрати времето, необходимо за подготовка за трансплантация на стволови клетки, ако бъде решено да бъде избраният курс на лечение.
Други Treaments
Други видове лечения могат да се използват в случаите, когато TKI вече не работят за управление на заболяването. Те включват омацетаксин мепесукцинат, интерферон алфа, химиотерапия и лъчение. Спленектомия (отстраняване на далака) може да се използва в случаите, когато далакът се е увеличил толкова, че притиска други органи или за управление на кръвната картина. Но това не третира самия CML.
Омацетаксин мепесукцинат (Synribo ™) е синтетична форма на хомохарингтонин, съединение, пречистено от китайско вечнозелено дърво, е одобрено за лечение на ХМЛ, което не е отговорило на 2 или повече TKI. Това лекарство е проучено специално при пациенти с мутации T315I и може да бъде опция за тези пациенти.
Интерферон алфа също се използва често преди иматиниб. Тази терапия може да се използва при пациенти, които не могат да се подложат на трансплантация.
Химиотерапията може да се използва в случаите, когато TKI вече не работят или като част от трансплантация на стволови клетки. Химиотерапията, която получавате, ще бъде определена от вашия екип за грижи.
Радиацията може да се използва за лечение на органи, които причиняват симптоми, като увеличена далака, притискаща други органи. Може да се използва и за лечение на костна болка в случаите, когато левкемията е довела до увреждане на костите. Може да се използва и за подготовка за трансплантация на стволови клетки.
ХМЛ може да прогресира или да се ускори и започва да действа като остра форма на левкемия. Това може да се нарече и „взривна фаза“ или „взривна криза“. Пациентите могат да бъдат лекувани с иматиниб или други TKI, химиотерапевтични лекарства, подобни на тези, използвани при ОМЛ, или трансплантация. Избраното лечение ще зависи от това дали сте имали лечение в миналото.
Клинични изпитвания
Има клинични проучвания за повечето видове рак и всеки етап от болестта. Клиничните изпитвания са предназначени да определят стойността на специфичните лечения. Изпитванията често са предназначени за лечение на определен стадий на рак, или като първата предложена форма на лечение, или като опция за лечение, след като други лечения не са успели. Те могат да се използват за оценка на лекарства или лечения за предотвратяване на рак, откриване по-рано или помощ при управлението на странични ефекти. Клиничните изпитвания са изключително важни за по-нататъшното ни познаване на болестта. Чрез клинични изпитвания знаем какво правим днес и в момента се тестват много вълнуващи нови терапии. Говорете с вашия доставчик за участие в клинични изпитвания във вашия район. Можете също така да изследвате отворени в момента клинични изпитвания с помощта на услугата за съвпадение на клиничните изпитвания OncoLink.
Последващи грижи и оцеляване
Пациентите, лекувани за ХМЛ, се следят много внимателно от техните доставчици на грижи. Те често си правят лаборатории, за да наблюдават кръвната им картина и да определят дали лечението им с TKI продължава да работи. В някои случаи, ако болестта реагира на TKI в продължение на няколко години, може да успеете да спрете приема на лекарството. Вашите лаборатории ще бъдат наблюдавани и ако е необходимо, можете да се върнете към приема на лекарства. Ако сте имали трансплантация, ще бъдете внимателно наблюдавани, за да видите дали сте в ремисия или дали сте имали рецидив. Важно е незабавно да уведомите екипа си, ако имате някакви нови симптоми или не можете да приемате вашето TKI лекарство.
Предизвикателствата в отношенията, финансовото въздействие на лечението на рака, проблемите със заетостта и стратегиите за справяне са често срещани емоционални и практически проблеми, преживели оцелелите от ХМЛ. Вашият здравен екип може да идентифицира ресурси за подкрепа и управление на тези практически и емоционални предизвикателства, пред които са изправени по време и след рак.
Преживяването на рак е сравнително нов фокус на онкологичните грижи. С около 15 милиона оцелели от рак само в САЩ, е необходимо да се помогне на пациентите да преминат от активно лечение към оцеляване. Какво се случва по-нататък, как се връщате към нормалното, какво трябва да знаете и правите, за да живеете здравословно напред? Планът за грижи за оцеляване може да бъде първата стъпка в обучението си за навигация в живота след рак и да ви помогне да общувате добре с вашите доставчици на здравни услуги. Създайте план за грижи за оцеляване днес на OncoLink.
Препратки
Abeloff, M., Armitage, J., Niederhuber, J., Kastan, M. & McKenna, G. (Eds.): Clinical Oncology (2004). Elsevier, Philadelphia, PA.
Apperley, JF. Хронична миелоидна левкемия. Лансет. 5 декември 2014 г .: 385: 1447-59.
Cortes JE, Jones D, O'Brien S, Jabbour E, Ravandi F, Koller C, et al. Резултати от терапията с дазатиниб при пациенти с ранна хронична фаза на хронична миелоидна левкемия. J Clin Oncol. 20 януари 2010 г .; 28 (3): 398-404.
Druker BJ, Sawyers CL, Kantarjian H, et al. Активност на специфичен инхибитор на BCR-ABL тирозин киназа при бластна криза на хронична миелоидна левкемия и остра лимфобластна левкемия с филаделфийската хромозома. N Engl J Med. 5 април 2001 г .; 344 (14): 1038-42
Gratwohl A, Baldomero H, Passweg, J. Ролята на трансплантацията на хематопоетични стволови клетки при хронична миелоидна левкемия. Анали на хематологията. 2015 г .; 94 (2): 177-186.
Kantarjian, H et al. Хомохарингтонин/омацетаксин: малкото лекарство, което би могло. ASCO Post, том 4, брой 6, 15 април 2013 г.
Общество за левкемия и лимфом - хронична миелоидна левкемия
NCCN Практически насоки в онкологията. Хронична миелоидна левкемия. Версия 1.2020.
Shah NP, Kim DW, Kantarjian H, et al. Мощното, преходно инхибиране на BCR-ABL с дазатиниб 100 mg дневно постига бързи и трайни цитогенетични отговори и високи нива на преживяемост без трансформация при пациенти с хронична фаза на хронична миелоидна левкемия с резистентност, неоптимален отговор или непоносимост към иматиниб. Haematologica.2010; 95 (2): 232-40
Simonsson B, Gedde-Dahl T, Markevarn B, et al. Комбинацията от пегилиран IFN-a2b с иматиниб увеличава степента на молекулярен отговор при пациенти с хронична миелоидна левкемия с нисък или среден риск. Кръв. 2011; 118 (12): 3228-35.
- 5 съвета за начин на живот за живот с хронична миелоидна левкемия (ХМЛ) - Къде уелнес; Култура Свързване
- Аюрведа Body Cure Хронично разстройство Затлъстяване Загуба на тегло
- Алкохол, други хранителни вещества и хронични заболявания - Яжте до живот - NCBI Bookshelf
- Всичко за миелофиброзата OncoLink
- Алергия към варени бели картофи при кърмачета и малки деца Причина за тежка, хронична алергия