Кореспонденция на: Ясунори Кавагучи, д-р, катедра по вътрешни болести, Медицинско училище Сага, 5-1-1 Набешима, Сага 849-8501, Япония. pj.ca.u-agas.cc@yugawak
Телефон: + 81-952-342362 Факс: + 81-952-342017
Резюме
Основен съвет: Специфична патофизиологична характеристика на инфекцията с вируса на хепатит С (HCV) е инсулиновата резистентност на цялото тяло, която е свързана с оксидативен стрес, аномалии на липидния метаболизъм, чернодробна стеатоза и претоварване с желязо. Приемащите метаболитни фактори синергично усилват индуцираното от HCV метаболитно нарушение, афективно влошаващо клиничното протичане при пациенти с хроничен хепатит С. Следователно диетата, начинът на живот и лекарствата, подходящи за метаболитни нарушения, са важни за лечението на инфектирани с HCV пациенти за подобряване на прогнозата.
ВЪВЕДЕНИЕ
Епидемиологичните и клинични проучвания показват, че пациентите с хронично чернодробно заболяване, особено тези, заразени с вируса на хепатит С (HCV), имат по-висока честота на непоносимост към глюкоза от общата популация [1-8]. Инсулиновата резистентност изглежда е централна характеристика на патогенезата на HCV-индуцирана глюкозна непоносимост. Доказано е, че премахването на HCV чрез антивирусна терапия подобрява инсулиновата резистентност, както в чернодробните тъкани [4], така и в цялото тяло [9]; освен това тези пациенти с антивирусен отговор показват значително по-ниска честота на аномалии на метаболизма на глюкозата по време на последващото проследяване [10,11].
Инсулиновата резистентност се очертава като важен прогностичен фактор за клиничния ход на HCV инфекция, поради връзката му с резистентност към антивирусна терапия [12-18], прогресия на чернодробната фиброза [13,19-24], развитие на хепатоцелуларен карцином (HCC ) [25] и лошо качество на живот [26]. В допълнение, инсулиновата резистентност, както и оксидативният стрес, допринасят за свързаните с HCV нарушения в метаболитните фактори на гостоприемника, особено липидите и желязото [27-31]. Доказано е, че висцералното затлъстяване повишава HCV-индуцирана инсулинова резистентност [32], а HCV инфекцията при пациенти със затлъстяване и захарен диабет силно съдейства за развитието на HCC [33]. По този начин се предполага, че синергичните ефекти на вирусни и метаболитни фактори допринасят за хепатокарциногенезата.
Чернодробната цироза, независимо от етиологията, води до изразени метаболитни нарушения при протеиново-енергийно недохранване [34], инсулинова резистентност на цялото тяло [35,36] и периферна хиперинсулинемия [37-40]. По този начин патофизиологията на чернодробната цироза не е включена в настоящата дискусия за интерактивни и синергични взаимовръзки между специфичните за HCV метаболитни нарушения. Вместо това предлагаме прегледи на следното: (1) инсулинови сигнални фактори и пътища, които играят важна роля в метаболизма на глюкозата и липидите; (2) механизъм на HCV-индуцирана инсулинова резистентност в множество органи; (3) механизми на променен липиден метаболизъм и чернодробна стеатоза при условия на HCV инфекция; (4) взаимодействия между метаболизма на желязото и пътищата на оксидативен стрес при HCV инфекция; (5) въздействие на метаболитни фактори, свързани с гостоприемника, върху HCV-индуцирано метаболитно нарушение; и (6) препоръки за диета, начин на живот и лекарства, насочени към защита срещу или разрешаване на метаболитни нарушения при пациенти, заразени с HCV, които не са с цироза.
ПРЕГЛЕД НА ИНСУЛИНОВОТО ДЕЙСТВИЕ В РЕГУЛИРАНЕТО НА ГЛУКОЗЕН И ЛИПИДЕН МЕТАБОЛИЗЪМ
Инсулинът контролира нивата на кръвната глюкоза след хранене, като увеличава усвояването на глюкоза в мускулите и мазнините и намалява производството на чернодробна глюкоза. Инсулинът стимулира клетъчния синтез на гликоген, протеини и липиди и инхибира гликогенолизата, разграждането на протеините и липолизата, като по този начин улеснява съхранението на тези субстрати. Поглъщането на глюкоза от мускулни и мастни клетки се насърчава чрез инсулинова стимулация на транслокация на глюкозен транспортер (GLUT) 4 от цитоплазмата в плазмената мембрана. Въпреки че инсулинът не влияе на GLUT2 в хепатоцитите, той блокира глюконеогенезата и гликогенолизата и стимулира синтеза на гликоген [41].
Пътят на фосфатидил инозитол 3-киназата (PI3K) -Akt е ключов преобразувател на медиирания от инсулина метаболитен сигнал [41,49]. Самият PI3K се състои от p110 каталитична субединица и p85 регулаторна субединица. IRS протеините активират PI3K чрез фосфорилиране на два SH2 домена в p85 компонента [50]. Впоследствие р110 компонентът на PI3K фосфорилира мембранния фосфолипид фосфатидилинозитол 4,5-бисфосфат в позиция 3 ’. Полученият фосфатидилинозитол 3,4,5-трифосфат (PIP3) регулира фосфоинозитид-зависимата киназа 1, която фосфорилира и активира Akt [51]. Свръхекспресията на фосфатазния и тензиновия хомолог [52] и съдържащия домейна SH2 инозитол-5-фосфатаза [53] води до намалени нива на PIP3, което води до инхибиране на PI3K-Akt пътя.
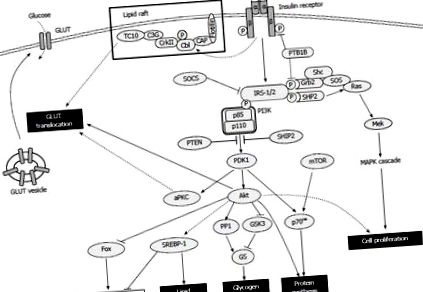
Следните три пътя регулират усвояването на глюкоза: PI3K-Akt [54]; PI3K-атипична протеинкиназа С (aPKC, съставена от PKC ζ/λ) [55]; и експресиран липиден сал CAP-Cbl-TC10 [56,57]. За всички пътят PI3K-Akt е от решаващо значение за транслокацията на GLUT4. При активиране Akt инхибира гликоген синтазата киназа-3 [58] и активира протеинова фосфатаза 1 [59], като по този начин активира гликоген синтазата чрез насърчаване на нейното дефосфорилиране. Самият инсулин инхибира глюконеогенезата и гликогенолизата чрез модулирането на някои свързани с процеса транскрипционни фактори, като чернодробен ядрен фактор-4, членове на семейството на протеиновите вилици и активиращия пероксизомен пролифератор (PPAR) γ коактиватор 1 и увеличава липогенезата чрез модулиране на протеиновия регулаторен елемент на стерол (SREBP) -1 [41]. Инсулин-медиираният PI3K път и мишената на бозайниците за сигнализиране на рапамицин (mTOR) активират p70 рибозомната S6 киназа, която синтезира протеини и модулира машината за превод на бозайници [60]. Инсулинът може също така да стимулира клетъчната пролиферация и диференциация чрез нарушаване на Ras активацията от Grb2-SOS, която модулира сигналната каскада на митоген-активирана протеинкиназа (MAPK) надолу по веригата [61,62] (Фигура (Фигура1 1).
Преглед на инсулиновата сигнализация. Инсулиновото свързване насърчава автофосфорилирането на рецептора и последващото фосфорилиране на тирозин на субстратите на инсулиновите рецептори, които инициират каскада от многостранни метаболитни действия. ГЛУТ: Глюкозен транспортер; IRS: Инсулинов рецепторен субстрат; SOCS: Супресор на цитокиновата сигнализация; aPKC: Атипична протеинкиназа; SREBP: протеин, свързващ стерол регулаторен елемент; mTOR: Прицел на рапамицин при бозайници; КАРТА: Активирана с митоген протеинкиназа; PTEN: фосфатаза и хомолог на тензин; GSK3: Gen-синтаза киназа-3; КОРАБ: SH2 домейн съдържащи инозитол фосфатази.
МЕТАБОЛНО НАРУШЕНИЕ, ИНДУЦИРАНО ОТ HCV
Молекулни механизми на инсулинова резистентност в инфектиран с HCV черен дроб
Молекулярни механизми на инсулинова резистентност в заразени с вируса на хепатит С хепатоцити. Вирусът на хепатит С (HCV) може да инхибира инсулиновата сигнализация директно или индиректно. ГЛУТ: Глюкозен транспортер; IRS: Инсулинов рецепторен субстрат; SOCS: Супресор на цитокиновата сигнализация; SREBP: протеин, свързващ стерол регулаторен елемент; mTOR: Прицел на рапамицин при бозайници; КАРТА: Активирана с митоген протеинкиназа; PTEN: фосфатаза и хомолог на тензин; КОРАБ: съдържащи домейн SH2 инозитол фосфатази; GSK3: Gen-синтаза киназа-3; PI3K: Фосфатидил инозитол 3-киназа; TNF: Туморен фактор на некроза; ER: ендоплазмен ретикулум; PP2A: Протеинова фосфатаза 2А; PA28γ: Протеазомен активатор 28γ.
Механизми на инсулинова резистентност в незаразени с HCV периферни тъкани (главно скелетни мускули)
При нормални физиологични условия скелетните мускули представляват до 75% от инсулинозависимото изхвърляне на глюкоза, докато мастната тъкан представлява само малка част [41]. Въпреки това, пациентите със затлъстяване и диабет едновременно развиват инсулинова резистентност в черния дроб, скелетните мускули и мазнините. Инфектираните с HCV пациенти също развиват инсулинова резистентност в периферните тъкани (главно скелетни мускули), както и в черния дроб, въпреки че молекулярният механизъм остава неясен.
Многоорганно взаимодействие при вирусна инфекция с хепатит С. Висцералното затлъстяване повишава индуцираната от вируса на хепатит С (HCV) инсулинова резистентност на цялото тяло. TNF: Туморен фактор на некроза; FFA: Свободна мастна киселина.
Свързани с HCV промени в β-клетките на панкреаса
Дали патогенезата на HCV-индуцирания диабет е същата като тази на диабет тип 2 остава противоречива, въпреки обширните проучвания на HCV ефектите върху основните характеристики, свързани с диабета, на намалената островна маса и β-клетъчната дисфункция. Проучванията in vitro показват, че HCV инфекцията на човешки β-клетки води до намаляване на стимулираното от клетките освобождаване на инсулин [82] и индуцира нова подобна на апоптоза смърт чрез ER-ангажиран стрес, зависим от каспаза 3, специфичен пътека [83]. За разлика от това обаче, in vivo проучване на трансгенния модел на трансгенния миши HCV ядрен протеин не предполага съществени ефекти върху свързания с панкреаса инсулин, поради компенсаторно увеличение на островната маса, което се е случило без инфилтрация на възпалителни клетки [64].
Тези in vivo резултати са в съответствие с докладваните клинични наблюдения на регулирана секреция на инсулин при инфектирани с HCV пациенти [3,4,9,12-14,18-20,22-24,65,84,85]. Въпреки това са необходими допълнителни проучвания, за да се изяснят ефектите на HCV върху β-клетките на панкреаса и тяхното производство и освобождаване на инсулин.
Свързани с HCV промени в чревните хормони
Стомашно-чревният тракт играе ключова роля в регулирането на метаболизма на глюкозата и енергийната хомеостаза чрез храносмилането и усвояването на хранителни вещества и секрецията на множество чревни хормони. Инкретиновите хормони, глюкагоноподобният пептид (GLP) -1 и глюкозозависимият инсулинотропен полипептид се произвеждат главно в тънките черва и насърчават биосинтезата на инсулина, секрецията на инсулин и преживяването на β-клетките и се инактивират ензимно от дипептидил пептидаза (DPP ) -IV [86]. Освен това, GLP-1 инхибира секрецията на глюкагон и изпразването на стомаха, предизвиква ситост и активира синтеза на гликоген в хепатоцитите [86,87]. За разлика от тях, хормонът грелин, който се произвежда в стомаха, инхибира секрецията на инсулин и стимулира приема на храна [88]. Холецистокининът и гастриновият хормон действат стимулиращо образуването на нови β-клетки чрез стимулиране на неогенезата на островчетата [86].
Досега само няколко доклада разглеждат връзката между чревните хормони и HCV инфекцията. Едно проучване демонстрира, че HCV може да намали серумния GLP-1 чрез регулиране нагоре на експресията на DPP-IV и предполага, че този механизъм може да обясни индуцираната от HCV глюкозна непоносимост [89]. Друго скорошно проучване показа, че циркулиращите нива на активен грелин са положително корелирани със серумните нива на албумин при пациенти, заразени с HCV [90]. Въпреки това, ефектът на грелин върху метаболизма на глюкозата при HCV инфекция остава неясен.
HCV засяга липидния метаболизъм и индуцира чернодробна стеатоза чрез генотип-специфични механизми
Домакинските липиди се манипулират от HCV, за да поддържат неговия жизнен цикъл. Вирусната репликация и сглобяване изискват тясно взаимодействие с липидни капчици и фактори на метаболизма на липопротеините [91,92] в клетката гостоприемник. Освен това, когато зрелият вирус се освободи от хепатоцитите, той се комплексира с липопротеини-гостоприемници [93]. За съжаление, модулирането на процеса на липиден метаболизъм в клетки-гостоприемници чрез HCV може да предизвика чернодробна стеатоза [27]. Този факт се отразява от по-голямото разпространение на чернодробната стеатоза при HCV-инфектирани пациенти в сравнение с общата популация или дори пациенти с хроничен хепатит В [94].
Използвайки HCV ядрен протеинов трансгенен модел на мишка, основният протеин е замесен като ключов индуктор на свързана с HCV чернодробна стеатоза [95] и механизмът е определен, че включва инхибиране както на активността на протеина на микрозомален триглицериден трансфер, така и на липопротеина с много ниска плътност ( VLDL) секреция [96]. Доказано е също, че HCV-индуцираният оксидативен стрес чрез митохондриална дисфункция причинява липидна и протеинова пероксидация, което води до увреждане на износа на VLDL [27]. Освен това е доказано, че основният протеин на HCV нарушава експресията и функцията на PPARγ [97], като по този начин намалява β-окислението на маточни киселини в митохондриите [98] и индуцира експресия на чернодробни гени и транскрипционна активност на SREBP-1, като по този начин синтез на мастни киселини [99]. Активирането на SREBP-1 се насърчава чрез SOCS [100] или PA28γ [101] (Фигура (Фигура 2). 2). Като цяло тези резултати предполагат, че чернодробната стеатоза при HCV инфекция се индуцира от намаляване на износа на липиди от черния дроб, намаляване на окисляването на мастни киселини и насърчаване на синтеза на мастни киселини de novo.
Проучване in vitro показва, че значително натрупване на триглицериди се наблюдава в клетките при трансфекция с HCV генотипове 1 и 3, но не и с генотипове 2, 4 или 5. Освен това се смята, че основният протеин на HCV генотип 3 е три пъти по-мощен при индуциране това натрупване на триглицериди от основния протеин на генотип 1 [102]. В сравнение с генотип 1, HCV генотип 3 също индуцира по-голяма SREBP-1-зависима активност на промотора на синтаза на мастни киселини [103], нарушение на експресията на PPARγ [104] и генериране на по-големи липидни капчици в хепатоцитите [105]. Клиничните проучвания на чернодробна стеатоза при пациенти с HCV генотип 3 показват директни връзки със серумните [20,106,107] и интрахепаталните [108] титри на HCV РНК, които изчезват след ерадикация на HCV чрез антивирусна терапия [107-110] и се повтарят заедно с рецидив на HCV [ 108]. Тези клинични явления не са наблюдавани при проучвания на другите генотипове на HCV, което предполага, че само HCV генотип 3 притежава специфични за вируса цитопатични ефекти, които могат да доведат до стеатоза.
Претоварване с желязо и оксидативен стрес при HCV инфекция
ВЪЗДЕЙСТВИЕ НА СВЪРЗАНИТЕ МЕТАБОЛНИ ФАКТОРИ ВЪРХУ ВРЪЗКА С HCV
Синергичен ефект на висцералното затлъстяване върху HCV-индуцирана системна инсулинова резистентност
Свободните мастни киселини (FFA), произведени и секретирани от висцерални адипоцити, могат да предизвикат инсулинова резистентност в скелетните мускули и черния дроб [120]. Последните проучвания предоставиха съществена информация за механизма на индуцирана от липиди инсулинова резистентност [121]. По-специално беше показано, че вътреклетъчното натрупване на метаболити на мастни киселини предизвиква активиране на нови ПКС (δ, ε, η и θ), което води до нарушаване на инсулиновата сигнализация. В мускулите активираният PKCθ е необходим за медиирано от диацилглицерол (DAG) инхибиране на транспортирането на GLUT4, а в черния дроб е необходим активиран PKCε за DAG-медиирано намаляване на синтеза на гликоген и увеличаване на глюконеогенезата. В допълнение, висцералните адипоцити също са показали, че насърчават инсулиновата резистентност чрез отрицателно модулиране на няколко адипокини, включително TNF-α, адипонектин, лептин и резистин [41]. Хипотезата, предложена от тези кумулирани открития, че висцералното затлъстяване може да причини инсулинова резистентност на цялото тяло и непоносимост към глюкоза чрез FFAs и адипокини, се подкрепя от клиничните проучвания на пациенти с хроничен хепатит С, показващи, че висцералното затлъстяване синергично повишава HCV-индуцирана инсулинова резистентност [32 ] (Фигура (Фигура3 3).
Връзки между метаболитните фактори и резистентността към антивирусна терапия при HCV инфекция
Чернодробната и периферната инсулинова резистентност е силно свързана с отговора на пегилиран интерферон (peg-IFN) -α плюс комбинирана терапия с рибавирин при пациенти с хроничен хепатит С [12,13-18]. Доказано е също, че липсата на отговор на антивирусна терапия при инфектирани с HCV пациенти е свързана с повишена чернодробна експресия на SOCS-3 [122], която е физиологичен отрицателен регулатор на ключов фактор в трансдукцията на IFN-α сигнализиране, сигнален преобразувател и активатор на транскрипция (STAT) -1 [123]. Известно е, че HCV избягва от имунната система на гостоприемника, като пречи на IFN сигнализирането чрез регулиране на PP2A нагоре и хипометилиране на STAT-1, като и двете водят до намалено транскрипционно активиране на IFN-стимулирани гени [124]. По този начин факторите, свързани с IFN сигнализирането, могат да представляват молекулярна връзка между резистентност към антивирусна терапия и инсулинова резистентност при пациенти с хроничен хепатит С. Тази теория се подкрепя допълнително от проучвания, показващи, че SOCS протеините също играят важна роля в инсулиновата резистентност, свързана с метаболитния синдром [100] и че свързаната със затлъстяването повишена регулация на чернодробната експресия на SOCS-3 е свързана с намален биологичен отговор на IFN-α при инфектирани с HCV пациенти [122].
Метаболитните фактори са свързани с чернодробно възпаление, фиброза и хепатокарциногенеза при HCV инфекция
ПРЕПОРЪКИ ЗА ДИЕТА И НАЧИН НА ЖИВОТ ЗА ИНФЕКТИРАНИ ОТ HCV ПАЦИЕНТИ
Препоръките за диета и начин на живот за управление на хроничен хепатит С са по същество същите като тези за затлъстяване, диабет и метаболитен синдром, отразяващи потенциалните отрицателни ефекти на метаболитните фактори върху клиничния ход на HCV инфекцията. Неотдавнашен мета-анализ потвърди, че модификациите на диетата и начина на живот, предназначени за справяне с метаболитния синдром, водят до ефективно намаляване на кръвната захар на гладно, обиколката на талията, кръвното налягане и триглицеридите [131]. Упражнението е добре установена поведенческа модификация, която благоприятства метаболитните нарушения, а молекулярният механизъм е определен, че включва стимулиран от упражнения транспорт на глюкоза чрез активиране на AMP-активирана протеин киназа (AMPK) в скелетните мускули [132]. Тъй като пътят на AMPK е независим от инсулиновата сигнализация, упражненията са ефективни за подобряване на хипергликемията без влияние от инсулинорезистентна среда. Въпреки че прецизното въздействие на диетата и модификациите на начина на живот върху резултатите от HCV инфекция остава да бъде напълно изяснено, ние показахме, че подходящата диета и упражнения могат да повишат инсулиновата чувствителност при инфектирани с HCV пациенти, както и да подобрят ранния вирусен отговор на антивирусната терапия и намаляване на серумните нива на α-фетопротеин [84,85].
Имайки предвид потенциалните ефекти, медиирани от HCV, върху метаболизма на желязото, препоръчително е пациентите, заразени с HCV, да намалят приема на желязо. Въпреки че докладваните натоварвания от HCV-индуцирано натрупване на желязо в черния дроб не са били изключително високи [133,134], прекомерният прием на желязо може да повиши състоянието до опасно ниво [31,118,119]. Следователно, диетичното ограничаване на желязото е важно за инфектирани с HCV пациенти. Доказано е, че приемът на диета с ниско съдържание на желязо с подходящо хранене значително намалява серумните нива на АЛАТ и феритин при пациенти с хроничен хепатит С [135]; в допълнение, намаляването на чернодробното желязо чрез флеботомия също показа, че подобрява серумните нива на ALT [30,136-138] и инсулиновата резистентност [30]. Дългосрочната терапия с диета с ниско съдържание на желязо в комбинация с флеботомия допълнително подобрява чернодробното възпаление и фиброза [138] и намалява риска от хепатокарциногенеза [139]. Събраните резултати от тези клинични проучвания доведоха до оценка на идеалния прием на желязо, като Mehta SH, Brancati FL, Sulkowski MS, Strathdee SA, Szklo M, Thomas DL. Разпространение на захарен диабет тип 2 сред хората с инфекция с вируса на хепатит С в Съединените щати. Ann Intern Med. 2000; 133: 592-599. [PubMed] [Google Scholar]
- Допълнена с кето киселина диета с ниско съдържание на протеини за лечение на възрастни пациенти с хепатит В вирус
- Симплекс на херпес симплекс (HSV-1 и HSV-2) Симптоми на вируса, диагностика, лечение
- Херпес вирус 8 вида - Инфекция
- Вирус на херпес симплекс
- Как да се храните за борба с падащите нива на тестостерон Метаболитни ястия