Проучване EpiFASSTT, Биомедицински науки, Университет Ълстър, Колрейн, Великобритания
Проучване EpiFASSTT, Биомедицински науки, Университет Ълстър, Колрейн, Великобритания
Проучване EpiFASSTT, Психология, Университет Ълстър, Колрейн, Великобритания
Проучване EpiFASSTT, Биомедицински науки, Университет Ълстър, Колрейн, Великобритания
Проучване EpiFASSTT, Психология, Университет Ълстър, Колрейн, Великобритания
Проучване EpiFASSTT, Изследователски институти по компютърни науки, Университет Ълстър, Лондондери, Великобритания
Проучване EpiFASSTT, Биомедицински науки, Университет Ълстър, Колрейн, Великобритания
* Автор за кореспонденция:
Проучване EpiFASSTT, Биомедицински науки, Университет Ълстър, Колрейн, Великобритания
Резюме
ДНК метилирането осигурява привлекателно възможно средство за разпространение на ефектите от влаганите в околната среда по време на живота на плода и въздействие върху последващото психично здраве на възрастните, което води до засилване на сътрудничеството между молекулярни биолози, диетолози и психиатри. Област на интерес е потенциалната роля на фолиевата киселина, не само в затварянето на нервната тръба в началото на бременността, но и в по-късните големи невроразвития събития, с последствия за по-късното социокогнитивно съзряване. Тук поставяме сцена за скорошни открития, като преглеждаме основните събития от невронното развитие по време на живота на плода, с акцент върху тъканите и структурите, където е известно, че се случват динамични промени в метилирането. След това даваме индикация за някои от основните класове гени, насочени към метилиране и важни за неврологичното и поведенческо развитие. И накрая, ние подчертаваме някои когнитивни разстройства, при които промените в метилирането са замесени като играеща важна роля.
Първият представен проект: 6 януари 2016 г .; Приет за публикуване: 17 март 2016 г .; Публикувано онлайн: 20 юни 2016 г.
Д: Епендимален слой; EGL: Външен гранулиран слой; I: Междинна зона; IGL: Вътрешен гранулиран слой; М: Маргинален слой; P: клетки на Purkinje; V: Камерна страна.
Прерисувани елементи с разрешение от [19,20].
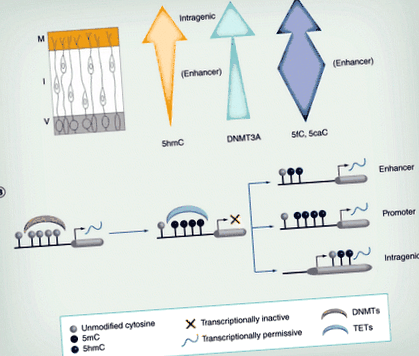
(А) Тъй като невроните мигрират от V, нивата на 5hmC обикновено се увеличават. Освен това неговата локализация се променя, с обогатяване в интрагенни области в М, но при усилватели в I. Експресията на DNMT3A (зелена стрелка) също се увеличава в нервната тръба. Нивата на 5fC/5caC варират по време на миграцията, като са по-силно обогатени в подобрителните региони, особено в междинната зона (синя стрелка). (Б) Метилирането на наивна ДНК чрез DNMTs често се свързва с транскрипционна репресия. Това метилиране може да бъде обърнато от ТЕТ, които генерират 5hmC, обикновено свързани с транскрипционно активиране. Хидроксиметилирането в енхансера и промотора изглежда по-преходно и вероятно отразява активно деметилиране в тези региони, докато интрагенното 5hmC е по-стабилно и може непрекъснато да се изисква за оптимални скорости на транскрипция.
5hmC: 5-хидроксиметилцитозин; DNMT: ДНК метилтрансфераза; I: Междинна зона; М: Маргинална зона; ТЕТ: Десет единадесет транслокази; V: Камерна зона.
Фигура 3. Магнитоенцефалографско сканиране на дете на възраст 8 години и съответния изходен сигнал.
Магнитоенцефалографското сканиране на момче на възраст 8 години показва лесна за употреба, неинвазивна система със съответно измерване на мозъчната активност на екрана.
Последните изследвания доведоха до неочакваното разбиране, че клетките в мозъка имат по-голяма пластичност по отношение на метилирането на ДНК, отколкото се предполагаше преди. Поради репликативното спиране на невроните и догмата, че метилирането може да бъде загубено пасивно само чрез разреждане след удвояване на клетките, се смяташе, че след диференциацията могат да настъпят малко промени. Докато това изглеждаше в противоречие с високите нива на метилтрансферази, наблюдавани в мозъка, едва с откриването на 5-хидроксиметилиране (5hmC) в невроните на ЦНС [1,2], възможен механизъм за динамична промяна и адаптация може да се види. Освен това, неотдавнашното идентифициране на преобладаващо не-CG метилиране (CpH метилиране), съществуващо в невроните, предизвика допълнителен интерес към епигенетичната регулация на мозъка [3]. Заедно с влиятелно предложение за възможния произход на болестта при възрастни [4,5], това доведе до експлозия от изследвания на границата между невроразвитието, епигенетиката и психиатрията.
Метилиране на фолиева киселина и ДНК
Фолатът (наричан фолиева киселина в нейната синтетична форма, предоставена в хранителни добавки или обогатена храна), е водоразтворим B-витамин, който е от съществено значение за жизнеспособното ембрионално развитие и остава важен хранителен компонент през целия живот. Биологично фолатът е необходим за метаболизма с един въглерод, включващ трансфера и използването на единици с един въглерод в основни пътища. Човешкото тяло не може да синтезира фолат de novo и по този начин два критични пътя зависят от достатъчен хранителен прием като източник на един въглерод: синтез на ДНК [9] и цикъл на метилиране на ДНК, разгледан в Kirkbride и др. [10]. Първият вероятно ще бъде особено важен в началото на бременността, когато растежът е най-бърз, тъй като е от съществено значение за клетъчното делене и растежа на тъканите. Последното може да е по-важно в по-късните етапи на невронното развитие, когато се наблюдава ремоделиране на ДНК метилиране в целия геном, както ще опишем по-долу. ДНК метилирането изисква S-аденозилметионин (SAM) като универсален донор на въглерод, който се получава от метиловите групи, получени от фолат.
Моделите на метилиране на ДНК се установяват по време на ембрионалното развитие и профилът на метилиране на ембриона се променя динамично по време на спецификацията и диференциацията на линията. Фолатът е ограничаващ фактор в цикъла на метилиране и следователно неоптимален прием на това основно хранително вещество вътреутробно може да промени епигенетичните белези на основни гени, като тези, замесени в невронното развитие, които са насочени от ДНК метилиране. Тези модификации могат да доведат до устойчиви функционални промени през целия живот, потенциално предразполагащи развиващия се индивид към неврологични разстройства. Влиянието на наличието на фолиева киселина обаче вътреутробно върху моделите на метилиране на нервната ДНК и ефектите върху мозъчната функция в момента са слабо характеризирани. Ембрионално излагане на хранителни вещества вътреутробно се контролира предимно от майката, поради което промяната в майчината диета може пряко да засегне епигенома на развиващия се индивид с по-късни последици от живота.
Доказана роля на добавките с фолиева киселина за предотвратяване на NTD
Кратък график
Пропуски в настоящите знания
Механизъм, чрез който фолиевата киселина предотвратява NTD
Ползи или не от фолиевата киселина в по-късно развитие на мозъка
Въпреки че добавките с фолиева киселина при майките се считат за съществена защитна мярка срещу NTD и се препоръчва на жените да приемат 400 μg/d фолиева киселина периконцептивно и до края на първия триместър, клинични препоръки дали бременните жени трябва да продължат това добавката през последните два тримесечия остава нерешена. Продължаващите добавки са показали, че са ефективни за повишаване на фолатното състояние както на майката, така и на пъпната връв [37]; Въпреки това, ефектите от това увеличение върху майката и бебето трябва да бъдат изяснени напълно.
ASD: Разстройство от аутистичния спектър; NTD: Дефект на нервната тръба.
Образ на мозъка и магнитоенцефалография.
Резюме
Неотдавнашната работа по молекулярна биология показа, че метилирането на ДНК в мозъка е по-динамично, отколкото се смяташе досега.
Едновременно с това епигеномните анализи на големи кохорти, събрани като част от социалната или здравната наука, показват връзка между промените в метилирането на ДНК и конкретни социокогнитивни резултати.
Основно хранително вещество, необходимо за метилиране на ДНК по време на развитието, е фолатът, който осигурява универсалния метилов донор S-аденозилметионин.
Фолатната недостатъчност на бременната майка през първия триместър дава ясен пример, когато приносът на околната среда при майката променя неврокогнитивните резултати при потомството.
Фолатите или други променливи в околната среда могат да повлияят на моделите на метилиране през цялото развитие, но това предстои да бъде проучено.
В този преглед ние подчертаваме ключови етапи по време на развитието на мозъка на плода, където настъпват динамични промени в метилирането и потенциално могат да бъдат нарушени.
Затварянето на нервната тръба в началото на първия триместър е чувствително към фолатна недостатъчност, което може да доведе до дефекти на нервната тръба и този ефект може да бъде имитиран от ДНК метилтрансферазни инхибитори.
По време на ранна и средна бременност вълните от диференциращи се неврони се движат радиално навън в нервната тръба от слоя на стволовите клетки от вътрешната страна, везикуларна страна.
През втория триместър малкият мозък се формира и има хистологично узряване на кората и малкия мозък, тъй като миграцията спира.
През третия триместър настъпват миелинизация и започване на синаптогенеза, както и узряването на мозъчната кора и появата на региони, специализирани за изпълнение на по-високи когнитивни способности.
Миграцията на клетките навън в нервната тръба е придружена от динамични промени в метилирането, с увеличаване на 5hmC и CpH метилиране в узряващите неврони, тъй като се установяват транскрипционни програми.
Освен че вероятно е важно за специфични гени като BDNF и CNTNAP2 метилирането има установена роля в контролирането на HOX, ИЛИ и PCDH генни семейства, участващи в невронното развитие.
Промените в ДНК метилирането са замесени в редица неврокогнитивни нарушения в допълнение към дефекти на нервната тръба, включително синдром на Angelman, нарушения на аутистичния спектър и синдром на Rett.
Благодарности
Авторите са благодарни на A Caffrey и L-A Henry за ценни дискусии.
Разкриване на финансови и конкурентни интереси
Работата в лабораториите на авторите се подпомага от Награда за активиращи изследвания STL/5043/14) от отдела за научноизследователска и развойна дейност на HSC на Агенцията за обществено здраве, Северна Ирландия (на K Pentieva, CP Walsh и H McNulty), грант по проект MRC (MR/J007773/1 на CP Walsh) и безвъзмездна помощ по инициатива Epigenetics от ESRC/BBSRC (проучването EpiFASSTT ES/N000323/1 на CP Walsh, K Pentieva, T Cassidy, H McNulty, DL Lees-Murdock, M McLaughlin и G Prasad). Авторите нямат други свързани или финансови ангажименти с която и да е организация или субект с финансов интерес или финансов конфликт с предмета или материалите, обсъдени в ръкописа, с изключение на тези, разкрити.
При изготвянето на този ръкопис не е използвана помощ при писането.
Свободен достъп
Това произведение е лицензирано под лиценза Attribution-NonCommercial-NoDerivatives 4.0 Unported. За да видите копие на този лиценз, посетете http://creativecommons.org/licenses/by-nc-nd/4.0/
Хартиите със специална бележка са подчертани като: • представляващи интерес; •• от значителен интерес
- Влиянието на епигенетичната диета върху раковия епигеном Епигеномика
- Взаимодействието между диетата, транспортерите на урат и риска от подагра и хиперурикемия в момента
- Ролята на адипоцитната хипертрофия и хипоксия в развитието на свързаната със затлъстяването мастна тъкан
- Група на Световната банка - международно развитие, бедност,; устойчивост
- Wyszukiwarka mieszkań - Unimax Development
