Вишал Вяс
1. Бартс и Лондонското училище по медицина и стоматология, Лондон, Великобритания
2. Лондонски университет „Кралица Мери“, Лондон, Великобритания
3. Сърдечен център „Бартс“, болница „Свети Вартоломей“, Лондон, Великобритания
Pier Lambiase
3. Сърдечен център „Бартс“, болница „Свети Вартоломей“, Лондон, Великобритания
4. Институт по сърдечно-съдови науки, Университетски колеж Лондон, Лондон, Великобритания
Резюме
Затлъстяването вече е основен глобален проблем в областта на общественото здраве, замесен в широк спектър от състояния, засягащи множество телесни системи. Понастоящем тя също е твърдо установена като независим рисков фактор за честотата и прогресията на ПМ. Бързо нарастващите заболеваемост, смъртност и разходи за здравеопазване, свързани с ФП, въпреки прилагането на трите стълба на управлението на ФП - антикоагулация, контрол на скоростта и контрол на ритъма - предполагат, че трябва да се имат предвид други стратегии. Убедителните данни разкриха нови прозрения в биологията на мастната тъкан и нейния ефект върху аритмогенезата, докато вторичните стратегии за превенция, насочени към затлъстяването като част от цялостна програма за управление на рисковите фактори, са доказани като много ефективни. Тук авторите правят преглед на епидемиологичната основа на връзката затлъстяване-ФП, разглеждат нейната основна патофизиология и обсъждат нови терапевтични възможности на хоризонта.
Затлъстяването в световен мащаб е достигнало пандемични размери с повече от 1,9 милиарда възрастни, класифицирани като наднормено тегло през 2016 г., от които 650 милиона са били със затлъстяване. [1] Тъй като това е основен модифицируем рисков фактор за толкова много сърдечно-съдови заболявания, не е изненадващо, че е имало експоненциално увеличение на случаите на ФП, съвпадащо с нарастването на затлъстяването. Въпреки че само през 2010 г. само през 2010 г. е имало 8,8 милиона случая на ФП, до 2060 г. това се очаква да нарасне до 17,9 милиона. [2] Освен това затлъстяването сега е вторият най-голям приписван рисков фактор за ПМ след хипертония. Заедно с наднорменото тегло, то представлява 17,9% от всички случаи на ПМ в проучването за риск от атеросклероза в общностите (ARIC). [3] Докато рискът от ФП следва линеен модел с увеличаване на ИТМ, патофизиологичната основа на връзката затлъстяване-ФП е сложна и многофакторна. [4] В действителност, различни епидемиологични проучвания показват очевиден парадокс по отношение на резултатите при пациенти с ПМ; пациентите с наднормено тегло и леко затлъстяване с ПМ изглежда имат по-добра прогноза по отношение на смъртността от всички причини в сравнение с постно болните с ПМ. [5] Това е в съответствие с други сърдечно-съдови заболявания.
В този преглед ще започнем с подробно обсъждане на епидемиологичните връзки между затлъстяването и AF, подчертавайки ползите и относителните ограничения от използването на ИТМ и други антропометрични маркери при оценка на затлъстяването (затлъстяването обикновено се определя като BMI> 30 kg/m 2). Ще очертаем общите механизми, допринасящи за ПМ, и ще поставим затлъстяването в този контекст, като се фокусираме върху патофизиологичните механизми, които са в основата на връзката затлъстяване-ПМ с акцент върху скорошни прозрения, получени от проучвания върху биологията на мастната тъкан. Накрая обсъждаме нови терапевтични цели и значението на холистичния подход за справяне с този процъфтяващ проблем на общественото здраве.
Епидемиология на затлъстяването - връзка с AF
Ранни връзки между ПМ и затлъстяване са наблюдавани при пациенти, претърпели сърдечна хирургия, като в многобройни проучвания се съобщава за висок ИТМ като основен рисков фактор за постоперативна ПМ. [6–8] Различни проучвания, включително Проучване на сърцето на Фрамингам и мета-анализ е показал, че повишаването на ИТМ е паралелно със значително увеличение на риска от ПМ (Таблица 1). [9,10] Проучването за здравето на жените установи, че за всеки 1 кг/м2 увеличение на ИТМ се наблюдава 4,7% увеличение на риска от развиващ се AF. [4] В кохорта от 47 589 пациенти, проспективно проследени за средно 5,7 години в датското проучване за диета, рак и здраве, ИТМ независимо корелира с повишен риск от ПМ, независимо от пола. [11] В наскоро публикувана кохорта от 67 238 пациенти, извлечена от база данни със здравни претенции в САЩ, затлъстяването е свързано с ново начало на ПМ, независимо от възрастта, диабета, хипертонията и пола. [12]
Маса 1:
Изследване на риска от атеросклероза в общностите
Средно проследяване 17,1 години
Средна възраст 54,2 години
Проучване на здравето на жените
Средно проследяване 12,9 години
Средна възраст 55 години
Проучвания за сърцето и потомството на Фрамингам
Средно проследяване 13,7 години
Средна възраст 57 години
Датско проучване за диета, рак и здраве
Средно проследяване 5,7 години
Средна възраст 56 години
Последващи 8 години
Средна възраст 43,8 години
Пациенти от окръг Олмстед с пароксизмална ФП
Медиана на проследяване 5.1 години
Средна възраст 71 години
Проучване на здравето на жените
Медиана на проследяването 16,4 години
Регистър на раждащите млади жени
Медиана на проследяване 4.6 години
Средна възраст 30,6 години
База данни на третичния медицински център
Средно проследяване 6,4 години
Средна възраст 49 години
Корейска национална база данни за здравно осигуряване
Средно проследяване 7,5 години
Средна възраст 45,6 години
Парадоксът на затлъстяването и AF
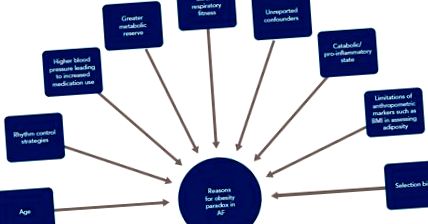
Въпреки че има последователно и широко докладвана връзка между нарастващия ИТМ и риска от ПМ, прогресия и рецидив, се наблюдава противоинтуитивен противоположен ефект по отношение на смъртността. Известен като парадокс на затлъстяването, хората с наднормено тегло (ИТМ 25–30 kg/m 2) и леко затлъстяване (BMI 30–35 kg/m 2) изглежда имат по-ниска смъртност от всички причини в дългосрочни последващи проучвания. [18 –20] Всъщност това явление е вярно за много сърдечно-съдови заболявания. [5] Мета-анализ, обединяващ девет проучвания, включващи 49 364 участници, установява, че азиатските пациенти с ПМ с поднормено тегло (BMI 2) са изложени на повишен риск от емболични събития, като инсулт и системна емболия, както и от сърдечно-съдова и смърт от всички причини. [21] Освен това те откриха, че при всички пациенти с ПМ наднорменото тегло и затлъстяването не са свързани с тези резултати.
За да се анализират потенциалните причини за този парадокс, е важно да се вземат предвид характеристиките на пациентите, включени в тези проучвания. Авторите намекват за различни объркващи фактори, които биха могли да обяснят това явление. Първо, по-голяма част от пациентите с ФП в кохортни проучвания са с наднормено тегло или затлъстяване (78% в проучването на Панди), докато тези пациенти, които имат нормален ИТМ, са склонни да бъдат значително по-възрастни (в кохортата Sandhu et al., Пациентите със затлъстяване са [18,19] Възрастта е особено важна, тъй като тя е основен предиктор за смъртността от всички причини при ФП. [22] Второ, изглежда, че се използват по-широко стратегиите за контрол на ритъма и антикоагулацията при пациенти с висок ИТМ, потенциално за да се отчете по-голям дял на персистиращи ФП в групи с по-висок ИТМ. [18] Трето, пациентите с висок ИТМ са склонни да имат по-високо кръвно налягане, което улеснява по-голямото използване на подходящи сърдечни лекарства. [23] Четвърто, пациентите с привидно нормален ИТМ могат да имат други медицински състояния, които водят до относително катаболно или провъзпалително състояние и че повишеният ИТМ осигурява метаболитен резерв в този случай. Пето, кардиореспираторната фитнес все повече се признава като основен фактор за намаляване на ФП.
Qureshi et al. демонстрира в голяма многорасова кохорта от 64 561 възрастни, че за всеки един метаболитен еквивалент, постигнат по време на тестването на бягаща пътека, има 7% по-нисък риск от инцидентни ФП, дори когато се вземат предвид потенциалните объркващи. [24] В проучването CARDIO-FIT, Sanders et al. показаха при 308 пациенти с ПМ, че за всеки два метаболитни еквивалента, получени след тяхното управление на рисковия фактор и съобразена програма за упражнения, се наблюдава двукратно подобрение в оцеляването без аритмия. [25] Това беше придружено от намалено бреме на AF и подобряване на симптомите. Съвсем наскоро Malmo et al. установи, че след 12-седмична интервална тренировъчна програма за пациенти с пароксизмален AF, тежестта на AF, измерена чрез имплантируеми записващи устройства, намалява с 50% в сравнение с контролите. [26] Освен това авторите наблюдават тенденция към по-малко кардиоверсии и прием в болница заедно със значителни симптоматични подобрения.
Ефектът на ИТМ
Има относителни плюсове и минуси от използването на ИТМ като мярка за затлъстяване. ИТМ е най-широко използваният маркер за затлъстяване с очевидни предимства по отношение на лесното получаване на данни за височина и тегло на пациентите. Той обаче не успява да улови разпределението на телесните мазнини или да вземе предвид телесния състав. [27,28] Например, спортисти с висока мускулна маса и по-голямо тегло могат да попаднат в категория с наднормено тегло, въпреки че имат относително нисък състав на телесните мазнини. От друга страна, централното коремно затлъстяване е свързано с вредни резултати. [29] Различни други антропометрични маркери, като обиколката на талията и съотношението между талията и ханша, могат по-добре да показват разпределението на затлъстяването и да отразяват по-добре риска. Всъщност наскоро в датската кохорта от регистрите се съобщава за чиста телесна маса като преобладаващ антропометричен рисков фактор за AF с други маркери, които не показват връзка с AF, когато се коригира за чиста телесна маса. [30] В кохорта от 130 473 участници в Обединеното кралство на Biobank без свързано с тютюнопушенето заболяване или загуба на тегло не се забелязва значителна разлика в смъртността между нормалните и наднормените групи (стратифицирани от ИТМ). [29] Във всяка група обаче по-високо съотношение между талията и ханша, отразяващо централната адипозия, е свързано с излишен риск от смърт.
Взети заедно, има многобройни потенциални причини, които биха могли да обяснят този очевиден парадокс на затлъстяването, наблюдаван при ФП и други сърдечно-съдови заболявания (Фигура 1). Освен това, трябва да се имат предвид и допълнителни неотчетени объркващи фактори и пристрастност при подбора, като генетично предразположение към AF. Разбира се, предвид подобренията, наблюдавани при резултатите от ФП при управление на рисков фактор и загуба на тегло, очевидният парадокс на затлъстяването не трябва да възпира от агресивна стратегия за оптимизиране на рисковия фактор за управление на ФП.
Патофизиологичният контекст на затлъстяването - AF връзка
Фактори като сънна апнея/синдром на хиповентилация на затлъстяването (често известни заедно като нарушения на дишането, свързани със съня) са нови играчи, които трябва да се вземат предвид. В проучване, разглеждащо пациенти, които се оценяват за бариатрична хирургия, нарушения на дишането, свързани със съня, са налице при 88% от пациентите. [38] Нещо повече, проучването за здравето на съня на сърцето демонстрира, че пациентите с нарушения на дишането, свързани със съня, са били с четирикратно повишен риск от ПМ и трикратно повишен риск от неподдържана камерна тахикардия след корекция за няколко смутители. [39] Ще обсъдим механистичната основа за това в следващия раздел.
Хемодинамични промени, свързани със затлъстяването
Епикардна мазнина, биология на мастните тъкани и AF
Като се има предвид, че разпределението на мастната тъкан е ключов фактор за определяне на сърдечно-съдовия риск, не е изненадващо, че ролята на отделните депа на мастната тъкан представлява голям интерес. [43] С по-усъвършенстваните модалности за изобразяване на напречно сечение като CT и MRI, които все повече се използват за сърдечно изобразяване, висцералният мастен слой, директно покриващ миокарда - епикардната мастна тъкан (EAT) - може да бъде директно изобразен. Трябва да се отбележи, че в литературата перикардната мазнина често се споменава взаимозаменяемо с EAT, но строго казано паракардиалната мазнина се отнася до слоя мастна тъкан извън теменния перикард, а перикардната мазнина е комбинацията както от EAT, така и от паракардиална мазнина. [44]
EAT обхваща 80% от сърдечната повърхност и до 20% от теглото на сърцето, преобладаващо над коронарните, атриовентрикуларните и интервентрикуларните канали, но също така обхваща предсърдията и вентрикулите. [45,46] Няма фасциални граници между EAT и миокарда и те споделят едно и също кръвоснабдяване, коронарните съдове, улеснявайки директните паракринни и вазокринни ефекти върху сърцето. [47] Физиологичните роли на EAT включват терморегулация, източник на енергия и механична защита. [47,48] Семенно следкланично проучване за оценка на затлъстяването на сърцето през 1933 г. показва, че 98% от пациентите със затлъстяване имат прекомерна епикардна мазнина. [49] Данните от изображенията в напречно сечение показват, че обемът на ЕАТ корелира с повишен риск от ПМ с обем на ЕАТ в ляво предсърдие, специфичен предиктор за ПМ. [50-52] Съобщават се за по-лоши резултати след аблация на ПМ, както и след оперативна ФП в сърдечната хирургична обстановка. [51,53] Мета-анализ, потвърждаващ тази връзка между EAT и AF, показва общо съотношение на шансовете от 2,61 за всяко увеличение на стандартното отклонение в обема на EAT с още по-високо съотношение на шансовете за постоянен AF. [54]
Роля на възпалението
Фиброза и липотоксичност
Наред с възпалението, фиброзата се признава като централен фактор за развитието на аритмогенен субстрат. [41] Провъзпалителните цитокини и растежни фактори като активин А и матрични металопротеинази вероятно ще медиират фибротичен ефект върху предсърдния миокард чрез паракринни пътища. [59,60] В проучване на Venteclef et al, само EAT секретом - а не подкожен секретом - прилага се върху предсърден препарат, индуциран на миокардна фиброза с миофибробластите, способни да произвеждат извънклетъчни матрични компоненти. [59] Този фибротичен ефект се дължи на активин А, който възпроизвежда значителния фибротичен ефект, когато се прилага върху предсърдния препарат с повишено регулиране на про-фибротичните гени. Фибротичният ефект се отрича чрез прилагане на активин-А антитяло. [59] Activin-A е член на суперсемейството на TGF-бета и индуцира експресия на TGF-бета1 и бета2 в същото проучване. [59] Установено е, че TGF-beta1 причинява селективна предсърдна фиброза и увеличава уязвимостта към AF, когато е свръхекспресиран в трансгенен модел на мишка. [60] Фиброзата играе основна роля в създаването на електрическа хетерогенност, региони на локалния проводим блок, промени в предсърдната рефрактерност и образуването на реентрантни вериги, които в крайна сметка образуват субстрата за AF. [61,62]
Докато възпалението и фиброзата играят централна роля в затлъстяването - AF каскада, директната мастна инфилтрация на миокарда при затлъстяване също вероятно ще играе роля за предизвикване на вредни структурни и електрически промени в предсърдията. [63] Mahajan et al. използвал овчи модел на затлъстяване при овце, хранени с диета с високо съдържание на мазнини за период от 72 седмици. [63] Обширното изобразяване и електрофизиологичният анализ показаха, че овцете показват по-голямо бреме на AF с разширени предсърдия и EAT мастна инфилтрация на задната лява предсърдна стена. Това беше придружено от значителна предсърдна фиброза, намаляване на скоростта на проводимост в двете предсърдни камери и намалено напрежение на задните леви предсърдни ендокарди. Тези прозрения за затлъстяването и AF трябва да бъдат поставени в контекста на изследването. Използва се лабораторен животински модел на затлъстяване при овце, хранени с висококалорична и богата на мазнини диета, която може да не отразява непременно модела на затлъстяване, наблюдаван в световен мащаб, който се причинява от западната диета и заседналия начин на живот. Авторите признават, че от това проучване не е възможно да се установи причинно-следствена връзка между мастната инфилтрация и AF. [63]
Директни електрофизиологични ефекти на Secretome
В допълнение към възпалителните и фиброзни медиатори, които могат да подкрепят връзката затлъстяване-AF, се съобщава, че висцералната мастна тъкан и нейният секретом имат директни електрофизиологични ефекти в експериментите за съвместно култивиране на кардиомиоцитни леви предсърдия (зайци) [64]. Lin et al. демонстрира, че епикардните, коремните и ретростерналните адипоцити удължават LA потенциала за действие, докато епикардните адипоцити също значително променят потенциала на мембраната в покой. [64] Късният натриев ток, токът от L-тип калциеви канали и преходният външен ток бяха увеличени в съвместно култивираните клетки, докато забавените токове на калиев токоизправител бяха по-малки. [64] Авторите също така отбелязват по-голямо индуцирано от изопреналин забавяне след деполяризация в съвместно култивираните клетки. [64] Взети заедно, тези промени в потенциала за действие биха насърчили аритмогенността в кардиомиоцитите на лявото предсърдие и илюстрираха обширните директни модулаторни ефекти на висцералната мазнина.
Автономна нервна система при затлъстяване
Доказано е, че автономната дисфункция вследствие на затлъстяването със съпътстваща сънна апнея предизвиква AF при животински модели. [65] Освен това EAT съдържа ганглираните плекси, за които се смята, че са ключови медиатори на автономната модулация на сърцето. [66] В кучешки модел от Po et al., Парасимпатомиметици се инжектират в EAT, което води до брадикардия, последвана от преждевременна деполяризация и последваща спонтанна AF. [67] Смяташе се, че мястото на стрелба възниква както от белодробната вена, така и от белодробните вени. Допълнителни доказателства за ролята на ганглираните плекси при ФП идват от аблация на плексите като част от процедурите за аблация на ФП, което има тенденция да намалява индуцируемостта на ФП [68].
Връзката затлъстяване-AF е сложна с множество обиди, като възпаление, фиброза, липотоксичност и вегетативна дисрегулация, в съчетание с хемодинамични и механични промени, образуващи субстрата и спусъка за AF. Със съпътстващите свързани със затлъстяването съпътстващи заболявания като диабет, хипертония, нарушения на дишането, свързани със съня и исхемична болест на сърцето, включени в тази картина, се създава оптимална среда за поддържане на ПМ. Фигура 2 обобщава тези механизми.
- Преобладаване на затлъстяването и предсърдно мъждене, патогенеза и прогнозни ефекти на загуба на тегло и
- Затлъстяване и предсърдно мъждене Изчерпателен преглед на патофизиологичните механизми и
- Предотвратяване на детското затлъстяване Ранни съобщения от епидемиологията - Робинсън - 2017 - Хранене
- Белодробна физиология и патофизиология при затлъстяване Затлъстяване и възпаление на белите дробове
- Патофизиология и клинични характеристики на хипоталамусното затлъстяване при деца и юноши