Резюме
1. Въведение
Безалкохолната мастна чернодробна болест (NAFLD) е едно от най-често срещаните хронични чернодробни заболявания в западните общества [1,2]. Днес се изчислява, че близо 25% от световното население може да страда от NAFLD [1,3,4]. Това състояние се характеризира с хистологични промени в резултат на прекомерно отлагане на липиди в повече от 5% от обема на чернодробните клетки без прекомерна консумация на алкохол [1,5,6]. В почти всички западни страни основните причини за появата на чернодробно заболяване, които могат да бъдат разграничени, са висококалорични и високомаслени диети. Освен това, неотдавнашни проучвания потвърдиха значителна връзка между прогресията на NAFLD и нарастващия брой случаи на диабет тип 2 и затлъстяване [6,7]. В серумите на пациенти със затлъстяване със съжителстващ мастен черен дроб има значителни промени в нивата на адипонектин, лептин и резистин. Тези молекули, заедно с провъзпалителни цитокини, освободени от мастната тъкан, могат да участват в развитието на чернодробна стеатоза [8].
Развитието на NAFLD често започва с леки мастни чернодробни промени и може да прогресира до неалкохолен стеатохепатит (NASH), характеризиращ се с възпаление, придружаващо прекомерно натрупване на липиди, състояние, което е обратимо. Прогресивният NASH обаче води до по-тежки необратими промени, като развитие на чернодробна фиброза, цироза и накрая чернодробна недостатъчност или хепатоцелуларен карцином (HCC) [1,2,4,5,6].
Продължителната, увеличена консумация на хранителни мазнини, надхвърляща енергийните нужди на организма, води до прекомерно натрупване на липиди в хепатоцитите, митохондриална дисфункция и нарушение на окислителния баланс в черния дроб. Прекомерното отлагане на липиди предимно във фракцията на триацилглицерола (TAG) може да инициира каскада от промени, водещи до увеличеното натрупване на диацилглицероли (DAGs) и керамиди (CERs) [2,9]. Прекомерното натрупване на тези липидни фракции може да причини нарушение на липидния метаболизъм, възпалителна реакция и развитие на оксидативен стрес [10,11]. Най-важното в патофизиологията на NAFLD са не само количествата от основните липидни класове, натрупващи се в черния дроб, които са от решаващо значение за влошаването на стеатозата, но и съставът на мастните киселини в тези фракции [10]. Интересното е, че прекомерното натрупване на свободни мастни киселини (FFA) може да определи сенсибилизацията на черния дроб до поредица от „удари“, като по този начин води до стеатоза и развитие на NASH [1].
Прекомерното хранене и особено храненето с високо съдържание на мазнини служат като екзогенен източник на арахидонова киселина (AA, C20: 4), която принадлежи към n-6 полиненаситените мастни киселини (PUFA) и е свързана с метаболитни нарушения. Повишеното предлагане на PUFAs може да доведе до засиленото генериране на провъзпалителни липидни съединения като арахидонова киселина и производни на АА, допринасяйки за клетъчно възпалително сигнализиране [2]. Оксидативният стрес и свързаното с него възпаление играят ключова роля в развитието и прогресирането на NAFLD. Отдавна е признато, че арахидоновата киселина е предшественик на противовъзпалителни съединения, известни също като ейкозаноиди, т.е. простагландини, левкотриени и тромбоксан А2, чието повишено отлагане може да доведе до влошаване на NAFLD [2,12].
Както беше отбелязано по-рано, важно е да се определи моментът, когато възпалението и свързаните с него необратими промени се развиват в хепатоцитите. Промените в активността на ензимите, отговорни за пътя на оксидативен стрес, са добри показатели за това кога трябва да се приложи медицинска намеса. Следователно, следващото проучване има за цел да определи промени в липидния състав по време на развитието на NAFLD. Представените тук данни се отнасят до разликите в съдържанието на АА в избрани липидни фракции в индуцирана с високо съдържание на мазнини NAFLD в различни времеви моменти, което се счита, че играе основната роля в развитието на оксидативния стрес и появата на възпаление. По този начин нашето проучване ще изследва потенциалната връзка между съдържанието на АА и появата на възпаление по време на развитие на безалкохолно мастно чернодробно заболяване.
2. Материали и методи
2.1. Експериментален модел
2.2. Хистологичен анализ на черния дроб
За анализ специфичните части на чернодробните лобове от всеки плъх се фиксират в 10% воден разтвор на формалдехид и след това се дехидратират в серия алкохоли. По този начин подготвените чернодробни тъкани бяха вградени в парафин. Секции (с дебелина 4 μm) се оцветяват с хематоксилин и еозин (Н + Е), както е описано от Konstantynowicz-Nowicka et al. [13].
Подготвените хистологични диапозитиви се оценяват под лек микроскоп Olympus BX41, оборудван с камера Olympus DP12 (увеличение 200 ×; 20 × леща, 10 × окуляр; Хамбург, Германия) от трима независими патолози. В предишното ни проучване [13] същите тъкани бяха оценени за наличие на NAFLD с помощта на системата за оценка на активността на NAFLD (NAS), която показа, че NAFLD се е появила след 3 седмици на HFD.
2.3. Анализ на съдържанието на липидите в черния дроб и плазмата
Отделните метилови естери на мастните киселини в получените плазмени и чернодробни проби се екстрахират с разтвор на хлороформ/метанол (2: 1, v/v) (методът на Folch) [14] и се разделят на фракции - DAGs, TAGs, FFAs и фосфолипиди (PLs) - използвайки тънкослойна хроматография (TLC) [15]. Отделените фракции се трансметилират с 14% метанолов разтвор на борен трифлуорид и се определят количествено в съответствие с времето на задържане на стандартите с помощта на газово-течна хроматография - GLC (Hewlett Packard 5890 Series II Газов хроматограф; Agilent Technologies, CA, USA; съдържащ капиляр колонен и пламъчен йонизационен детектор - HP-INNOWax) - както е описано по-подробно по-рано [15]. Въз основа на състава на мастните киселини, съдържанието на арахидонова киселина в конкретната липидна фракция се изразява в наномоли на грам тъкан.
2.4. Имуноблотинг
Определянето на общата концентрация на протеин в чернодробната тъкан се извършва с използването на комплект за анализ на протеин на бицинхонинова киселина (BCA) с BSA като стандарт. Денситометричният анализ на имуноблотинг сигнала беше извършен със система за визуализация ChemiDoc (BioRad). Експресията на анализираните протеини беше стандартизирана до общата експресия на протеин и контролата беше определена на 100%.
2.5. Определяне на окислителните и антиоксидантните параметри
Преди определянето на компонентите на оксидативния стрес, чернодробната тъкан се хомогенизира в радиоимунопреципитационен тест (RIPA) буфер (25 mg тъкан/250 µL буфер) за малонилдиалдехид (MDA); в ледено студен фосфатен буферен разтвор (PBS) при 20 mg тъкан/1 ml PBS за супероксиддисмутаза 2 (SOD2), каталаза (CAT) и общ антиоксидантен капацитет (TAC); и в това при 10 mg тъкан/90 µL PBS за определяне на 4-хидроксиноненал (4-HNE) и напреднал гликационен краен продукт (AGE). След това центрофугирахме получените хомогенати в RIPA буфер при 1600 × g при 4 ° С в продължение на 10 минути, за да определим количествено MDA. За да се определят количествено CAT, SOD2 и TAC, хомогенатите в PBS се центрофугират при 12 000 × g при 4 ° C в продължение на 5 минути, а пробите се центрофугират при 5000 × g при 4 ° C в продължение на 5 минути, за да се оценят 4-HNE и AGEs. След това супернатантните фракции се преместват в отделни епруветки и се съхраняват при -80 ° С за допълнителен анализ.
Концентрациите на CAT и SOD2 в черния дроб бяха определени с търговски комплекти ELISA от Cloud-Clone Corp. (Хюстън, Тексас, САЩ). Абсорбцията на тези биомаркери беше измерена спектрофотометрично при 450 nm с помощта на четец за микроплаки (Synergy H1 Hybrid Reader, BioTek). Накрая, концентрациите на оксидативния стрес на ензима бяха изчислени от получените стандартни криви. Резултатите се изразяват в пикограми и нанограми на милиграм тъкан за SOD2 и CAT, съответно.
За количествено определяне на съдържанието на MDA в чернодробните хомогенати, ние използвахме комплекта за анализ на реактивни вещества с тиобарбитурова киселина (TBARS) от Cayman Chemical Company (Ann Arbor, MI, USA). Този метод се основава на реакцията на свързване на MDA с тиобарбитурова киселина (TBA) и получените MDA-TBA адукти се измерват колориметрично при 530 nm. След това се изчисляват стойностите на MDA и се изразяват в наномоли на милиграм тъкан.
За да определим концентрациите на 4-HNE и AGE, използвахме комплекти ELISA от Biorbyt (Кеймбридж, Великобритания). Абсорбцията се оценява спектрофотометрично при 450 nm. След това концентрациите на окислителния компонент бяха получени от стандартни криви. Изразените количества 4-HNE и AGE се отчитат като пикограми и нанограми на милиграм тъкан, съответно.
Нещо повече, параметърът на TAC на чернодробната тъкан се определя чрез използването на колориметричен TAC комплект за анализ (Abcam). Абсорбцията е измерена спектрофотометрично при 570 nm. След това параметърът се изчислява съгласно протоколите на производителя и се изразява като наномоли на милиграм тъкан.
2.6. Анализ на данни
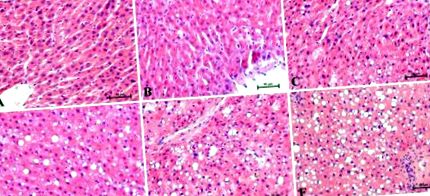
Данните от експеримента са изразени като средно ± стандартно отклонение. Нашият статистически анализ беше извършен с помощта на GraphPad Prism 5 (Калифорния, САЩ). Предположенията на използваните при анализа методи (нормалност на разпределението на данните и хомогенност на дисперсията) бяха проверени с помощта на теста на Шапиро-Уилк и теста на Бартлет. Статистическите различия между групите бяха изследвани чрез еднопосочен тест ANOVA, последван от подходящ post-hoc тест (тест на Тюки и t-тест). За всички данни, р-стойност Фигура 1 са показани представителни хистологични изображения на H + E оцветени чернодробни участъци. Хистологичните изменения бяха оценени от трима независими патолози. Петседмичното хранене с високо съдържание на мазнини повлиява нивото на липидните отлагания в черния дроб и се наблюдава повишено балониране на хепатоцитите. В контролната група (0 седмици) след H + E оцветяване се наблюдават радиално разположени чернодробни трабекули без балонна дегенерация (Фигура 1 А). Всички оценени участъци в края на експеримента в различните моменти от време (1, 2, 3, 4 и 5 седмици) показват лека до тежка стеатоза с линейно увеличение на балонна дегенерация (Фигура 1 B – E) в сравнение с контролата група. С всяка поредна седмица от нашето проучване стеатозата приемаше по-тежък ход. Патолозите забелязаха видима дезорганизация на чернодробния паренхим в отговор на храненето с високо съдържание на мазнини. Най-високата степен на стеатоза и балониране се наблюдава през петата седмица на HFD хранене (Фигура 1 F).
Представителни петна от хематоксилин и еозин (Н + Е) на чернодробните секции в отделните моменти от (A) 0 седмица като контролна група и експериментални HFD седмици: (Б.) 1, (° С) 2, (д) 3, (Е.) 4 и (F) 5. Резултатите от всеки плъх (n = 6) бяха събрани като независими определяния на специфичните части на чернодробните лобове. 200 × увеличение. В долния десен ъгъл на калибриране е равен на 50 μm.
3.2. Промени в съдържанието на арахидонова киселина в черния дроб и плазмата
В черния дроб наблюдавахме значително повишено съдържание на арахидонова киселина във фракцията DAG всяка седмица в групата с високо съдържание на мазнини (първа седмица: + 107,2%; втора седмица: + 94,9%; трета седмица: + 77,5%; четвърта седмица: + 59,8%; пета седмица: + 123,8%; p Фигура 2 А) в сравнение с контролната група. Нещо повече, във фракцията TAG нивото на АА постепенно нараства във всички изследвани групи и тези промени са статистически значими (първа седмица: + 405,2%; втора седмица: + 498,7%; трета седмица: + 571,4%; четвърта седмица: + 815,0%; пета седмица: + 945,5%; p Фигура 2 Б) в сравнение с контролната група. През всяка седмица на хранене с високо съдържание на мазнини открихме също значително повишено съдържание на арахидонова киселина в FFA (първата седмица: + 134,7%; втората седмица: + 93,7%; третата седмица: + 41,6%; четвъртата седмица: + 25,2%; пета седмица: + 97,4%; p Фигура 2 В) и PL (първа седмица: + 89,5%; втора седмица: + 86,4%; трета седмица: + 108,9%; четвърта седмица: + 104,9%; пета седмица: + 119,3%; p Фигура 2 Г) от тази в контролната група.
- Зелето може да ви помогне в борбата с безалкохолната мастна чернодробна болест Други естествени решения, които да опитате - Звук
- Асоциация на безалкохолните мастни чернодробни заболявания с метаболитен синдром независимо от централната
- Зелето може да ви помогне в борбата с безалкохолната мастна чернодробна болест Други естествени решения, които да опитате
- Има ли някаква връзка артериалната хипертония, затлъстяването и безалкохолната мастна чернодробна болест
- 6 съвета за намаляване на мастната чернодробна болест - често усложнение на диабета, затлъстяването - развитие