Резюме
Въведение
T2DM е ендокринно заболяване, което често придружава други метаболитни нарушения, които са потенциално животозастрашаващи [1]. Инсулиновата резистентност (IR) се появява в ранния стадий на T2DM и постепенно води до намалена инсулинова секреторна способност на β клетките поради структурно увреждане, което накрая води до нарушения на глюкозния и липидния метаболизъм [2]. Както е известно, митохондриалният оксидативен стрес е ключов фактор, допринасящ за IR и β клетъчната дисфункция. Излишъкът от реактивни кислородни видове (ROS) може да активира апоптотични фактори надолу по веригата, включително цитохром С (Cyto-C) и AIF и да индуцира β клетъчна апоптоза [3, 4]. В предишните си проучвания открихме, че PR може да намали нивото на FBG на индуцираните от STZ мишки с диабет чрез подобряване на оксидативния стрес и намаляване на експресията на възпалителни фактори ядрен фактор капа В (NF-кВ) и Цито-С [5]. Следователно ние се заехме да изследваме механизма на PR при апоптоза на панкреаса при мишки T2DM.
Традиционно апоптозата се изпълнява от протеиновото семейство каспазна протеаза, които се активират чрез екзогенния път на рецептора на смъртта и ендогенния митохондриален път. Каспазните протеини от семейството увеличават митохондриалната пропускливост, което след това задейства освобождаването на Cyto-C от митохондриите и образуването на индуциращ апоптоза комплекс с Apaf-1, ATP и про-каспаза-9 [6, 7]. Предишни проучвания са установили, че индуциращият фактор на митохондриалната апоптоза (AIF) може да медиира ядрена апоптоза [8, 9]. Смята се, че AIF играе централна роля в независимия от каспаза път на апоптоза. Проапоптотичният ефект на AIF се отразява и в собствената му положителна обратна връзка, т.е. AIF, освободен в цитоплазмата, може да действа върху други митохондрии, увеличавайки тяхната пропускливост и допълнително насърчавайки освобождаването на AIF. AIF също така насърчава освобождаването на Cyto-C, като в крайна сметка активира каспаза-3. В нашето предварително проучване открихме, че PR може да предизвика активирането на Bcl-2, регулаторен фактор на AIF, което показва, че PR може да инхибира апоптозата чрез регулиране на експресията на AIF. Следователно, ние имахме за цел да тестваме тази хипотеза, за да изясним допълнително механизма на PR на T2DM.
STZ е класическо лекарство за предизвикване на диабет при мишки. Мишките, хранени с високо съдържание на мазнини и прилагани STZ, показват клинични прояви на хипергликемия, хиперлипидемия, затлъстяване и хиперинсулинемия [10]. Поради своята нестабилност, STZ разтворът трябва да бъде прясно приготвен и директно инжектиран в гладни мишки през нощта през опашната вена.
PR, едно от активните съединения на Pueraria lobata, е популяризиран като терапия за DM чрез ролята му за повишаване на експресията на инсулин и поддържане на метаболитна хомеостаза при индуцирани от STZ мишки с диабет. В настоящото проучване ние изследваме ефекта от PR върху T2DM. Демонстрираме за първи път, че PR може да инхибира апоптозата на панкреатичните клетки при мишки T2DM чрез регулиране на експресията на протеини от семейство каспаза и AIF.
Материали и методи
Животни
Всички протоколи за животни са одобрени от Институционалната комисия по етика на Медицинския университет в Гуангси (Одобрение № 2012011121). Всички експерименти с животни се провеждат в съответствие с насоките на Ръководните становища за лечение на опитни животни за грижа и използване на лабораторни животни. Здрави мъжки мишки кунмин с тегло приблизително 18–22 g са закупени от Експерименталния център за животни на Медицинския университет в Гуангси (регистрационен номер SCXK 2010-0002). Животните бяха аклиматизирани в контролирани от температурата (22–25 ° C) лабораторни условия с 12-часов цикъл светлина-тъмнина и им беше предоставен свободен достъп до чешмяна вода и стандартна чау от гризачи.
Материали
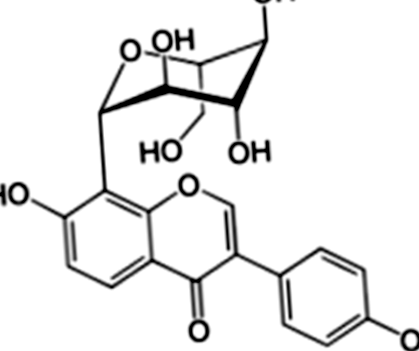
Препарат от пуерарин (чистота> 99%) е осигурен от Катедрата по фармацевтична химия, Медицински университет Гуангси (Нанинг, Китай). Метформин е закупен от Zhongxin Pharmaceutical Co., Ltd. (Тиендзин, Китай). Стрептозотоцин (STZ) е получен от Sigma Co., Ltd. (Мисури, САЩ). Молекулярната структура на PR е показана на фиг. 1. FBG и химията на кръвта са измерени съответно с Roche ACCU-CHEK ® Performa (Strip lot: 470664, Швейцария) и автоматичен биохимичен анализатор (Hitachi Model 7100 Automatic Analyzer). Останалите материали са описани в следващите раздели.
Химичната структура на пуерарин, изолиран от P. lobata (Уилд.)
Експериментален дизайн [11]
Диабетичните мишки тип 2 са установени чрез диетично хранене с високо съдържание на мазнини и инжектиране на STZ. Здрави мъжки мишки Kunming бяха хранени с диета с високо съдържание на мазнини в продължение на 1 месец и бяха инжектирани интравенозно с 80 mg kg -1 телесно тегло STZ след 12 часа бързо. Прясно приготвеният разтвор на STZ се разтваря в охладен физиологичен разтвор без светлина. А метформинът се разтваря директно във физиологичен разтвор за орална сонда. Седемдесет и два часа по-късно се измерва FBG и мишките с FBG ≥ 11,1 mmol L -1 се считат за T2DM мишки. В допълнение, здрави мъжки мишки кунмин, хранени със стандартна чау от гризачи, служеха като нормални контроли. Опитните животни бяха разделени на следните групи:
Група 1 здрави мишки, лекувани с физиологичен разтвор чрез сонда: нормален контрол.
Група 2 Диабетни мишки тип 2, лекувани с физиологичен разтвор чрез сондаж: контролен модел.
Група 3 Диабетни мишки тип 2, лекувани с 320 mg kg -1 метформин чрез сондаж: положителна контрола.
Група 4 Диабетни мишки тип 2, лекувани с 80 mg kg -1 PR чрез сондаж (предишното ни проучване установи, че 80 mg kg -1 PR е ефективна доза [5]).
Метформин и PR се дават ежедневно по едно и също време в продължение на 15 дни.
Биохимични измервания
Нивата на FBG са открити по време на експеримента на 0, 7 и 15 ден от лечението, като се използва Roche ACCU-CHEK ® Performa през кръв от вената на опашката. Пробите от серума се събират от цяла кръв чрез центрофугиране при 1300 ×ж за 10 минути за откриване. Съдържанието на FINS в серума е измерено чрез комплекти ELISA за мишки Cusabio (Huamei Biotech Co., Ltd., Hubei, China). Серумните нива на TC, TG, LDL и HDL са анализирани с помощта на наличните в търговската мрежа комплекти (Jiancheng Bioingineering Institute, Nanjing, China).
Патологично изследване
Направен е коремен разрез за събиране на панкреаса. Тъканите на панкреаса се фиксират в 10% параформалдехид за 24 часа и след това се влагат в парафин. Срезите (5 μm) бяха подложени на редовно оцветяване с хематоксилин-еозин (HE) и наблюдавани под светлинен микроскоп Olympus CX4 (Япония).
Трансмисионна електронна микроскопия
Тъканите на панкреаса, използвани за изследване с електронна микроскопия, се отстраняват под 0 ° C, нарязват се на малки парченца и веднага се фиксират в 2,5% предварително охладен глутаралдехид. Ултратънки срезове (70 nm) се подлагат на оцветяване с уранилацетат и оловен цитрат. И накрая, пробите бяха наблюдавани при трансмисионна електронна микроскопия (Hitachi H-7650).
Анализ на апоптоза на β-клетки на панкреаса
Комплектът за откриване на клетъчна смърт in situ (Roche, Германия) се прилага върху панкреасната тъкан за терминално дезоксинуклеотидил трансфераза-медиирано dUTP маркиране на ник края (TUNEL). Апоптотичните клетки бяха открити под наблюдението на светлинен микроскоп чрез цветната реакция.
Western blot анализ
Пробите от панкреаса се хомогенизират в лизисен буфер и се екстрахира общ протеин. Концентрациите на протеини се определят с помощта на реагент за анализ на протеин (Bio-Rad). За Western blot анализ, протеиновите лизати се разтварят чрез SDS-полиакриламиден гел електрофореза и се прехвърлят върху поливинилдифлуоридни мембрани. Мембраните бяха блокирани с PBST буфер (1% Tween-20, PBS) за 2 часа при стайна температура и след това инкубирани с първични антитела срещу каспаза-3, 8, 9 и AIF (1: 1000 Санта Круз, САЩ) за една нощ в 4 ° С. След три измивания, петна се инкубират с кози анти-заешки и/или кози анти-миши конюгиран пероксидазен хрян вторичен IgG (Boster Biotechnology) в продължение на 2 часа при стайна температура. Имунореактивните ленти се визуализират с диаминобензидин. Представителните ленти бяха измерени чрез софтуер за изображения на Scion (Scion Corp., Frederick, MD). Протеиновите нива бяха нормализирани до тези на β-актина.
статистически анализи
Данните са изразени като средната стойност ± S.E. Значителните разлики между групите бяха анализирани с еднопосочни ANOVA, последвани от тестове на Tukey за сравнения между групи, използващи SPSS16.0. P-стойности
Резултати
Ефект на PR върху серумни нива на FBG и инсулин при T2DM мишки
За да изследваме хипогликемичния ефект на PR върху T2DM мишки, ние прилагахме 80 mg kg -1 PR през устата в продължение на 15 дни на диети с високо съдържание на мазнини и индуцирани от STZ мишки Kunming. Както е показано на фиг. 2 и таблица 1, пероралното приложение на PR ефективно намалява нивото на FBG спрямо T2DM мишки в сравнение с контролната група на модела, както и групата, лекувана с метформин. Съдържанието на FINS значително намалява при T2DM мишки, прилагани метформин в сравнение с контролните модели. FINS бяха намалени при мишки, лекувани с PR, показващи разлика (Фиг. 3 и Таблица 1).
Ефект на PR върху серумни липидни профили при T2DM мишки
Хипергликемията често се придружава от хиперлипидемия. По този начин, ние също измерихме нивата на TC, TG, LDL и HDL, за да наблюдаваме промени в липидния метаболизъм при T2DM мишки. Серумните нива на TC, TG и LDL бяха намалени чрез PR лечение в сравнение с нелекувани мишки с диабет. В допълнение, PR лечението повишава нивото на HDL при мишки с диабет в сравнение с контролните модели (Фиг. 4 и Таблица 2).
Ефект на PR върху морфологичните промени в панкреаса на T2DM мишки
Оцветената от НЕ панкреасна тъкан показва, че клетъчната структура се поддържа при здрави мишки. В сравнение с островчетата в нормални проби, в контролната група на модела се наблюдават оскъдност и кавитации поради щетите, причинени от инжектирането на STZ. Щетите са облекчени от прилагането на PR, както е показано на фиг. 5 и таблица 3.
Ефект на PR върху панкреатичната ултраструктура при T2DM мишки
Наблюдението с ултраструктура осигурява ясен и директен поглед върху органелите. Както е показано на фиг. 6 и таблица 4, ядрените пикнози и деформационни характеристики на апоптозата, както и митохондриалната кавитация, са наблюдавани в островните клетки на мишки с диабет. За разлика от тях, мишките T2DM, третирани с PR, показват относително по-малко ядрени деформации и кавитални митохондрии.
Ефект на PR върху панкреатичната апоптоза при T2DM мишки
Оцветяването с TUNEL, при което положителните клетки изглеждат кафяви, беше проведено за изследване на апоптозата в панкреаса. Както е показано на фиг. 7 и таблица 5, броят на положителните клетки е по-голям при мишките T2DM в сравнение с нормалните контроли. Лечението с PR, както и метформин значително отслабва намалената жизнеспособност на клетките.
Ефект на PR върху протеиновите експресии на каспаза-3, 8, 9 и AIF при мишки T2DM
Каспазното семейство протеини участва в индуцирането на апоптоза. AIF също е решаващ фактор, отговорен за митохондриалната апоптоза. Следователно ние изследвахме дали PR повлиява експресията на протеини от семейството на каспаза и AIF при T2DM мишки. Както е показано на Фиг. 8 и Таблица 6, се наблюдава повишена каспаза-3, 8, 9 и AIF в панкреатичните тъкани от диабетни мишки. PR лечението ефективно премахва повишените нива на експресия на протеини на протеините от семейство каспаза и AIF.
Дискусия
Относителният дефицит на инсулин е добре известен решаващ фактор за прогресията на T2DM, който допринася за увреждането и апоптозата на островните β клетки [12]. По този начин, възстановяването на β клетки на островчета е ефективна терапевтична цел за лечение на T2DM. В настоящото проучване демонстрирахме, че PR може да отслаби индуцираната от STZ апоптоза на панкреатичната клетка чрез инхибиране на експресията на протеини от семейство каспаза и AIF.
PR, изофлавоноид, е основният активен компонент на P. lobata. Съобщава се, че PR има антиоксидативни, хипотензивни и хипогликемични активности [13,14,15]. Предишни проучвания демонстрират, че PR оказва защитни ефекти върху диабетно увреждане на бъбреците, сърдечна недостатъчност, диабетна кардиомиопатия, сърдечна фибробластна пролиферация, метаболизъм на скелетната мускулатура и метаболизъм на липидите в черния дроб [16,17,18,19,20,21,22]. Хипогликемичният ефект на PR върху захарен диабет е потвърден от предишни проучвания [15, 23, 24]. В нашето предишно проучване лечението с PR намалява нивото на FBG при мишки с диабетна нефропатия чрез отслабване на оксидативния стрес. Друго предишно проучване установи, че PR се разпространява в панкреаса, което може да обясни хипогликемичната проява на PR при диабет [25].
Индуцираният от глюкоза оксидативен стрес при диабет би повлиял регулирането на инсулина, което може да доведе до намаляване на синтеза на инсулин и да насърчи дисфункцията на β клетките. Митохондриите се увреждат, когато са изложени на прекомерни свободни радикали, които нарушават дихателните енергийни пътища [26]. Контролът на кръвната захар е в основата на лечението на СД. В допълнение, увреждането на β клетки може да бъде терапевтична цел. За да открием ефекта на PR върху панкреаса, изследвахме ултраструктурата на панкреаса и измерихме експресията на свързани с апоптозата протеини.
Защитният ефект на PR върху апоптозата е потвърден допълнително чрез патологични и ултраструктурни наблюдения. PR лечението отслабва анормалната морфология на островчетата, включително формата и целостта на клетките. По-конкретно, ядрената деформация и митохондриалната кавитация бяха намалени след PR лечение. Тези ефекти могат да се дължат на инхибирането на каспаза-3, 8, 9 и пътя на AIF; въпреки това сигналната пътека на AIF надолу по веригата все още се нуждае от допълнителна проверка.
Колективно нашите открития дават нови прозрения за патогенния процес на нараняване на панкреаса и идентифицират PR като нова терапия, насочена към пътя на каспаза/AIF/апоптоза.
- Еволюция на диабетната терапия за медицинско хранене Следдипломно медицинско списание
- Диетично управление на захарен диабет с фокус върху Нигерия Udogadi International Journal от
- Обяснението на неуспехите в терапията на затлъстяването ще намали силата на волята, целевата грешка в изчислението или
- История на диабета - История на захарен диабет
- Рецидив на жлъчния камък след успешна терапия за разтваряне SpringerLink