Cadence True
1 Кардиометаболитен здравен отдел, Национален изследователски център за примати в Орегон, Beaverton OR
Тайлър Дийн
1 Кардиометаболитен здравен отдел, Национален изследователски център за примати в Орегон, Beaverton OR
Диана Такахаши
1 Кардиометаболитен здравен отдел, Национален изследователски център за примати в Орегон, Beaverton OR
Елинор Съливан
2 Отдел по неврология, Национален изследователски център за примати в Орегон, Beaverton OR и Катедра по физиология на човека, University of Oregon, Eugene OR
Павел Киевит
1 Кардиометаболитен здравен отдел, Национален изследователски център за примати в Орегон, Beaverton OR
Свързани данни
Резюме
ОБЕКТИВЕН
Определете дали консумацията на храна с високо съдържание на мазнини (HFD) при нечовешки примати променя способността на потомството да се адаптира метаболитно към хранителни и калорични предизвикателства.
МЕТОДИ
Потомци от язовири от японски макаки, хранени или с контролна диета, или с HFD, са били отбити от контролна диета, създавайки две групи: HFD на майката (mHFD, n = 18) и диета за контрол на майката (mCTR, n = 12). Мъжките и женските потомци са били изложени на 5-дневно ограничение от 30% калории и на 35-дневно предизвикателство с високо съдържание на мазнини (HFD), съответно на 16 и 24 месеца. Измервани са калориен прием, телесно тегло и енергийни разходи.
РЕЗУЛТАТИ
Потомците от двете групи показват сходно телесно тегло, прием на храна и метаболитни адаптации до 5-дневно ограничение на калориите. mHFD потомството демонстрира повишен прием на храна и ранно наддаване на тегло в отговор на 35-дневно предизвикателство с HFD; груповите разлики в теглото обаче се разсейват по време на предизвикателството. За разлика от mCTR животните, групата mHFD има значително увеличение на инсулина на гладно след остра експозиция на HFD.
ЗАКЛЮЧЕНИЯ
Настоящите констатации показват, че потомството, изложено на HFD при майката, показва до голяма степен подобни метаболитни адаптации към ограничаването на калориите като потомството, изложено на диета за контрол на майката, но забавена адаптация при излагане на остро предизвикателство на HFD.
Въведение
Детското затлъстяване има дългосрочно вредно въздействие върху метаболитното здраве. Развитието на затлъстяване в ранна възраст показва, че тези индивиди вероятно ще страдат от метаболитна дисфункция през значителна част от живота си. В допълнение, по-голямата част от интервенциите за отслабване имат ниска ефективност и възстановяването на теглото е често срещано в дългосрочен план (1–3), създавайки доживотна борба със затлъстяването. Многобройни фактори допринасят за нарастващото разпространение на детското затлъстяване, включително нарастващата наличност на диети с високо съдържание на мазнини и захар и намаляване на физическите упражнения (4). Затлъстяването на майките също е замесено като фактор, допринасящ за детското затлъстяване при потомството (5–10). Като се има предвид, че 38% от жените в Съединените щати са със затлъстяване (11), затлъстяването при майките вероятно представлява важен и преобладаващ рисков фактор за бъдещите поколения.
Методи
Животни, майчина/постнатална диета и телесно тегло
Разход на енергия
Индиректната калориметрия се извършва преди и по време на ограничаването на калориите и предизвикателствата на HFD, както и 7 дни след ограничаването на калориите, както е описано по-рано (17, 23, 24). Маймуните се аклиматизират за 15 часа, след което се събират метаболитни измервания за 24 часа. Маймуните бяха хранени с банан сутрин (0900h) и имаха неограничен достъп до нормалната си диета следобед (1400h); водата се предлагаше ad libitum. Позната маймуна беше настанена срещу маймуната, която се подлага на метаболитни тестове, за да предотврати социалната изолация. За анализ са използвани изчисления на софтуер на Oxymax за топлина (kcal/час) и дихателни коефициенти (RQ, VC02/VO2).
Предизвикателство за ограничаване на калориите
Животните са претърпели ограничение на калориите на приблизително 16 месечна възраст. Преди експеримента, животните са били успокоявани за една нощ на гладно и са претегляни. За първи път животните са били подложени на базална индиректна калориметрия и веднага са били ограничени до приблизително 30% от индивидуалния им калориен прием през следващите пет дни. На петия и последен ден непрякото калориметрично тестване беше повторено. След това животните бяха върнати на свободен достъп до храна и повторно тествани за индиректна калориметрия 7 дни по-късно, представляваща точката на отскок.
Предизвикателство на HFD
Приблизително на 24-месечна възраст животните са били подложени на изходни тестове, включително тестове за глюкозен толеранс и индиректна калориметрия. Измерват се пет дни първоначален прием на храна за CTR, след което животните се превключват на HFD и се измерва консумацията на храна за първите 15 дни от 35-дневно предизвикателство. Между 15–35 дни от предизвикването на HFD, метаболитните мерки бяха събрани отново, включително индиректна калориметрия в метаболитната камера на приблизително 16–24 дни след HFD предизвикателство и тестове за толерантност към глюкоза на приблизително 30–35 дни след предизвикване на HFD, извършени, както е описано преди (20).
Автоматизирани измервания на приема на храна
Приемът на храна по време на предизвикателството с HFD се измерва с помощта на автоматизирана система за дозиране на храна (Med Associates, Inc., St. Albans, VT) в потомство, настанено в група, както е описано по-рано (17). Животните бяха идентифицирани чрез AVID микрочипове, имплантирани преди това в китката им (Avid Identification Systems, Inc., Norco, CA). Броят на дръпванията на лоста и животното, свързано с всяко дръпване, бяха записани и използвани за изчисляване на калорийния прием. Този метод преди това е валидиран в групово настанени NHPs (25), но представлява приблизителна оценка, тъй като животните не могат да консумират всяка пелета, която се дозира. Потомците бяха представени с CTR диета [(TestDiet 5052, Primate Tablet # 1814687, 5AP7, Richmond, IN) или HFD (TestDiet TAD 5L0P, Primate Tablet # 1814863, 5ASN)], предоставена ad libitum.
Анализи на хормони
Плазмените концентрации на инсулин и лептин са измерени от Endocrine Technologies Support Core (ETSC) в Националния изследователски център за примати в Орегон (ONPRC) от кръвни проби на гладно, събрани в GTT. Концентрациите на инсулин бяха определени с помощта на автоматична клинична платформа, базирана на хемилуминесценция (Roche Diagnostics Cobas e411, Indianapolis, IN); този анализ е използван преди това при нечовешки примати (26). Диапазонът на инсулина е 0.2 - 1000 uIU/ml, с вариации в рамките на и между теста по-малко от 7%. Концентрациите на лептин са измерени чрез радиоимунологичен анализ (Millipore HL-81K, Billerica, MA), както е описано по-рано за нечовешки примати (27). Диапазонът на анализа е бил 0,78–100 ng/ml, а вариациите в интра- и между теста са съответно 13,9% и 24,7%.
Статистика
Данните бяха анализирани в SPSS, с изключение на площта под кривата, която беше изчислена в Prism GraphPad. Данните бяха проверени за нормалност и log10 трансформиран, за да се коригира за нормалност, когато е възможно. За единични времеви точки беше направен анализ на линеен модел, за да се изследва основният ефект от майчината диета. Надлъжните данни бяха анализирани чрез смесени модели на повторен анализ на измерванията и анализирани с основните ефекти на майчината диета, времето и тяхното взаимодействие. За да се изследва ефектът от възрастта и теглото при зачеване, както и пола на потомството върху връзката между диетата на майката и променливите на резултата, тези променливи бяха оценени като потенциални ковариати в двата типа анализ. Окончателният скромен модел беше определен чрез обратен подбор. Всяка ковариация с p-стойност на основния ефект по-малка от 0,1 е оставена в модела и е докладвана в текста за значими констатации. Всички графики са генерирани в Prism GraphPad.
Резултати
Базова метаболитна физиология на 16 и 24 месечна възраст
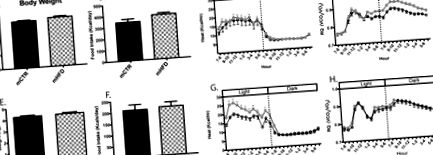
Метаболитни профили на mCTR и mHFD животни на 16 (A – D) и 24 (E – H) месечна възраст. Телесното тегло (A, E), приемът на храна (B, F), топлината (kcal/час; C, G) и коефициентът на дишане (RQ, VCO2/VO2; D, H) са измерени по време на индиректната калориметрия на 16 месеца от възраст (горен панел) и 24-месечна възраст (долен панел) непосредствено преди метаболитни предизвикателства. * Обозначава статистически значима разлика между mCTR и mHFD средно през нощта RQ. mCTR n = 12, mHFD n = 16–18.
Предизвикателство за ограничаване на калориите
Ефекти от ограничаването на калориите върху потомството, консумиращо HFD. Отделна кохорта от потомство беше изложена на mCTR или mHFD условия, след което всички потомци бяха отбити върху HFD в периода след отбиването (pHFD). Измерва се първоначалното телесно тегло преди ограничението на калориите (A), както и телесното тегло в последния ден от ограничаването на калориите с HFD, за да се определи промяната в BW (B). Средният дневен прием на храна е измерен в индиректната калориметрична камера непосредствено преди ограничаването на калориите (изходно ниво), в последния ден от ограничаването на калориите и 7 дни по-късно (Rebound; C). Индиректната калориметрия беше извършена на изходно ниво, по време на ограничаване на калориите и по време на представяне са представени графики за отопление и почасови графики за топлина (kcal/hr, D – F) и дихателен коефициент (RQ, G – I). * означава статистически значима разлика от mCTR базова линия, # означава статистически значима разлика от mHFD базова линия. mCTRpHFD n = 5–6, mHFDpHFD n = 5–9.
Предизвикателство на HFD
Приблизително на 24-месечна възраст, потомството на CTR след отбиването е било изложено на HFD в продължение на 35 дни, за да се определи дали консумацията на HFD при майката увеличава податливостта към вредните ефекти от експозицията на HFD по-късно в живота, както се наблюдава при гризачи (28, 29). Автоматизираните измервания на приема на храна при групово настанени животни през първите 15 дни разкриват значителен ефект на HFD при майката за увеличаване на консумацията на HFD калории (майчина диета F1,26 = 8.02, p Фиг. 5А). Средният дневен прием на храна е изчислен за дни, когато са били налични измервания от всички животни, и по подобен начин се установява значително увеличение на консумацията на HFD в групата на mHFD (mCTR: 2,85 log kcal/ден n = 12, mHFD 3,01 log kcal/ден n = 18, p Фиг. 5B). В съответствие с първоначалното умерено увеличение на консумацията на калории в групата на mHFD, се наблюдава повишено наддаване на тегло в Ден 8 на предизвикателството (mCTR: 2,4%, n = 12; mHFD: 6,7%, n = 18, p = 0,02; Фиг. 5C) и тенденция за общ ефект на майчината диета (майчина диета F1,28 = 4.02, p = 0.06; смесен модел, коригиран за теглото на язовира при зачеването p Фиг. 6). Мащабът на промените в мерките за разход на енергия е малко по-различен между групите. RMR се увеличава между изходното ниво и HFDC в mHFD група (mHFD: изходно ниво 0.77 log kca/hr, HFDC 0.87 log kcal/hr, n = 18, p Фиг. 6A и B), но не и при mCTR животни. По същия начин TEE се увеличава между изходното ниво и HFDC за mHFD група (mHFD: изходно ниво 344 kcal/ден, HFDC 387 kcal/ден, n = 18, p = 0,02; смесен модел, коригиран за пол p = 0,01; не mCTR групата. По време на HFDC и двете групи демонстрират намаляване на дневния RQ (mCTR: изходно ниво 0,84, HFDC 0,81, n = 12, p Фиг. 6D и E; смесен модел, коригиран пол p Фиг. 6D и F).
Разходи за енергия и окисляване на гориво по време на предизвикателството с HFD (HFDC). Часова цифра за топлина по време на HFD предизвикателство (A) и метаболизъм в покой (средно kcal/час между 0100–0500; B) и общ разход на енергия (сбор от kcal/hr между 0800–0700; C). Почасова цифра за RQ по време на HFDC (D) и изчисляване на средните дневни (E) и нощни RQ (F). * означава статистически значима разлика от mCTR базова линия, # означава статистически значима разлика от mHFD базова линия. mCTR n = 12, mHFD n = 18.
Интравенозни тестове за толерантност към глюкоза (ivGTT) бяха направени непосредствено преди HFDC (изходно ниво) и през последните пет дни от 35-дневния HFDC (фиг. 7). Нивата на глюкозата на гладно не се различават между mCTR и mHFD групите нито в изходното ниво, нито в края на HFDC (фиг. 7А). Инсулинът на гладно се е увеличил значително между изходното ниво и HFDC в групата на mHFD (mHFD: изходно ниво 0,45 log ug/mL, HFDC 0,78 log ug/mL, n = 18, p Фиг. 7В), но не и в групата mCTR, но няма разлика между двете групи бяха наблюдавани във всеки един момент от времето. HOMA-IR, индекс на инсулинова резистентност, значително се увеличава по време на HFDC и в двете групи (mCTR: изходно ниво -0,35 log HOMA-IR, HFDC -0,11 log HOMA-IR, n = 12, p = 0,05; mHFD: изходно ниво -0,45 log HOMA-IR, HFDC -0.01 log HOMA-IR, n = 18, p Фиг. 7C). Не се наблюдава разлика в HOMA-IR между двете животински групи. Глюкозната площ под кривата (AUC) от нула по време на ivGTT не се различава значително между групите или времевите точки (фиг. 7D). AUC на инсулина се повишава значително между изходното ниво и HFDC и за двете групи (mCTR: изходно ниво 3,16 log AUC, HFDC 3,25 log AUC, n = 12, p Фиг. 7Е); обаче няма разлика в нито един момент от времето между mCTR и mHFD групата. Нивата на серумен хормон на лептин (≈ 2,5 ng/ml) не се влияят от експозицията на HFD на майката или от HFDC (данните не са показани).
Измервания на глюкоза и инсулинова чувствителност преди и по време на HFDC. Интравенозните тестове за толерантност към глюкоза (ivGTT) се извършват непосредствено преди излагане на HFD (изходно ниво) и в дни 30–35 от предизвикателството на HFD. Първоначалните стойности на глюкоза (A) и инсулин (B) на гладно бяха използвани за изчисляване на HOMA-IR ((глюкоза mg/dL × инсулин)/405; C). ivGTT площта под кривата (AUC) за изчисления за глюкоза (D) и инсулин (E) се изчислява от нула в началото и по време на HFDC. * означава статистически значима разлика от mCTR базова линия, # означава статистически значима разлика от mHFD базова линия. mCTR n = 12, mHFD n = 18.
Дискусия
Настоящото проучване изследва ефектите от консумацията на HFD при майката върху способността на потомството да се адаптира към промените в калориите и хранителните вещества. Въпреки че имаше тънки разлики в метаболитните реакции при 5-дневно ограничаване на калориите и 35-дневно предизвикателство с HFD, животните се приспособиха към тези метаболитни предизвикателства до голяма степен по подобен начин, независимо от диетата, консумирана от майките им. Една разлика, наблюдавана между групите, е, че потомството на mHFD показва повишен прием на храна в сравнение с потомството на mCTR, когато се предизвиква остро с HFD, което съответства на по-голямо наддаване на тегло през първата седмица на предизвикателството. В допълнение, базалната секреция на инсулин значително се увеличава след остра експозиция на HFD в групата mHFD, но не и в групата mCTR. Тези открития могат да покажат, че потомството на mHFD е по-чувствително към отрицателните метаболитни ефекти на HFD, ефект, който може да бъде по-изразен при продължителна експозиция.
Констатациите от настоящото проучване са в контраст с констатациите при миши модели на майчино затлъстяване, които показват, че потомството от затлъстели майки набира повече тегло, когато е изложено на HFD по-късно в живота (28, 29). Докато mHFD животните ядат повече и наддават повече на HFD първоначално, този ефект изглежда се разсейва към края на предизвикателството. Това може да означава кратко забавяне в началото на адаптивните отговори на по-високата консумация на мазнини в потомството на mHFD, но че общите механизми са налице. В допълнение към острия кратък характер на експозицията на HFD, следва също така да се отбележи, че животните в настоящото проучване са все още млади и активни и следователно вероятно по-устойчиви на обезогенните ефекти на HFD от възрастните животни. Следователно остава възможно консумацията на HFD при майките да повлияе на способността на потомството да се адаптира към консумацията на HFD, но това може да изисква продължителна експозиция при по-възрастни животни. Продължават проучванията, изследващи метаболизма на потомството в настоящия модел по-близо до времето на пубертета.
Въпреки че директното сравнение между mCTR и mHFD животни не разкрива различия нито преди, нито в края на HFD предизвикателството, имаше тънки разлики в секрецията на инсулин. Докато mHFD животните показват повишаване на инсулина на гладно по време на излагане на HFD в сравнение със собственото им изходно ниво, това не се наблюдава в групата mCTR. Трябва да се отбележи, че промяната в секрецията на инсулин в групата на mHFD е фина и че общите нива на инсулин на гладно и AUC на инсулин не се различават между mCTR и mHFD групите по време на HFDC. Въпреки че повишаването на инсулина е било малко, то се е случило след относително кратка 35-дневна продължителност на предизвикателството с HFD и показва, че потомството, изложено на HFD на майката, може да развие инсулинова резистентност по-бързо при по-продължително излагане на HFD. Настоящото проучване потвърждава клиничните находки за майчиното затлъстяване, увеличаващи честотата на детска инсулинова резистентност (5, 8) и илюстрира колко бързо могат да се развият промените в секрецията на инсулин при остро излагане на HFD.
ЗАКЛЮЧЕНИЕ
Настоящият доклад установява, че консумацията на HFD при майката води до леки промени в адаптивните реакции към експозицията на HFD по-късно в юношеството. Умереното увеличение на базалния инсулин показва, че консумацията на HFD при майката може да увеличи риска от диабет при консумация на HFD по-късно в живота. Бъдещите изследвания, използващи този модел, ще продължат да изследват основните механизми, чрез които майчината диета програмира метаболитна дисфункция.
ВЪПРОСИ ЗА ИЗСЛЕДВАНЕ НА ВАЖНОСТТА
Относително малко се знае за това как затлъстяването на майките променя способността на потомството да се адаптира към метаболитните предизвикателства при приматите.
Нашите открития показват, че консумацията на диета с високо съдържание на мазнини при майките не променя драстично способността на потомството да се адаптира метаболитно към острото ограничаване на калориите или поставянето им върху диета с високо съдържание на мазнини по-късно в живота.
Докато теглото и метаболитните параметри изглеждаха сходни в различните групи, животните с HFD при майката демонстрираха повишен прием на храна и по-голямо увеличение на инсулина на гладно в отговор на остър достъп до HFD, което показва, че те могат да бъдат по-податливи на диабетогенните ефекти на тази диета.
Допълнителен материал
Supp FigS1
Благодарности
Финансиране: NIH R01DK079194, R24DK090964, R01 MH107508R01 и P51 OD011092
Авторите биха искали да благодарят на д-р Кевин Гроув за подкрепата при разработването на този животински модел. Освен това благодарим на Лина Гао за биостатистическа помощ. И накрая, признаваме нашата финансова подкрепа NIH R01DK079194, R24DK090964, R01 MH107508R01 и P51 OD011092.
Бележки под линия
Принос на автора: CT анализира данните и пише ръкописа. TD и DT са участвали в експериментално планиране, изпълнение и анализ на данни. ES и PK са участвали в експериментално планиране, интерпретация на данните и са допринесли за значително обсъждане на данните.
Разкриване: Д-р True получава финансова подкрепа от NIH и работи по съвместен грант с Novo Nordisk. По време на проучването д-р Съливан съобщава за безвъзмездни средства от благотворителния фонд Мърдок, NIH и Фондация Бил и Мелинда Гейтс. Д-р Киевит получава финансова подкрепа от NIH, както и изследователска подкрепа от Novo Nordisk, Leidos Biomedical Inc и Janssen Pharmaceuticals.
- Имунологични и метаболитни ефекти на високо рафинирана диета, съдържаща въглехидрати при хранителни алергии
- Термично обработената диета с високо съдържание на мазнини модифицира чревната микробиота и метаболитните маркери при апое - мишки Хранене;
- Влияние на хранителните добавки, диетата върху метаболитното здраве, изследвано в прегледа Хранителни перспективи
- Как да получите фигура за пясъчен часовник (Съвети за трансформация от мъж към жена)
- Хашимото; s диетични ефекти на шоколада; BOOST Щитовидна жлеза Хашимото; s и приложението Hypothyroid