Резюме
Ролята на диетата за удължаване на продължителността на живота и здравето е обект на много изследвания и дебати. Нашите скорошни епидемиологични и in vivo данни показват, че качеството на въглехидратите може да бъде основен фактор за удължаване на здравето на очите. Освен това прекомерният прием на въглехидрати може да допринесе за обостряне на много различни заболявания. Метаболитното разнообразие на тъканите, засегнати от прекомерен прием на въглехидрати, предполага, че диетичното качество на въглехидратите може да повлияе на клетъчната хомеостаза.
1. Въведение и дефиниция на гликемичния индекс
1.1. Въведение
1.2. Определение на гликемичния индекс
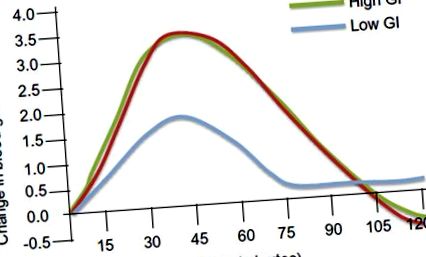
Промени в кръвната глюкоза след консумация на храни с висока и ниска гликемия. Промяната в глюкозата в кръвта в mmol/L се начертава спрямо времето в минути.
2. Гликемичен индекс, болест и протеопоаза
По време на тази работа протеостазата се нарича протеопоза, за да покаже, че съществува динамична, а не статична връзка между протеините, обидите и клетъчната машина, която трябва да разпознава и избирателно да премахва увредените протеини.
2.1. Риск от свързана с възрастта макулна дегенерация (AMD)
Работата в нашата лаборатория е фокусирана върху връзките между риска от свързани с възрастта очни заболявания, главно свързана с възрастта дегенерация на макулата (AMD) или катаракта и консумирането на диети с висок GI. AMD е водещата причина за необратима слепота при възрастните хора. Има два вида AMD: „мокро AMD“ е резултат от неоваскуларизация в хориоидеята на ретината, докато „сухо AMD“ е свързано с появата на друзи, които са бели или жълти отлагания на извънклетъчен материал, които се натрупват между мембраната на Bruch и ретинален пигментен епител (RPE). Сухото AMD е най-разпространеният вид, представляващ почти 90% от всички случаи на AMD. Въпреки че има няколко лечения, насочени към неоваскуларизацията при мокро AMD, понастоящем няма лечения за забавяне или обръщане на сухо AMD. И двата вида AMD водят до смърт на фоторецепторните клетки и загуба на зрение. Късният стадий на сухо AMD е свързан със загубата на големи площи на RPE и фоторецепторите, известни като географска атрофия.
Нашите епидемиологични данни показват, че консумацията на диети с висок GI е свързана с повишено разпространение и повишена прогресия на AMD (фиг. 2) (Chiu et al., 2006a, 2007a, 2007b); дори когато диетите съдържат същото количество общ въглехидрат. Хората с най-висок квинтил на прием на стомашно-чревния тракт имат повишени рискове от големи друзи, неоваскуларизация и географска атрофия в сравнение с най-ниския квинтил (Chiu et al., 2007a). Работа от други групи потвърждава, че диетите с висок ГИ увеличават риска от ВМД, включително меки друзи (Kaushik et al., 2008). Тези проучвания показват, че промените в диетата могат да намалят риска от развитие на ВМД и прогресия на заболяването. Рисковете от AMD, свързани с тютюнопушенето (Smith et al., 2001) и генетичните вариации (Fritsche et al., 2013), са в сходни граници с рисковете, свързани с консумацията на диети с висок GI (фиг. 2).
Риск от развитие на AMD. Коефициенти или съотношения на риск от развитие на ВМД поради консумация на диети с висок гликемичен индекс (първите 7 точки (Chiu et al., 2006a, 2007b; Kaushik et al., 2008)), тютюнопушенето (Smith et al., 2001) или варианти в ARMS2 или CFH гени (Fritsche et al., 2013). Централните точки (червени) са коефициенти или съотношения на риска, докато линиите показват горния и долния интервал на доверие. (За тълкуване на препратките към цвета в тази легенда на фигурата читателят е насочен към уеб версията на тази статия.)
Много други свързани с възрастта заболявания също се влошават от диети с висок GI: хората, консумиращи диети с висок GI, са изложени на повишен риск от диабет тип II, сърдечно-съдови заболявания, както и катаракта (Chiu et al., 2011). Тъй като катарактата е резултат от постсинтетични модификации на протеините на лещата, наречени кристалини, изглежда, че повишените нива на захари могат да участват и в катарактогенезата. Тези взаимоотношения са интригуващи, защото лещата е безсъдова, аноксична среда с вероятно най-бавния метаболизъм в тялото. Точно до него е ретината, най-кислородната и силно васкуларизирана тъкан в тялото. Метаболитното разнообразие на тъканите, които са неблагоприятно повлияни от високия прием на въглехидрати с GI, предполага, че връзката между диетичното качество на въглехидратите и клетъчната хомеостаза е от основно физиологично значение и, може би, че има обща етиологична връзка между диетичната гликемия и различните заболявания.
2.2. Натрупване на усъвършенствани крайни продукти за гликиране (AGEs)
AGE се натрупват по време на стареене и при консумация на диети с висок GI. (А) Човешки лещи са получени от трупове на млади (на възраст 22) или възрастни (на възраст 76 години) донори. Лещите се събират от млади (възрастови месеци) и стари (възрастови месеци) мишки. AGEs бяха открити с помощта на анти-MG-H1, както е описано (Uchiki et al., 2012). Последните доказателства сочат, че това антитяло всъщност разпознава изомера MG-H3 (Wang et al., 2015) и ние ги обозначихме като такива. Понсо, оцветяване с общ протеин (човешки проби) или експресия на GAPDH е използвано за количествено определяне. (Б) Проби от същите възрасти мишки: мозък, леща, ретина и черен дроб от мишки, хранени с диети с нисък или висок гликемичен индекс в продължение на 10 месеца.
Въпреки че фруктозата по дефиниция е захар с нисък ГИ, диетите с високо съдържание на фруктоза също са свързани с влошено здраве (Lim et al., 2010; Lustig, 2013). Един възможен механизъм може да бъде, че фруктозата е в състояние да образува AGEs с повишена скорост в сравнение с глюкозата (Bousova et al., 2011; Sadowska-Bartosz et al., 2014). По този начин токсичността на фруктозата може да се дължи на способността й да образува AGEs. Въпреки това, фруктозата in vivo не е по-гликираща от глюкозата в модела на дрожди (Semchyshyn et al., 2014) и скорошно проучване предполага, че фруктозата сама по себе си не е свързана с влошено здраве, което не може да се отдаде на увеличения общ прием на калории (Chung et ал., 2014). Поради това не е ясно дали гликиращата активност на фруктозата е по-вредна in vivo, отколкото глюкозата. Като се има предвид изобилието от фруктоза в нашите диети, връзката между консумацията на фруктоза и риска от AMD заслужава допълнително внимание.
2.3. In vitro анализ на протеопоаза и AGEs
Предполагаме, че увеличеното натрупване на AGE-модифицирани протеини води до дългосрочно нарушаване на клетъчната хомеостаза и намаляване на цялостното здраве. Адекватно идентифициране и отстраняване на увредените протеини е необходимо за поддържане на протеопозата. Няколко протеолитични пътища могат да изхвърлят нежеланите протеини, когато те са повредени или вече не са необходими.
Протеазомата е многосъединична протеаза, която разгражда разгънати или повредени протеини (Dudek et al., 2005; Marques et al., 2006; Shang et al., 2001; Zhang et al., 2007) и които трябва бързо да бъдат отстранени . Това включва много регулаторни протеини на клетъчния цикъл (Buschhorn and Peters, 2006; Peters, 2002; Yew, 2001). Протеазомата може да разгради протеини, които са широко разпространени. Пътят на убиквитин добавя малкия протеин убиквитин към субстрати чрез реле от три различни семейства ензими. Множеството убиквитинови ензими позволяват изключителна субстратна специфичност при насочване на разграждането (Pickart и Fushman, 2004). По този начин увредените протеини могат да бъдат идентифицирани и насочени към протеазомно разграждане чрез добавяне на частици убиквитин. Когато пътеката работи правилно, субстратът може да достигне много висока маса, тъй като става мултивиквитиниран. Ако тези широкомащабни субстрати с висока маса не се разграждат, те могат да се агрегират и да станат неразтворими. Преди разграждането убиквитинът се отстранява и рециклира, докато субстратът преминава към разграждане до пептиди.
Лизозомата разгражда протеини, които идват от извънклетъчната среда чрез ендоцитоза, както и вътреклетъчните протеини, които се доставят чрез автофагия. Първоначално автофагията е идентифицирана като път, който може да рециклира насипни клетъчни протеини в условия на лишаване от хранителни вещества (Cuervo and Dice, 1998; Mortimore et al., 1988). Автофагията може също да разгради цели органели и да прояви специфичност на субстрата (Tolkovsky, 2009; Wong et al., 2012). Както протеазомните, така и автофагичните/лизозомни протеолитични способности намаляват по време на стареенето (Cuervo and Dice, 2000; Pereira et al., 2003), като по този начин потенциално допринасят за натрупването на увредени протеини.
Лечението с MGO води до натрупване на AGE и намалено разграждане на протеини. (А) RPE клетките се третират с 1 mM MGO в продължение на 2 часа. След това MGO се отстранява и клетките се инкубират в присъствието или отсъствието на инхибитори за посочените времена. AGEs бяха открити чрез анти-MG-H3 (Wang et al., 2015). (B) RPE клетките са белязани с 3 H-Tyr в продължение на 60 часа и след това клетките са третирани с MGO в продължение на 2 часа. След отстраняване на MGO, скоростта на белтъчния оборот се определя чрез изследване на TCA разтворимата радиоактивност във времето.
Също така тествахме дали инхибиторите на лизозомния и автофагичния път влияят върху клирънса на AGEs. Хлорохинът, който повишава интрализозомното рН, като по този начин инхибира лизозомните протеази, намалява клирънса на AGE (сравнете пътеките 3-5 и 7-9). Тези резултати предполагат, че лизозомата участва в изчистването на AGE-модифицирани субстрати. Обърнете внимание, че също така наблюдаваме убиквитиниран и AGE-модифициран протеин с много голяма маса, натрупващ се при третиране с хлорохин (път 5), което предполага, че някои убиквитинирани AGE-модифицирани протеини могат да бъдат разградени чрез лизозомата. Тези данни се съгласуват с най-новата литература, показваща, че лизозомните и протеазомните пътища си сътрудничат за разграждане на увредените протеини (Park and Cuervo, 2013). Допълнителни данни показват, че докато гликираните протеини пристигат в лизозомата, те изглежда се натрупват във вътрешната мембрана, вместо да достигнат до протеолитичния механизъм в лизозомата (Uchiki et al., 2012). Като такива, те могат да влошат нарушаването на протеопозата чрез намаляване на протеолитичния капацитет. Тези наблюдения бяха потвърдени, когато изследвахме общия протеолитичен оборот в RPE клетки, третирани с MGO; Лечението с MGO намалява протеолитичния оборот над 50% (фиг. 4Б). Тези данни предполагат, че дългосрочната хипергликемия води до намалена протеолиза.
За да определим конкретно дали автофагичният път участва в изчистването на AGE, използвахме инхибитора на автофагията 3-метил аденин (3MA). Третирането с 3MA също намалява клирънса на AGE-модифицирани протеини (сравнете линиите 3–6 и 7–10). Колективно нашите резултати показват, че както протеазомните, така и автофагичните протеолитични пътища се използват за изчистване на AGE модифицирани протеини.
3. Модел и заключения
Модел на AGE натрупване и протеопоаза. Консумацията на диета с висок GI причинява засилено окисление и индуцирано от гликиране увреждане на протеините. Когато нивата на увредените протеини са ниски, убиквитинът и лизозомната/автофагичната протеолитична система могат да разграждат увредените протеини и токсичността се предотвратява (отгоре). При хроничен гликативен стрес се натрупват гликирани протеини. Те могат да включват AGEs заедно с немодифицирани протеини, някои включително конюгати на убиквитин (кутия). Някои могат да олигомеризират и омрежат, образувайки агрегатите с по-висока маса. Конюгатите, които не са влошени, също могат да се натрупват, ако има недостатъчна протеазомна, включително деубиквитинираща активност. Натрупаните олигомеризирани променени протеини могат да увредят протеолитичния механизъм, създавайки порочен цикъл на стрес, ограничено протеолитично редактиране и допълнителни увреждания на протеома, което води до някои от свързаните със заболяването натрупвания на AGE и конюгати, наблюдавани in vivo
Благодарности
Този материал се основава на работа, подкрепена от Министерството на земеделието на САЩ - Служба за земеделски изследвания (ARS), съгласно Споразумение № 58-1950-4-003. Допълнително финансиране от Националния очен институт към AT EY-13250, EY-21212. Също така благодарим на д-р Шелдън Роуън за работата по Фигура 2 .
Биографии
Елизабет А. Уиткомб д-р е учен в Центъра за изследване на човешкото хранене по въпросите на стареенето в университета Туфтс. Нейната работа се фокусира върху ролята на пътеката на убиквитина при контролирането на съдбата на субстратите, участващи в клетъчното делене, миграция и диференциация.
- DIET @ NET Насоки за най-добри практики за оценка на диетата при здравни изследвания
- Диетични мазнини и вашето здраве HealthLinkBC File 68f
- Диетични аспекти, свързани със здравето и затлъстяването при синдром на Уилямс, синдром на Даун и Прадер – Уили
- Диетични насоки за здравните въпроси на американците
- Gale OneFile Здраве и медицина - Документ - Диетично ограничаване на медта при болестта на Уилсън