Резюме
Заден план
Затлъстяването е рисков фактор за рак на гърдата при жени в менопауза и е свързано с намалена преживяемост и по-неблагоприятни клинични характеристики като по-голяма туморна тежест, по-висока степен и лоша прогноза, независимо от менопаузалния статус. Въпреки отрицателното въздействие на затлъстяването върху клиничния резултат, молекулярните механизми, чрез които излишното затлъстяване влияе върху етиологията на рака на гърдата, не са добре дефинирани.
Методи
Данните за експресия на гена Affymetrix U133 2.0 са генерирани за 405 първични тумори на гърдата, като се използва РНК, изолирана от лазерни микродисектирани тъкани. Пациентите са класифицирани като нормално тегло (ИТМ
Заден план
Данните от Центровете за контрол и превенция на заболяванията показват, че 68% от възрастните в Съединените щати (САЩ) са с наднормено тегло (25 ≤ BMI 2) или със затлъстяване (BMI ≥ 30 kg/m 2) [1]. Затлъстяването е свързано със значително по-висока смъртност от всички причини в общата популация [2] и е свързано с диабет тип 2, сърдечно-съдови заболявания, астма, остеоартрит и много видове рак [3]. Ако затлъстяването продължи да ескалира при сегашните темпове, общите разходи за здравеопазване, свързани с грижите, свързани със затлъстяването, могат да достигнат> 860 милиарда долара до 2030 г. и да представляват 18% от общите разходи за здравеопазване в САЩ [4].
Затлъстяването и наддаването на тегло между 20 и 50 години са значими рискови фактори за рак на гърдата [5] при жени в менопауза [6, 7], особено тези, които не използват хормонозаместителна терапия (ХЗТ) [8]. Въпреки че връзката между индекса на телесна маса (ИТМ) и подтипа на рака на гърдата е неясна [9–15], затлъстяването е свързано с по-неблагоприятни патологични характеристики, включително напреднал стадий, по-голям размер на тумора и метастатично засягане на лимфните възли [16–19]. В допълнение, мета-анализите са открили значителни връзки между затлъстяването и общата преживяемост и специфичната преживяемост при рак на гърдата [20, 21].
Като се има предвид нарастващата епидемия от затлъстяване в Съединените щати и по целия свят, е изключително важно да се разбере как затлъстяването влияе върху етиологията на рака на гърдата. Лошата прогноза може да се дължи на съпътстващи заболявания, неадекватно дозиране с химиотерапевтични средства или биологични ефекти от излишното затлъстяване, включително повишени нива на естроген, хиперинсулинемия или хронично възпаление [22, 23]. За да се разберат по-добре връзките между молекулния пейзаж на туморните епителни клетки и затлъстяването, данните за генната експресия бяха генерирани от 405 микродисектирани карцинома на гърдата и анализирани от ИТМ по време на диагностицирането.
Методи
Етика, съгласие и разрешения
Всички пациенти, включени в Проекта за клинична грижа за гърдата, отговарят на следните критерии за допустимост: 1) възрастен на възраст над 18 години, 2) психически компетентен и готов да предостави информирано съгласие и 3) представяне в центровете за гърди с доказателства за заболяване на гърдата. Проби от тъкани и кръв бяха събрани с одобрението на Комитета за човешка употреба на Националния военномедицински център „Уолтър Рийд“ и Институционалния съвет за преглед. Всички субекти доброволно се съгласиха да участват и дадоха писмено информирано съгласие.
Събиране и характеризиране на проби
Тъкани са събрани от пациенти, подложени на хирургични процедури, включително лумпектомия или мастектомия. В рамките на 5–15 минути след хирургично отстраняване тъканите на гърдата бяха отнесени върху натрошен, мокър лед в патологичната лаборатория, където лицензиран патолог или асистент на патолози извършват рутинни патологични анализи. Диагнозата на всеки образец е проведена от патолог на гърдата. Етапът и степента бяха определени с помощта на насоки, определени от AJCC Ръководство за постановка на рак седмо издание [24] и Nottingham Histologic Score [25, 26], съответно. Вътрешният подтип е определен с помощта на BreastPRS, както е описано по-горе [27].
Изолиране на РНК, амплификация, маркиране на аРНК и хибридизация
За всеки случай патологът на гърдата идентифицира туморни зони за лазерна микродисекция от H&E оцветени стъкла. Нарязани са две до пет серийни секции (с дебелина 8 μm), монтирани на стъклени стъклени PEN фолиа (Leica Microsystems, Wetzlar, Германия), оцветени с помощта на комплекта за оцветяване LCM (Applied Biosystems, Foster City, CA) и лазерна микродисекция върху ASLMD система за лазерна микродисекция (Leica Microsystems, Wetzlar, Германия). Подготовката на слайдовете, оцветяването и нарязването бяха извършени в рамките на 15 минути, за да се запази целостта на РНК. След това РНК се изолира с помощта на RNAqueous-Micro kit (Applied Biosystems, Foster City, CA) и се третира с DNase I за отстраняване на всякакви замърсяващи геномна ДНК. Целостта на РНК е оценена с помощта на 2100 Bioanalyzer (Agilent Technologies, Санта Клара, Калифорния), превърната в белязана с биотин aRNA, като се използват два кръга на усилване с MessageAmpII aRNA Amplification kit (Applied Biosystems, Foster City, CA), както и концентрацията и качеството от пробите бяха измерени с NanoDrop 1000 (NanoDrop Products, Wilmington, DE) и 2100 Bioanalyzer. Хибридизация с контролирани от производителя контроли за хибридизация, измиване, оцветяване и сканиране на масиви HG U133A 2.0 (Affymetrix, Санта Клара, Калифорния) бяха проведени съгласно протоколите на производителя [28].
Анализ и статистика
За статистически анализи BMI не се третира като непрекъсната променлива; по-скоро пациентите са класифицирани като нормално тегло (ИТМ
Резултати
Характеристики на пациента
Всички пациенти са диагностицирани с инвазивен рак на гърдата между 2001 и 2011 г. Затлъстелите жени са били значително по-възрастни при диагностицирането (P = 0,009) и са били значително по-склонни да бъдат афроамериканци (P = 0,012) от жените с нормално тегло. Жените с наднормено тегло не се различават значително по възраст при диагностициране или по произход от жени с нормално тегло или затлъстяване. Нито една патологична характеристика или резултатите от пациентите не се различават значително по ИТМ (Таблица 1).
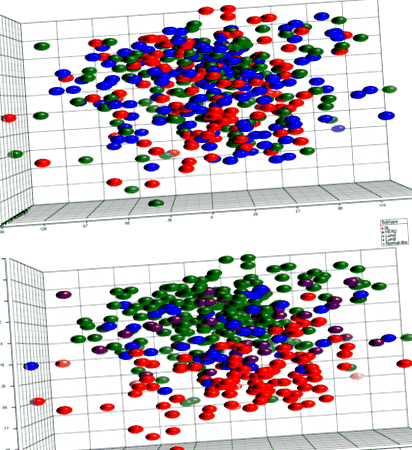
PCA не ефективно групира проби от BMI (фиг. 1). Не са открити диференциално експресирани гени между групите на ИТМ в първоначалния анализ, който включва всички туморни подтипове или при сравняване на затлъстели с не-затлъстели пациенти. Докато PCA не е ефективно дискриминирал туморите чрез ИТМ, туморите са се групирали по вътрешен подтип. По този начин, за да се определи дали включването на хетерогенна група тумори прикрива значителни различия в генната експресия, бяха проведени анализи в рамките на присъщи подтипове. Не са открити разлики за луминал В (н = 43), обогатен с HER2 (н = 48) или базално (н = 99) тумори; обаче, 44 сонди от 42 гена бяха диференцирано изразени чрез категория ИТМ (Таблица 2; Фиг. 2) в рамките на луминалния А подтип (н = 209). Тези диференцирано експресирани гени са свързани с редица пътища, участващи в туморогенезата, като контрол на клетъчния цикъл, mTOR и p53 сигнализиране и възстановяване на ДНК (Таблица 3).
PCA на генна експресия от 405 първични туморни проби. Графиката отгоре е оцветена от BMI групи без очевидни клъстери. Графиката вляво е оцветена по подтип и показва групиране на пробите по подтип
Кутия и мустаци начертават диференциална генна експресия при тумори от жени с нормално тегло и затлъстяване. Най-високите разлики в пъти са открити за APOD и OGN с 2,36- и 2,05 пъти по-висока експресия при тумори от затлъстяване в сравнение с жени с нормално тегло; MELK демонстрира най-голямо увеличение (1,71 пъти) на експресията при нормално в сравнение със затлъстелите жени
Дискусия
Световните нива на затлъстяване се увеличават с тревожна скорост [29], а в Съединените щати> 50% от възрастните се очаква да бъдат затлъстели до 2030 г. [4]. Предвид лошата прогноза на затлъстелите жени с рак на гърдата, по-доброто разбиране за това как затлъстяването влияе върху оцеляването е от решаващо значение. Идентифицирането на молекулярни профили при инвазивни карциноми на гърдата, които корелират със затлъстяването, би позволило разработването на целенасочена терапия или стратегии за намаляване на риска, които биха могли да подобрят резултатите при затлъстелите жени. В това проучване открихме 42 уникални гена, които са диференцирано експресирани в луминални тумори на гърдата от нормално тегло в сравнение с жени със затлъстяване. Туморите от пациенти с наднормено тегло не се различават значително от тези при жени с нормално тегло или затлъстяване.
Доколкото ни е известно, това е първото проучване за идентифициране на транскриптомни промени, свързани със затлъстяването в епителните клетки на луминални А тумори. Kwan et al. оценява ефектите на ИТМ в набор от 1676 тумори в ранен стадий, при които е присвоен вътрешен подтип с помощта на PAM50 qRT-PCR анализ [11] и установява, че високото затлъстяване (ИТМ ≥ 35) е свързано с намалена експресия на ESR1 и повишена експресия на гени за пролиферация. От 10 гена за пролиферация, изследвани от Kwan et al., Четири (CENPF, CEP55, MK167 и KIF2C) също са изразени при значително по-високи нива в тумори от затлъстяване в сравнение с пациенти с нормално тегло в нашето проучване.
Fuentes-Mattei et al. извърши анализ на транскриптом на базата на микрочипове при ER + тумори и идентифицира 112 гена, диференцирано експресирани между пациенти със затлъстяване и затлъстяване. Анализът за обогатяване на гени открива значителни промени в AKT-мишени и епителни-мезенхимни пътища на преход. Активирането на пътя на AKT/mTOR също е открито при тумори от затлъстели мишки [30]. Въпреки че нито един от диференциално експресираните гени от нашето проучване също не е участвал в изследването от Fuentes-Mattei et al., Анализът на обогатяване на пътя на нашите диференциално експресирани гени също разкрива промени в mTOR сигналния път.
По-рано се съобщава за транскриптомен подпис на затлъстяването, обхващащ 662 диференциално експресирани гена въз основа на проби от туморни биопсии от 103 пациенти с локално напреднал рак на гърдата, включени в неоадювантни проучвания, независимо от ER състоянието [31]. Анализът за обогатяване на генни анотации открива експресивна сигнатура, свръхпредставена от гени, участващи в регулирането на транскрипцията и ядрото, която е свързана с по-кратко време до метастази в два публични набора от данни; обаче не е открита корелация в четири други бази данни. Трябва да се отбележи, че значително по-висок дял от афро-американците са били със затлъстяване в сравнение с нормално или с наднормено тегло и известен брой диференциално изразени сонди в техния набор от данни, включително 205048_s_at (PSPHL), 206777_s_at (CRYBB2P1) и 212777_at (SOS1), са известни като диференцирани изразена в различни видове тъкани между афроамериканци и европейци [32–39]. Включването на тумори в късен стадий, които не са стратифицирани по подтип или ER статус, в комбинация с объркващи резултати от генната експресия, приписвани на генетичния произход, може да е повлияло на способността за откриване на транскриптомни промени, свързани с ИТМ.
Критична разлика между нашите данни и други доклади е използването на лазерна микродисекция за изолиране на туморни клетки, докато пробите от другите изследвания са съставени от 15–30% стромални клетки. Мастната тъкан на гърдата служи като гориво за растежа на тумора, набира макрофаги и стимулира възпалителна реакция [40]. Данни от нашата лаборатория показват, че съседният на тумори мастен има променен възпалителен отговор и повишена имунотолерантност [41], а последните данни показват, че съвместното култивиране на ER + клетки на рак на гърдата с мастна строма/стволови клетки от затлъстели жени засилва пролиферацията на раковите клетки на гърдата и тези клетки на рак на гърдата демонстрираха засилен епително-мезенхимен преход и експресия на гени за метастази [42]. По този начин, докато лазерната микродисекция на туморни клетки може да е осигурила молекулярен портрет на генната експресия в туморния епител, проучвания, които позволяват значителна част от стромалните клетки, включително мастните, може да са открили промени, свързани с излишното затлъстяване, които присъстват в тумора микросреда.
Заключение
Излишното затлъстяване не засяга еднакво всички тумори на гърдата; по-скоро диференциалната генна експресия чрез ИТМ е ограничена до луминални А тумори. Промените в пътищата, свързани с контрола на клетъчния цикъл, mTOR и p53 сигнализирането и метаболизма на мастните киселини, могат да обяснят по-неблагоприятните резултати, свързани със затлъстяването. В допълнение, откриването на промени в тези пътища позволява използването на агенти като mTOR инхибитори за по-ефективно лечение на затлъстели жени с луминални А тумори и намаляване на разликите в резултатите.
- Експресия на витамин D-метаболизиращи ензими в човешката мастна тъкан - ефектът на затлъстяването и
- Ефект на изкуствените подсладители върху риска от затлъстяване при деца - клиничен съветник
- Chopra, Tanzi споделят как да променят нервните пътища и дори самата експресия на гени в нова книга
- Детското затлъстяване като предиктор за заболеваемост в зряла възраст систематичен преглед и метаанализ -
- Ефект на диетите с различни енергийни концентрации върху ефективността на растежа, характеристиките на трупа