Рафик А. Шахид
1 Катедра по медицина, Медицински център на университета Дюк, Дърам, NC 27710, САЩ
Дейвид К.-Х. Уанг
5 Катедра по вътрешни болести, Отдел по гастроентерология и хепатология, Медицински факултет на Университета Сейнт Луис, Сейнт Луис, MO 63104, САЩ
Брайън Е. Такса
1 Катедра по медицина, Медицински център на университета Дюк, Дърам, NC 27710, САЩ
Шанън Дж. Маккол
2 Катедра по патология, Медицински център на университета Дюк, Дърам, NC 27710, САЩ
Джоел М.-Ж. Romac
1 Катедра по медицина, Медицински център на университета Дюк, Дърам, NC 27710, САЩ
Стивън Р. Виня
1 Катедра по медицина, Медицински център на университета Дюк, Дърам, NC 27710, САЩ
3 Катедра по клетъчна биология, Медицински център на университета Дюк, Дърам, NC 27710, САЩ
Роджър А. Лидъл
1 Катедра по медицина, Медицински център на университета Дюк, Дърам, NC 27710, САЩ
4 Durham VA Medical Center, Durham, NC 27710, САЩ
Резюме
Заден план
Редовното свиване на жлъчния мехур намалява застоя на жлъчката и предотвратява образуването на камъни в жлъчката. Интрадуоденалното приложение на екзогенен инхибитор на секреторния трипсин на панкреаса (PSTI-I, известен също като мониторен пептид) причинява секреция на холецистокинин (CCK).
Дизайн
Предложихме стимулацията на освобождаване на CCK от PSTI да доведе до свиване на жлъчния мехур и да предотврати появата на камъни в жлъчката при мишки, хранени с литогенна диета. Следователно тествахме ефекта на свръхекспресията на PSTI-I на плъх в ацинарни клетки на панкреаса върху плазмените нива на CCK и функцията на жлъчния мехур в трансгенна миша линия (TgN [Psti1]; известна по-нататък като PSTI-I tg).
Резултати
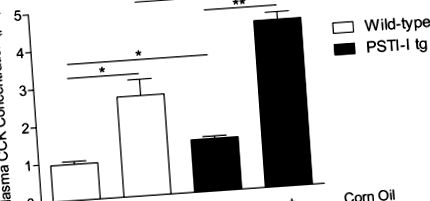
Важно е, че PSTI tg мишките са имали повишени нива на гладно и хранени плазмени CCK в сравнение с мишки от див тип (WT). Само мишки, хранени с литогенна диета, развиват камъни в жлъчката. Както нивата на CCK на гладно, така и стимулираните плазми са значително намалени както при WT, така и при PSTI-I tg мишки на литогенна диета. Освен това, въпреки по-високите нива на CCK, животните от PSTI-I развиват повече камъни в жлъчката, отколкото животните от WT.
Заключения
Заедно с наблюдаваното по-рано намаляване на изпразването на жлъчния мехур, стимулирано от CCK, при мишки, хранени с литогенна диета, нашите открития показват, че литогенната диета причинява образуване на жлъчен камък чрез нарушена секреция на CCK в допълнение към намалената чувствителност на жлъчния мехур към CCK.
Въведение
Добре установено е, че хормонът на тънките черва холецистокинин (CCK) е основният стимулант на свиването на жлъчния мехур след ядене на храна [1]. Контролът на секрецията на CCK е комплексен, включващ множество интралуминални фактори, включително протеини, мазнини и секреторен трипсинов инхибитор-I на панкреаса (PSTI-1, известен също като мониторен пептид) [2]. PSTI-I е 61-аминокиселинен, чувствителен към трипсин пептид, пречистен от панкреатичен сок от плъх [3, 4]. Той стимулира отделянето на CCK в червата, което води до повишена секреция на панкреатичен ензим в отговор на диетичния протеин и може да бъде частично отговорен за регулирането на физиологичната обратна връзка на секрецията на панкреатичния ензим [5]. PSTI-I също инхибира интрапанкреатичната трипсинова активност. Показано е, че активността на инхибиране на трипсина е ефективна за намаляване на възпалението на панкреаса при животински модели както на остър [6], така и на хроничен [7] панкреатит, когато PSTI-I е свръхекспресиран в панкреаса на трансгенна миша линия. Не е известно обаче дали трансгенната свръхекспресия на PSTI-I влияе върху плазмените нива на CCK на гладно или хранене или дали повишените плазмени концентрации на CCK влияят върху функцията на жлъчния мехур или образуването на камъни в жлъчката.
Разработихме трансгенна миша линия, при която генът на секреторния трипсин I на панкреаса на плъх (PSTI-I) е свръхекспресиран в ацинарни клетки на панкреаса на мишки [6, 20, 21]. Наред с други действия, PSTI-I стимулира секрецията на CCK от I клетки в лигавичния епител на тънките черва и повишените плазмени концентрации на CCK от своя страна причиняват свиване на жлъчния мехур. Поради това предположихме, че трансгенните мишки PSTI-I ще покажат повишени плазмени нива на CCK, което води до непрекъснато стимулиране на свиването на жлъчния мехур, и преценихме дали тези реакции ще предпазят мишките от образуването на камъни в жлъчката, когато се хранят с литогенна диета. Открихме, че експресията на PSTI-I при трансгенни мишки наистина е довела до хронично повишаване на CCK. Това издигане обаче не попречи на образуването на камъни в жлъчката. Също така забелязахме, че литогенната диета инхибира секрецията на CCK, като по този начин намалява свиването на жлъчния мехур и следователно допринася за образуването на камъни в жлъчката.
Методи
В тези проучвания са използвани два щама мишки. Мишки от див тип и C57BL/6J са закупени от лабораторията Jackson (Bar Harbor, Мейн, САЩ). Трансгенни мишки на генетичния фон C57BL/6J и експресиращи секреторния трипсинов инхибитор I на панкреатичен панкреатичен ген в панкреатични ацинарни клетки (TgN [Psti1]; PSTI-I tg) са генерирани в нашата лаборатория, както е описано по-горе [6]. Трансгенът се състои от химерна конструкция на миши еластазен I усилвател/промотор, клониран нагоре по веригата на минигена от 4,6 kb от плъх PSTI-I и иРНК на плъх PSTI-I и протеин се експресират изключително в панкреаса. Мишките бяха настанени в контролирани от климата стаи с 12:12-часов цикъл светлина-тъмнина и разрешени вода и чау ad libitum. Всички експерименти с животни са извършени с одобрението на институционалния комитет за грижа и употреба на животните от университета Дюк.
На възраст от 6 седмици мъжки мишки от див тип и PSTI-I tg бяха поставени на една от двете диетични диалити: (1) нормална мишка чау (Purina) или (2) литогенна диета, състояща се от 1% холестерол и 0,5 % натриев таурохолат (Harlan-Teklad миша диета # 5015 CB, Indianapolis, IN). В края на осем седмици непрекъсната диета животните бяха евтаназирани за събиране на кръв и тъкани.
Анализ на плазмен CCK
Концентрациите на CCK в плазмата са измерени чрез специфичен биоанализ, както е описано [22]. Този анализ се основава на способността на CCK да стимулира освобождаването на амилаза от изолирани ацини на панкреаса на плъх. Накратко, плазмата се екстрахира и концентрира чрез адсорбция върху октадецилсилилсиликатни патрони С-18 (Waters Associates, Millipore Corp., Milford, MA). За да се получи адекватна чувствителност, плазмата се обединява от 3 мишки [23].
Хистопатология на жлъчния мехур
Жлъчните мехури бяха фиксирани в 10% формалин, вградени в парафин, а срезовете бяха изрязани на 5 μm и монтирани върху стъклени пързалки. Хроничният холецистит е класифициран от патолог (заслепен от обозначението на групата) чрез оценка на хроничното възпаление в собствената ламина, наличие на синусите на Rokitansky-Aschoff и степента на удебеляване на muscularis externa. Други възпалителни промени, включително брой неутрофили в епитела, брой неутрофили и еозинофили в ламина проприа, реактивни епителни промени като еозинофилни цитоплазмени включвания, папиларна лигавична архитектура и липса на възпалителни клетки спрямо папиларен оток; всяка категория е отбелязана с 0, 1 или 2 (максимално възможният резултат = 16).
Обем на жлъчния мехур
Обемът на жлъчния мехур е измерен, както е описано по-рано [10, 24]. Накратко, мишките на гладно през нощта със свободен достъп до питейна вода се анестезират, лапаротомия се извършва при стерилни условия, жлъчният мехур се излага и неговият размер се измерва с помощта на микрокалипер. Обемите на жлъчния мехур се изчисляват, като се използва следната формула, като се приема елипсоидна форма (която се оказа точна при липса на големи разлики във формата на жлъчния мехур) [24]:
За да се определи изпразването на жлъчния мехур и концентрациите на CCK в плазмата в отговор на интрадуоденалната мастна тъкан, PE-10 полиетиленов катетър е вкаран в дванадесетопръстника по време на лапаротомия. Дуоденалният катетър се екстернализира през лявата коремна стена и се свързва с инфузионна помпа. След операцията размерът на жлъчния мехур се измерва с микрокалипер и обемът на жлъчния мехур се изчислява, използвайки формулата по-горе. След това мишките се инфузират интрадуоденално с царевично масло при 40 μl/min в продължение на 5 минути. Контролите се вливат идентично с 0.9% NaCl. След 30 минути обемът на жлъчния мехур се измерва отново както преди и се събира смесена артериовенозна кръв за анализ на CCK в плазмата. Тридесетминутният интервал е избран, тъй като е доказано, че това отговаря на пиковите плазмени нива на CCK и свиването на жлъчния мехур в предишни проучвания при хора [1, 25] и плъхове [26] и е подходящо при мишки [27]. Изпразването на жлъчния мехур се определя като разлика в обема на жлъчния мехур преди и след инфузиите на дванадесетопръстника.
Микроскопски изследвания на жлъчка и камъни в жлъчния мехур
След гладуване през нощта, холецистектомия се извършва при PSTI-I трансгенни и диви мишки (N = 18-20 на група) на 8 седмици на литогенна или чау диета. Жлъчката на жлъчния мехур беше изследвана чрез поляризираща светлинна микроскопия за муцинов гел, течни кристали, кристали на безводен холестерол, кристали като холестерол монохидрат, пясъчни камъни и истински камъни в жлъчката, всички от които бяха определени съгласно предварително установени критерии [28].
Липиден анализ
Билиарният холестерол, общите и отделните жлъчни соли и фосфолипидите се определят, както е описано по-горе [29]. Стойностите на индекса на насищане с холестерол (CSI) на обединената жлъчка на жлъчния мехур бяха изчислени от критичните таблици [30]. Относителните липидни състави на обединени жлъчни проби от жлъчния мехур са нанесени на триъгълна фазова диаграма според общите им липидни концентрации. Фазовите граници и пътищата на кристализация бяха екстраполирани от моделни жлъчни системи на базата на натриев таурохолат при 37 ° C [31]. Индексите на хидрофобността на жлъчния мехур бяха изчислени по метода на Хюман [32].
Статистически анализ
Сравнение на плазмените концентрации на CCK на гладно и на липиди (царевично масло) при мишки от див тип (отворени решетки) и при PSTI-I tg мишки (напълнени барове), хранени с нормална диета (N = 3 пула от по 3 мишки всеки). Свръхекспресията на PSTI-I значително повишава концентрациите на CCK на гладно и на липиди. (* P Фиг. 2А). И при двата щама на мишки литогенната диета причинява значителни хистопатологични промени, включително увеличаване на възпалителните клетки, удебелени мускулни стени, реактивни епителни промени и променена лигавична папиларна архитектура. Няма обаче съществена разлика между мишки от див тип и PSTI-I tg, хранени с литогенна диета, когато резултатите от хистопатологията бяха изчислени (Фиг. 2Б).
- Предотвратява ли кърменето Celiac без глутен живот
- Повдига ли се плазменият еритропоетин след излагане на голяма надморска височина, повлиява ли FGF23 при здрави
- Допълнителният калций не предотвратява увеличаването на теглото при пациенти с наднормено тегло 2009-09-01 AHC Media
- Земята вдига плазмен щит за борба със слънчевите бури New Scientist
- Готвачът на знаменитост Маги Биър за това как да се храните, за да предотвратите деменция Express Digest