Резюме
Бъбречната хипоплазия, дефинирана като необичайно малки бъбреци с нормална морфология и намален нефронов брой, е честа причина за педиатрична бъбречна недостатъчност и заболяване при възрастни. Генетичните проучвания, проведени при хора и мутантни мишки, са включили редица критични гени, вътреутробно фактори на околната среда и молекулярни механизми, които регулират дарението на нефрона и размера на бъбреците. Тук ние правим преглед на съвременните знания относно генетичния принос за бъбречната хипоплазия с особен акцент върху механизмите, които контролират нефроновата дарба при хора и мишки.
ПРЕГЛЕД НА РАЗВИТИЕТО НА БЪБРЕЦИТЕ
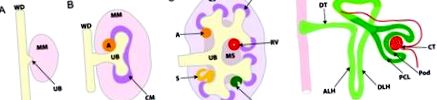
Морфогенеза на метанефричния бъбрек. A, Метанефричното развитие на бъбреците започва с индуцирано от метанефричен мезенхим (MM) образуване на уретерална пъпка (UB) от каудалния аспект на Wolffian duct (WD). Б., UB нараства към и нахлува в MM и реципрочните индуктивни взаимодействия между двете водят до повторно разклоняване на UB, в крайна сметка образувайки зрялата система за събиране на бъбреците. ° С, Едновременно с това UB връхчетата сигнализират на съседните ММ клетки да се кондензират (CM) и да претърпят мезенхимно-епителна трансформация, образувайки съвкупността (A), бъбречната везикула (RV), тялото с форма на запетая (C) и S-образното тяло (S). д, S-образното тяло се подлага на допълнителна диференциация, за да образува функционалния нефрон. Възходящ цикъл на Henle (ALH), кортикална строма (CS), капилярна туфа (CT), дистална верига на Henle (DLH), дистални тубули (DT), медуларна строма (MS), париетален клетъчен слой (PCL), клетъчен слой на подоцитите (Pod), проксимален канал (PT).
Получена е голяма част от представата за генетиката на човешката бъбречна хипоплазия чрез проучвания за редки синдромни състояния (Таблица 1). Тези важни генетични асоциации, идентифицирани в човешката бъбречна хипоплазия, са предоставили платформа за много изследователи да изследват молекулярните механизми, чрез които тези гени функционират както при нормално, така и при необичайно бъбречно развитие. Животински моделни системи (предимно миши) са предоставили значително разбиране за молекулярните механизми, лежащи в основата на развитието на бъбречната хипоплазия. На свой ред много от същите тези механизми са потвърдени в човешкото състояние. Тук обсъждаме най-важните генерирани констатации и сегашното ни разбиране за това как тези гени взаимодействат помежду си и в рамките на различни клетъчни линии.
ПРИНОС НА УРЕТЕРИЧНАТА КЛЕТОВА ЛИНИЯ ЗА РЕНАЛНА ХИПОПЛАЗИЯ
Образуването на нефрон в ММ изисква реципрочно взаимодействие с върховете на UB. Правилното разработване на UB дървото и секрецията на получени от върха сигнали са от съществено значение за адекватната нефрогенеза. В рамките на UB са необходими множество процеси за развитие: индукция, растеж и разклоняване, оцеляване и диференциация. Тези процеси се регулират основно от сигналните пътища на рецепторната тирозин киназа и транскрипционните фактори, изразени в UB (Таблица 2).
Растеж и разклоняване.
Поддръжка на Gdnf и Връщане изразът се контролира от авторегулираща обратна връзка с Wnt11. Секрецията на WNT11 от върха на UB е отговорна за поддържането на експресията на GDNF в MM. Wnt11 -/- мишките развиват дефектно разклонение на UB и не поддържат Gdnf израз в ММ (15). Новородените мутантни мишки се характеризират с 64% намаляване на гломерулния брой. Синергични генетични взаимодействия между Връщане и Wnt11 са демонстрирани от по-тежък хипопластичен фенотип през Wnt11 +/ - ; Ret +/ - мишки, както и загубата на Wnt11 в малкото Връщане -/- мишки, които развиват хипопластична бъбречна тъкан (15).
Сигнализиране от две допълнителни RTK, Срещнах се и Egfr, също така е доказано, че си сътрудничат при регулирането на късното разклоняване на UB. Срещнах се се изразява както в UB, така и в MM и е рецептор за Hgf. Целево изтриване на Срещнах се до уретеричната клетъчна линия води до 35% намаляване на броя на нефроните до 12 седмици на възраст (19). The Egfr е показано, че е регулирано нагоре в събирателните канали на тези мишки. Премахване на Egfr на Срещнах се дефицитът на фона причинява по-тежък дефицит в уретерното разклоняване, което предполага, че тези два RTK пътя действат съвместно в насочването на късното разклоняване на уретерите (19). Egfr нулевите мутанти сами по себе си също се срещат с бъбречна хипоплазия, характеризираща се с атрофия на бъбречната папила и намалено разклоняване на уретера (20). Интересното е, че условното инактивиране на Egfr в линията на UB води до нормално разклоняване на уретерите, но значително намаляване на удължаването на събирателния канал (20).
Разклоняването и растежът на уретерите също се регулира на ниво транскрипция. Транскрипционният фактор Lim1 е от съществено значение в UB за растеж и разклоняване, както и Връщане израз в домейна на върха. Целево изтриване на Lim1 в рода на UB също демонстрира изискване за Lim1 във времето на индукция на UB и поддръжка на нефричния канал (21). Анализ на химерни ембриони, състоящи се от комбинация от див тип и Lim1 -/- клетките демонстрираха клетъчно автономно изискване за Lim1 в нефричния канал и домейна на върха на UB.
Преживяемост на уретеричните клетки.
Индукция на нефрогенезата.
Наскоро транскрипционният фактор Hnf1β беше демонстрирано, че участва в регулаторна мрежа, която поддържа израза на Lim1, Pax2, и Wnt9b израз в UB (31). Hnf1β дефицитните ембриони развиват тежка бъбречна хипоплазия със забавяне на индукцията на UB, загуба на поддържане на канал на Wolffian и намален растеж и разклоняване на UB. Hnf1β-регулираната генна транскрипция е от решаващо значение за взаимодействието на UB и MM, тъй като се проявява in vivo свързване с некодиращи регулаторни ДНК последователности на Pax2, Lim1, и Wnt9b (31). Това е особено ясно, като се има предвид същественото изискване за секреция на WNT9b от домейна на стъблото на UB и неговият ефект върху индукцията на MM нефрогенна програма. Нарушаването на тези събития вероятно дава представа за рядката връзка на бъбречната хипоплазия със синдрома на бъбречните кисти и диабет (RCAD) и мутациите при хора HNF1β (Таблица 1) (32).
Диференциация на уретеричните клетки.
Транскрипционният контрол на диференциацията на UB, особено на домена на върха, е от съществено значение за развитието на UB и правилното образуване на нефрон. Ектопичната свръхекспресия на ядрен фосфо протеин p53 в UB води до дефектна диференциация на UB и вторичен дефект на оцеляване в MM, което води до 50% намаляване както на размера на бъбреците, така и на броя на нефрона при възрастни мишки (33). Обикновено изразени при ниски нива в UB, прекомерните количества див тип p53 в UB водят до дефектна експресия и локализация на Връщане, маркер на уретерния връх, както и намалена експресия на тубуларни маркери за диференциация DBA лектин и Aquaporin-2.
ПРИНОС НА МЕЗЕНХИМАЛНАТА/СТРОМАЛНАТА КЛЕТОВА ЛИНИЯ ЗА БЪРЗОВАТА ХИПОПЛАЗИЯ
Мезенхимна/строма-зависима уретерна разклонена морфогенеза.
Бъбречната строма също е от решаващо значение за дарението на нефрона, преди всичко чрез регулиране на морфогенезата на уретера с разклонение от сигналната ос на ретиноевата киселина. Ретиноевата киселина е активната форма на хранителния витамин А, която се синтезира от ензими, включително Raldh2, и сигнали чрез рецептори на ретиноева киселина (Rar). Генетично елиминиране на Raldh2 и съставни нулеви мутанти за Rarα и Rarβ2 проявяват бъбречна хипоплазия и намалена експресия на Връщане в клетки на върха на уретерите (55,56). Интересното е, че конститутивно Връщане израз в Rarα; Rarнулеви мишки от β2 съединение нормализират развитието на бъбреците, което предполага критична роля на ретиноевата киселина в поддържането Връщане израз (57). Подобен модел на дефекти се наблюдава при потомството на майки с дефицит на витамин А (58,59), обсъдени по-подробно по-долу. Fgf7, изразен в стромален мезенхим, също е замесен в бъбречна хипоплазия. Генетично елиминиране на Fgf7 води до намалено разклоняване на уретерите и 30% намаляване на броя на нефроните (60). Fgf10 нулевите мутанти също показват по-малки бъбреци с намалена разклонена морфогенеза (61,62). Напоследък генетичните анализи демонстрират критична роля за Fgf10 в UB индукция и разклоняване на морфогенезата в сътрудничество с Gdnf (61).
Преживяемост на мезенхима и поддържане на нефрогенни предшественици.
Популацията от ММ и нефрогенни прекурсори осигурява потенциален ограничаващ фактор за дарение на нефрона. Дефектите в клетъчната пролиферация, оцеляването и самообновяването на предшествениците и ангажираността могат да доведат до по-малко клетки, способни да допринесат за образуването на нефрон.
Членове на Myc семейство гени до голяма степен медиират клетъчния растеж, пролиферацията и апоптозата. По време на метанефричното развитие, израз на c-myc е ограничено до ранен неиндуциран мезенхим и n-myc до ранните мезенхимни агрегати. Целево изтриване на c-myc към MM рода или n-myc дефицитът води до бъбречна хипоплазия поради значително намаляване на мезенхималната пролиферация, независимо от промените в апоптозата (63,64). Интересното е, че прогресивна загуба на експресия на нефрогенен предшественик на клетъчни маркери, Шест2 и Цитирано1, се наблюдава и в c-myc дефицит на бъбреците, което предполага това c-myc функции за модулиране на разпространението и вероятно самообновяване на популацията от нефрогенни прогениторни клетки (64).
Bcl-2 е онкоген, който инхибира апоптотичната клетъчна смърт и се изразява както в UB, така и в MM (65). Bcl-2 нулеви мутантни мишки развиват бъбречна хипоплазия и тежка бъбречна недостатъчност (66,67). Интересното е, че тези мутанти показват значително увеличение на апоптозата, предимно в ММ, което води до намалено разклоняване на уретерите и нефрогенеза.
Шест2 се изразява изключително в мезенхима на капачката, отбелязващ популацията на нефронов предшественик (68,69). Генетично елиминиране на Шест2 води до тежка бъбречна хипоплазия, характеризираща се с преждевременна и ектопична диференциация на нефрогенните тубули и бързо изчерпване на нефрогенната популация на предшественици (69). Освен това Брахирин модел на мишката (Br) демонстрира значително намаляване на ембрионалната експресия на Шест2 (70). Br хетерозиготните мишки показват силно намаляване на размера на бъбреците, 88% намаляване на нефронния брой, повишено средно артериално налягане и намалена бъбречна функция. По-нататък се подразбира изискване за поддържане на прогениторни клетки в нормално дарение на нефрона, Шест2 наскоро са установени мутации при хора с изолирана бъбречна хипоплазия (Таблица 1; 50).
В МАТА ОКОЛНА СРЕДА И БЪЛГАРСКА ХИПОПЛАЗИЯ
Има все повече доказателства, получени от епидемиологични проучвания при хора и животински модели, показващи важна роля за вътрематочната среда и програмирането на плода в патогенезата на бъбречната хипоплазия и предразположението към по-късно бъбречно заболяване (Таблица 3) (71,72).
Важното е, че основните генетични и молекулярни механизми, които причиняват бъбречна хипоплазия в отговор на неоптимално вътреутробно околната среда са до голяма степен неизвестни. По-доброто разбиране в тези случаи ще предостави значителна възможност за бъдещи превантивни интервенции.
ЗАКЛЮЧЕНИЕ
Генетичните проучвания при хора и мишки предоставят ценна информация за генетичния принос и молекулярните механизми, водещи до нормална нефронова надареност и бъбречна хипоплазия. По-конкретно, ролите на няколко критични паралелни и взаимодействащи сигнални пътища, включително GDNF/Ret, FGF, PAX2 и HH, са силно замесени в патогенезата на бъбречната хипоплазия. Освен това фактори, влияещи върху вътреутробно околната среда също са от решаващо значение за установяването на достатъчен брой нефрони, макар и от предимно неизвестни механизми. С непрекъснатия напредък в генетичните анализи на хора и мишки със сигурност ще последва идентифицирането на други известни и нови гени в дарението на нефрона. Разбирането на точните механизми, регулиращи дарението на нефрона, е необходимо, за да се ускори прогнозирането, диагностиката, профилактиката и лечението на бъбречната хипоплазия и рисковете за здравето, свързани с ниско ниво на нефрон.
- Оценка на модификацията на диетата при уравнение за изследване на бъбречната болест при голямо разнообразие
- Контрол на стомашни язви при прасета Свинарникът
- Диета за контролиране на хроничен синузит
- Cookbook Ghostwriter - On The Renal Diet CaryPress Books
- Дислипидемична клиника Педиатрична ендокринология Услуги за жени и деца Cape Fear Valley Health