Лаборатория за стомашно-чревни и чернодробни изследвания, Катедра по медицина, USUHS, Bethesda, MD 20814‐4799, САЩ.
* Имейл [email protected]; Тел. (+1) 301 295 3607; Факс (+1) 301 295 3676 или (+1) 301 295 3557. Потърсете още статии от този автор
Катедра по медицинска биохимия и биофизика, Университет Умео, SE ‐ 901 87 Умео, Швеция.
Лаборатория за стомашно-чревни и чернодробни изследвания, Катедра по медицина, USUHS, Bethesda, MD 20814‐4799, САЩ.
* Имейл [email protected]; Тел. (+1) 301 295 3607; Факс (+1) 301 295 3676 или (+1) 301 295 3557. Потърсете още статии от този автор
Катедра по медицинска биохимия и биофизика, Университет Умео, SE ‐ 901 87 Умео, Швеция.
Обобщение
Патогенността на много бактерии, колонизиращи стомашно-чревния тракт, често зависи от способността им да получат достъп до клетки, които обикновено не са фагоцитни. Helicobacter pylori колонизира стомаха на над половината от световното население и е основната причина за язвена болест и рак на стомаха. Обикновено се счита за неинвазивен патоген, присъстващ само в лумена на стомаха и прикрепен към стомашни епителни клетки, въпреки че редица in vivo и инвитро проучвания са доказали това H. pylori всъщност е инвазивна. В допълнение, H. pylori може да засели отново извънклетъчната среда след пълно елиминиране на извънклетъчните бактерии с гентамицин, което предполага, че може да се счита за факултативна вътреклетъчна бактерия. Този преглед изследва валидността на тези наблюдения и описва доказателствата, предполагащи, че вътреклетъчното присъствие на H. pylori играе роля в индуцирането на болести, в имунното избягване и в продължителната доживотна устойчивост на бактерията в стомаха на повечето хора.
Въведение
Стомашният лумен отдавна се счита за стерилна среда, въпреки че сега е установено, че в стомаха може да се открие наличието на много бактерии. От началото на 20-ти век много автори наблюдават наличието на спирални организми в стомаха и предполагат, че тези бактерии причиняват стомашни заболявания. Наблюденията им се игнорират най-вече до 1985 г., когато Уорън и Маршал демонстрират убедително това Helicobacter pylori причинява гастрит (Маршал и др., 1985а), откритие, за което те получиха Нобелова награда за физиология или медицина за 2005 г. В допълнение, наличието на H. pylori е силно свързана с язвена болест (Маршал и др., 1985b; Anonymous, 1994a) и рак на стомаха (Anonymous, 1994b). Днес ние знаем това H. pylori колонизира стомаха на над половината от популацията на думата и че той е постоянно свързан с хроничен активен гастрит, въпреки че само 15–20% от H. pylori положителните субекти изпитват стомашни заболявания и някои пациенти с пептична язва или рак на стомаха изглежда са H. pylori отрицателен.
Този очевиден парадокс предполага, че H. pylori присъствието в стомаха не е достатъчно, за да причини стомашно заболяване и че трябва да бъдат изпълнени едно или няколко допълнителни условия. Например, H. pylori трябва да носи специфични вирулентни гени (напр. cag остров патогенност и vacA и babA гени) (Peek and Blaser, 2002) и гостоприемникът може да се наложи да предразположи към развитие на нарушения по време на инфекция [напр. IL-1β или NOD генен полиморфизъм в определени популации (El-Omar и др., 2000; Розенстиел и др., 2006)]. В допълнение, може да се наложи наличието на неопределени фактори на околната среда, които ускоряват появата на заболяването и се смята, че защитните фактори като витамините са защитни. И накрая, други фактори могат да играят роля в H. pylori патогенност, продължителност на живота и устойчивост на антибиотично лечение.
Тъй като се смята, че инвазивността на много патогени играе роля в тяхната вирулентност и патогенност, възможно е инвазивността да играе роля в H. pylori патогенност, както е прегледано през 2003 г. (Petersen и Krogfelt, 2003). Настоящият преглед актуализира наличната към момента информация и обобщава in vivo и инвитро данни, доказващи това H. pylori може да нахлуе в стомашната лигавица и да присъства в стомашните епителни клетки и имуноцити. Прегледът също обсъжда дали H. pylori инвазивността играе роля за устойчивостта и патогенността на бактерията.
Наблюдения в H. pyloriИнфектирани хора и животни
Липсата на признание, че H. pylori може да бъде вътреклетъчно може да се дължи на факта, че електронната микроскопия е по-малко адаптирана за скрининг на голям брой проби, трудно се прилага към архивиран материал и освен това изисква отлично съхранение на пробите. За разлика от това, използването на мощна хистохимия, IHC и FISH е ефективно при скрининг на голям брой биопсии (включително архивирани тъкани) и при характеризиране на малки организми (Makristathis и др., 2004). Когато се прилагат такива методи, H. pylori се открива в ламина проприа и в стомашните епителни клетки и имуноцитите на пациенти със стомашни заболявания (Andersen and Holck, 1990; Genta и др., 1996; Енгстранд и др., 1997; Semino ‐ Mora и др., 2003; Неки и др., 2007).
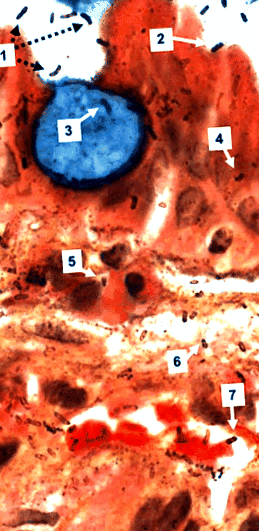
Наблюдението с голямо увеличение на оцветените от Genta биопсии лесно визуализира зацапани със сребро спираловидни организми не само в лумена на стомаха, но и в нормалните и метапластични стомашни епителни клетки, в ламина проприа и в поственозните капиляри, където изглежда се придържат към червените кръвни клетки (фиг. 1). Освен това размерът и външният вид на зацапаните със сребро организми в ламина проприа са поразително подобни на тези на интралуминалните H. pylori. Среброто обаче може да оцвети тъканните мембрани на гостоприемника и не е специфично за H. pylori и много патолози отхвърлят подобни наблюдения. За разлика от тях, конфокални микроскопични наблюдения на IHC и FISH препарати и ултраструктурни проучвания с имунозлато разкриват специфичната идентичност на организмите и тяхната вътреклетъчна локализация (Semino-Mora и др., 2003; Неки и др., 2007) и също потвърдено H. pylori наличие в капилярите на стомашната ламина проприа (Aspholm и др., 2006; Неки и др., 2007).
Стомашна биопсия на пациент с чревна метаплазия (Genta петно, оригинално увеличение × 1000). Синьо оцветената бокалена клетка е заобиколена от повече или по-малко нормални епителни клетки. Интралуминален H. pylori или са свободно плаващи (1), или са прилепнали към епителните клетки (2), но не и към бокаловата клетка. Пръчка, запетая и спирала H. pylori са видими в бокаловата клетка (3), в епителните клетки (4), във възпалителните клетки (5), в ламина проприа (6) и в пост-капилярна венула, където те са тясно свързани с еритроцитите (7) . Интересното е, че сребърното напрягане на интралуминално H. pylori изглежда по-силен, отколкото за вътреклетъчните и интерстициалните бактерии.
Инвитро наблюдения в клетъчни култури на епителни клетки и имуноцити
Понастоящем обаче няма пряко доказателство за това H. pylori може да се репликира вътреклетъчно, тъй като не е показано проучване с интервал от време H. pylori разделянето в клетките и броя на образуващите колонии единици (cfu) не се увеличава в AGS клетките, третирани с гентамицин (Amieva и др., 2002). Това последно наблюдение показва, че тези специфични инвитро експерименталните условия не осигуряват самоподдържаща се среда, но не изключват напълно вътреклетъчната репликация на H. pylori. Всъщност вътреклетъчният брой на cfu представлява сложен баланс между влизането, вътреклетъчния растеж, вътреклетъчната смърт и излизането от клетките и този деликатен баланс може да бъде нарушен от извънклетъчния гентамицин. In vivo, възможно е това H. pylori временно се скрива вътреклетъчно и след това излиза, след като опасността бъде премината, подобно на това, което може да се случи с Campylobacter jejuni, друг факултативен вътреклетъчен организъм.
Сложната връзка между H. pylori и имуноцитите, на които е възложено тяхното елиминиране, могат да помогнат да се обясни защо инфекцията обикновено продължава за живота на индивида. Инвитро, фагоцитиран H. pylori остават ултраструктурно неповредени, когато се инкубират с полиморфонуклеарни левкоцити и моноцити в отсъствие на комплемент или серум, докато добавянето на комплемент или серум към инкубационната среда води до унищожаване на бактериите (Andersen и др., 1993; Кист и др., 1993). По същия начин добавянето на имунен серум плюс излишък от моноцити намалява броя на H. pylori, като има предвид, че излишъкът от PMNs доведе до пълно убиване на H. pylori (Андерсен и др., 1993). Някои от фагоцитираните бактерии обаче не са засегнати след инкубация с моноцити и серум и често са заобиколени от големи агрегати на тромбоцити (Andersen и др., 1993). Това последно наблюдение може да е от значение за нормализирането на броя на тромбоцитите, наблюдавано при почти половината от пациентите с имунна тромбоцитопенична пурпура след H. pylori ликвидиране (Кувана и Икеда, 2006).
Helicobacter pyloriИндуцирано неопсоново активиране на човешки неутрофили се осъществява чрез лектинофагоцитоза, т.е. прилепване на свързващия сиалова киселина адхезин SabA към ганглиозидите на повърхността на неутрофилите (сиалилирани гликолипиди), които активират фагоцитозата (Unemo и др., 2005). SabA наскоро беше идентифициран като дълго търсената зависимост на сиаловата киселина H. pylori хемаглутинин, който агрегира бактериални клетки с еритроцити инвитро. В допълнение, H. pylori е прикрепен към еритроцитите в малки съдове в стомашната лигавица, което предполага, че хемаглутинацията може да има пряко биологично значение и да е механично активна in vivo (Аспхолм и др., 2006). В стомашната лигавица, H. pylori често е в излишък в сравнение с фагоцитите. Ако инвитро резултатите отразяват in vivo ситуация, фагоцитите може да са неефективни в H. pylori убийство, което може да играе роля за постоянството на H. pylori в стомашния епител.
Подобни събития са наблюдавани в макрофаги. Имунофлуоресценцията и електронната микроскопия показаха, че е вирулентен H. pylori съдържащи cag островите на патогенността бързо се интернализират във богати на актин фагозоми (Allen и др., 2000). Тогава хомотипното сливане на фагозома доведе до образуването на „мегазоми“, съдържащи множество H. pylori които са жизнеспособни за ≥ 24 часа (Алън и др., 2000). За разлика, H. pylori щамове, които не експресират CagA или VacA, бяха лесно фагоцитирани и убити и не бяха наблюдавани мегазоми (Алън и др., 2000). Мегазомно образуване и H. pylori Доказано е, че преживяемостта зависи от уреазата и произведения от уреаза амоняк и подкисляването на фагозомите (Schwartz and Allen, 2006). Вътреклетъчното присъствие на H. pylori в имуноцитите е свързано с производството на апоптоза в Т- и В-клетъчните линии (Singh и др., 2006) и in vivo (Semino ‐ Mora и др., 2005), което може да играе роля за персистирането на инфекцията (Singh и др., 2006).
Механизъм и времеви ход на H. pylori инвазивност
Времеизтичащата сканираща електронна микроскопия (SEM) и TEM документираха времевия ход на първоначалното сцепление и последващото въвеждане на H. pylori в HEp2 клетки (фиг. 2) (Lofman и др., 1997). Изглежда, че влизането включва различен механизъм в клетките на AGS, с интимна адхезия на H. pylori до псевдоподи, излизащи от AGS клетки, което води до прогресивно поглъщане на H. pylori по цип (фиг. 3) (Kwok и др., 2002).
А. SEM снимка на H. pylori влизане в клетка HEp2 (с разрешение от М. Блок, след Engstrand и Graham, 1997). B и C. Наблюдение във времето за две H. pylori очертано в червено, показващо прогресивното влизане в HEp2 клетка за 49 s време. Адаптиран с разрешение от Macmillan Publishers Ltd. Природна медицина3: 930–931, авторски права 1997.
SEM и TEM анализи на H. pylori 26695 придържане и влизане в AGS клетки. AGS клетки, заразени с H. pylori 26695 при множество инфекции от 100 за 12 часа при 37 ° C. Проби, получени по различно време, се анализират чрез SEM и TEM. H. pylori прилепнали към AGS клетки чрез интимен контакт с микровилите на клетката гостоприемник (30 минути, стрелки). Характеристики на поглъщане, подобно на цип, се наблюдават на 1 час, 90 минути и 3 часа след инфекцията. Барове, 1,5 μm. С разрешение от Kwok и др. (2002).
Молекулярните проучвания показват, че навлизането в епителните клетки е постигнато чрез ендоцитоза, медиирана от рецептор (Evans и др., 1992) и чрез активен процес на бактериална подвижност и проникване в клетъчните мембрани (Bjorkholm и др., 2000). След това бактериите бяха свързани в плътни вакуоли в тясна връзка с кондензирани нишковидни сигнали за актин и тирозин фосфорилиране. Тези събития се инхибират в зависимост от дозата от TNF-α и инхибитори на фосфатидилинозитол 3-киназа и на протеин киназа С и се усилват от инхибитор на тирозин фосфатази и АТФази (Kwok и др., 2002).
Диференциално интерференционно контрастно видео и имунофлуоресцентна микроскопия (фиг. 4) илюстрираха това H. pylori може да навлезе в големи цитоплазмени вакуоли от множество епителни клетъчни линии, включително аденокарцином на стомаха и дебелото черво и бъбречна клетъчна линия (Amieva и др., 2002). Лечението с цитохалазин D не повлиява образуването на вакуоли, но потиска навлизането в клетките, което предполага, че актиновият цитоскелет играе роля в навлизането на клетките (Amieva и др., 2002). След като влезете в клетките, H. pylori остава подвижен в рамките на вакуоли в продължение на няколко часа, както е показано чрез микроскопия със закъснение. Импулсното лечение с гентамицин показва, че полуживотът на интравакуоларните бактерии е приблизително 24 часа и че някои интравакуоларни бактерии остават жизнеспособни, освобождават се и репопулират извънклетъчната среда след отстраняването на гентамицин.
Илюстрация на диференциално имунооцветяване на AGS клетки, култивирани с H. pylori. Както е илюстрирано от жълтата стрелка, повечето H. pylori са оцветени в жълто и са разположени извън клетките. Един от H. pylori е вътреклетъчно (червена стрелка) и е оцветено в червено (по Амиева и др., 2002 г. с разрешение).
Един от тях може да бъде инвазин (InvA) протеин, подобен на този, произведен от ентеропатогенен Йерсиния и това се свързва с интегриновите рецептори на чревни М клетки и позволява влизане в тези клетки (Isberg и др., 2000). В случай че H. pylori, щамът J99 има хомоложен инвазинов протеин InvA и an invA ген, докато подобни последователности са наречени NudA и nudA в щама 26695 и също присъстват в наскоро публикуваните пълни геноми HPAG1 (номера за достъп CP000241 и NC_008086), въпреки че не е посочено име (Oh и др., 2006).
Уместност на H. pylori инвазивност
И накрая, вътреклетъчно H. pylori са по-устойчиви на антибиотично лечение и само високи концентрации на антибиотици с вътреклетъчна активност могат да елиминират бактерията от HEp2 клетки. In vivo, IHC демонстрира, че инфекцията не се лекува от антибиотици при пациенти с персистиращи вътреклетъчни H. pylori инфекция, дори ако елиминирането на извънклетъчните бактерии е завършило на 14 дни след лечението (Engstrand и др., 1997). По този начин антибиотиците с вътреклетъчна активност (напр. Макролиди) трябва да се използват предимно за лечение на H. pylori инфекция (Hulten и др., 1996; Печере, 2001).
Заключения
Четвърт век след откриването на H. pylori и демонстрация, че бактерията причинява стомашен аденокарцином, MALT лимфом и пептични язви, убедително in vivo доказателствата показват, че бактерията може да влезе и да експресира иРНК и антигени в стомашната ламина проприа. В допълнение, инвитро проучванията показват, че жизнеспособни H. pylori оцеляват в епителните клетки и имуноцитите, проявяват насочени движения в рамките на вътреклетъчните вакуоли и отново населяват извънклетъчното пространство, след като извънклетъчната бактериална популация е била убита от гентамицин за период до 3 дни. Въпреки това, преките наблюдения във времето не предоставят пряко доказателство за вътреклетъчна репликация на H. pylori чрез визуализация на бактерии, разделящи се в епителните клетки, и не се наблюдава увеличаване на броя на вътреклетъчните клетки. Освен това, не H. pylori фактор е известно, че е от съществено значение за инвазия или вътреклетъчно оцеляване. И накрая, фракцията вътреклетъчна спрямо интралуминална H. pylori съобщава се, че е приблизително 1% в стомашно-чревните епителни клетки и незначителен в HeLa клетките и е изкушаващо да се помисли, че инвазивността на бактерията не е клинично важна.
Независимо от това, малък брой бактерии, разположени в цитоплазмата на няколко бързо делящи се и стратегически разположени клетки, могат да имат потенциал да модифицират редица цитоплазмени и ядрени процеси и могат да причинят CpG метилиране и ДНК мутации, особено защото гените на вирулентност са известни като изразен в епителните клетки (Semino-Mora и др., 2003; Неки и др., 2007). По този начин, тъй като се смята, че много видове рак са еволюирали от една единствена клетка, няколко вътреклетъчни H. pylori може да задейства имунни, канцерогенни или други пътища за отговор на развитието, особено когато те присъстват в епителните клетки-предшественици, които се делят бързо (Oh и др., 2005; Semino ‐ Mora и др., 2007). Този процес е интуитивно привлекателен за обяснение на неопластична трансформация на епителни клетки, водеща до аденокарцином и на имуноцити, водеща до MALT лимфом. Освен това, сложни взаимодействия между H. pylori и имуноцитите могат да смекчат имунитета на гостоприемника и да играят важна роля за устойчивостта на бактерията.
Въпреки вече постигнатия напредък е ясно, че допълнителен инвитро и трябва да се извършат проучвания върху животни и наблюденията трябва да бъдат интегрирани с нови клинични наблюдения, преди да можем да установим това H. pylori инвазивността играе роля за бактериалната патогенност, устойчивост и устойчивост на антибиотици.
Благодарности
Благодарим на д-р В. Симко за предоставяне на стомашни биопсии от хора и на д-р Семино-Мора за предоставяне на фиг. 1. Благодарим също на д-р Енгстранд, Майер и Амиева, че ни предоставиха и позволиха да използваме висококачествени снимки, използвани за изграждането на фигури 2– 4 съответно. Поддържа се отчасти от Националните здравни институти (CA82312/AD).
- Helicobacter pylori Предотвратява ли гастритът колит
- Реакции на антитела срещу Helicobacter pylori и риск от колоректален рак в проучване за контрол на случая през
- Инфекция с хеликобактер пилори, рефлуксен езофагит и атрофичен гастрит Неизследван триъгълник -
- Инфекцията с хеликобактер пилори и ниското хранително промяна в поведението предизвикват желязодефицитна анемия,
- Инфекцията с хеликобактер пилори утежнява индуцирана от диетата инсулинова резистентност във връзка с червата