Хиперамонемията увеличава астроцитния пул глутамин приблизително три пъти и следователно количеството на етикета, включен в мозъчните метаболити, е пропорционално по-високо.
Свързани термини:
- Аминокиселина
- Хипогликемия
- Амоний
- Нарушение на цикъла на урея
- Ензим
- Протеин
- Мутация
- Цикъл на урея
- Мозъчна болест
Изтеглете като PDF
За тази страница
Хиперамонемия
КЛИНИЧНА ПРЕЗЕНТАЦИЯ
Симптомите, свързани с хиперамонемия, отразяват предимно невротоксичността на амоняка; следователно, хиперамонемия трябва да се има предвид при пациенти с необясними промени в психичното състояние, енцефалопатия или признаци на повишено вътречерепно налягане (Таблица 131-1). При новородените симптомите на хиперамонемия могат да бъдат невъзможни за разграничаване от тези на сепсиса; те включват намалена активност, лошо хранене, енцефалопатия и гърчове. Важна отличителна характеристика е, че новородените с хиперамонемия могат да имат респираторна алкалоза (средно рН 7,5, с Pco2 24), тъй като амонякът стимулира хипервентилацията. 2 Освен това тези деца обикновено не успяват да се подобрят след течна реанимация и антимикробна терапия; вместо това неврологичните симптоми могат да прогресират, като кулминират в кома. В такива случаи трябва силно да се подозира UCD. При по-големите деца хиперамонемията може да бъде дори по-трудно да се идентифицира, тъй като симптомите са или неспецифични (циклично повръщане, главоболие, лош апетит) или лесно се объркват с по-често срещани проблеми като злоупотреба с наркотици или първично психиатрично заболяване (остри промени в психичния статус, откровена психоза).
Представянето на хиперамонемия при новородени с UCD обикновено е това на незабележимо новородено с бременност, което е добре през първите няколко дни от живота. Прогресивният прием на протеини обаче води до азотен дисбаланс и хиперамонемия, обикновено през първата седмица от живота. Ретроспективен анализ на 74 бебета с дефицит на орнитин транскарбамоилаза (OTC), най-често срещаният UCD, показва средно начало на заболяването при 63 часа живот, с диапазон от 12 до 240 часа. 2
Децата с повечето видове UCD имат доживотен риск от хиперамонемични епизоди, които обикновено се появяват, когато се въведе нов азотен дисбаланс. Това може да бъде причинено от повишен прием на протеини с храната или индуциран от катаболен стрес оборот на мускулните протеини, който се случва по време на продължително гладуване, треска или повишено физическо натоварване. През тези периоди нивата на амоняк в кръвта могат бързо да се повишат и бързото лечение е от решаващо значение. По същия начин децата с леки форми на UCDs може да не страдат от първоначална хиперамонемична криза до заболяване по време на ранна детска възраст или дори по-късно в детството или юношеството, когато азотният дисбаланс причинява остри промени в психичния статус или други признаци на хиперамонемия. При такива пациенти задълбочената анамнеза може да разкрие причината за дисбаланса, като внезапно увеличаване на приема на протеини в храната или драстично увеличаване на упражненията.
Вродени грешки на метаболизма
1.6.1.4 Нива на амоняк в кръвта
Хиперамонемията е животозастрашаващо състояние и трябва да се подходи бързо за намеса. Хиперамонемията обикновено се придружава от респираторна алкалоза в резултат на стимулиране на вентилацията. Нивото на амоняк в плазмата винаги трябва да се изследва при пациент с необяснимо повръщане, летаргия или някакъв вид енцефалопатия [28] .
Концентрацията на амоняк в човешката плазма е микромоларна и варира във венозна, артериална или капилярна кръв, както и в зависимост от времето, възрастта, метода за анализ и начина на вземане на проби (Таблица 7). Плазмените нива на амоняк се определят от хепаринизирана кръвна проба, която трябва да се транспортира върху лед до лабораторията [29] .
Таблица 7. Нормални нива на амоняк в кръвта според възрастовите групи
| 50–159 | 85–271 |
| 24–48 | 41–82 |
| 11–48 | 19–82 |
| 15–55 | 26–94 |
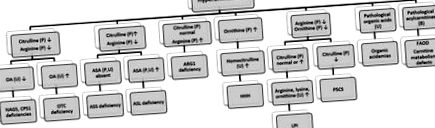
Хиперамонемията обикновено е симптом за UCD и може да се наблюдава и при органични ацидемии като пропионова ацидемия, метилмалонова ацидемия, изовалерианова ацидемия и множествен дефицит на карбоксилаза. Преходната хиперамонемия на новороденото е състояние, което обикновено се среща при големи недоносени бебета (около гестационна възраст от 36 седмици) с белодробно заболяване и причинява тежка хиперамонемия. Леката и преходна хиперамонемия, по-висока от два пъти нормална, е често срещана при новороденото, особено при недоносеното бебе, което обикновено протича безсимптомно. Диференциален подход към хиперамонемията е показан на фиг. 7 [28–30] .
Фигура 7. Диференциална диагноза на хиперамонемия за IEM. OA: оротична киселина, ASA: аргининосукцинатна киселина, ASS: аргининосукцинат синтетаза, ASL: аргининосукцинат лиаза, ARG: аргиназа, LPI: непоносимост към лизинуринов протеин, HHH: хиперамонемия-хиперорнитинимия-хомоцитрулин5ТС синдром, карбокситрилат 5-карцинолин орнитин транскарбамилаза, CPS: карбамил фосфат синтетаза, NAGS: N-ацетилглутамат синтетаза, FAOD: дефекти на окисляване на мастни киселини.
Цикъл на урея и други нарушения на хиперамонемия
Резюме
Хиперамонемията, характеризираща се с излишък на амоняк в кръвта, може да бъде животозастрашаващо състояние. Клиничните симптоми са неспецифични и включват лошо хранене, летаргия, раздразнителност, тахипнея, гърчове, запушване и дихателна недостатъчност. Хиперамонемията се дължи на дефект при детоксикация или свръхпроизводство на амоняк. Дефектите в урейния цикъл водят до най-тежката хиперамонемия. Други причини за хиперамонемия включват различни метаболитни дефекти като някои органични ацидурии, дефекти на окисляване на мастни киселини, лекарства и чернодробни заболявания. Най-важният диагностичен тест за диагностика на хиперамонемия е измерването на плазмения амоняк. За диференциална диагноза на хиперамония се използват различни биомаркери. Те включват профили на аминокиселини в плазмата и урината, профили на органични киселини в урината и плазмени профили на ацилкарнитин. Лечението на остра хиперамония включва спиране на приема на протеини и лечение с азотни чистачи и глюкоза. Аргинин се прилага при всички дефекти на урейния цикъл, с изключение на дефицита на аргиназа. Биомаркерите за проследяване на заболяването включват плазмени нива на амоняк, специфични аминокиселини и оротна киселина в урината. Тъй като пациентите са на диета с ниско съдържание на протеини, маркерите за хранителен дефицит също се наблюдават.
Парентерално хранене
Амоний
Хиперамонемия се е появила по време на парентерално хранене като компонент на терапията за бъбречна недостатъчност [23]. Хиперамонемията се представя като промяна в психичния статус, развиваща се около 3 седмици след започване на терапия с парентерално хранене; в повечето случаи епизодите са с нарастваща продължителност и пароксизмални. При трима от пациентите анализът на серумните аминокиселини в острата фаза показва намалени концентрации на орнитин и цитрулин (съответният субстрат и продукт на кондензация с карбамил фосфат при влизането му в урейния цикъл). Концентрациите на аргинин, предшественик на орнитин, бяха повишени.
Амонячен метаболизъм и хиперамонемични нарушения
15 Разни причини
HA възниква при хиповолемичен шок и застойна сърдечна недостатъчност. Повишеното освобождаване на амоняк от хипоксичните мускули и загубата на перицентрални хепатоцити, а оттам и защитната GS активност, допринасят. Вродените портосистемни шунтове са рядка причина [1,273]. Тъканната хипоксия/исхемия, чернодробна незрялост и портосистемно шунтиране чрез патентен дуктус венозус са всички предложени причини за преходно НА на новороденото, рядко, необяснимо разстройство, което обикновено засяга недоносени бебета с дихателен дистрес и ацидоза. Плазменият амоняк бързо нараства до много високи стойности (често над 1500 μmol/L) и острата енцефалопатия се развива в рамките на 2-3 дни от живота. Плазменият глутамин, аланин и цитрулин са умерено повишени, тестовете за чернодробна функция са незабележими и ензимите на урейния цикъл са нормални. Плазменият амоняк бързо пада с ранно агресивно лечение и НА не се повтаря. Оцелелите имат нормален толеранс към протеини [274] .
Производството на амоняк се увеличава от прекомерен абоминокиселинен катаболизъм, например в резултат на тежки физически упражнения, припадъци, травми или изгаряния, прилагане на стероиди, химиотерапия, стомашно-чревен кръвоизлив, добавки с високо съдържание на протеини на лошо подхранени пациенти, дефицит на аргинин и пикочен мехур, матка или стави напояване с глицинов разтвор по време на операция. Това може да утаи симптоматично НА при тези, които вече са изложени на риск поради други причини [285–287]. Интензивните упражнения са друга причина [40]. И накрая, се съобщава за хиперамонемична кома при пациенти с тежък хипотиреоидизъм и съпътстващо чернодробно заболяване, но без други данни за чернодробна декомпенсация. Това изглежда много рядко. Симптомите се разрешават с заместителна терапия на щитовидната жлеза. Механизмът е неизвестен [288 289] .
Вродени грешки на метаболизма на въглехидратите, амоняка, аминокиселината и органичната киселина
J. Lawrence Merritt II, Renata C. Gallagher, в Avery's Diseases of the Newborn (Десето издание), 2018
Преходна хиперамонемия на новороденото
THAN е най-често при недоносени новородени под гестационна възраст под 36 седмици, които имат тегло при раждане под 2,5 kg. Обикновено се появява след синдром на дихателен дистрес през първите 24 часа от живота и кома се развива през първите 48 часа от живота (Ballard et al., 1978). Нивата на амоняк в серума могат да надхвърлят 1500 µmol/L и кърмачетата може да се нуждаят от хемодиализа и ограничаване на протеините (Stojanovic et al., 2010).
Причината за това заболяване е неизвестна, въпреки че в някои случаи това може да се дължи на патентен ductus venosus. Трябва да се направи доплер ултразвук на порталната вена, за да се оцени съсирек в порталната вена. Плазмените нива на аминокиселини могат да имат повишения на цитрулин и аргинин. Съотношението глутамин към амоняк може да различи това от дефект на цикъла на урея (съотношение глутамин към амоняк Stojanovic et al., 2010). Изглежда, че смъртността при THAN е свързана с продължителността на кома; резултатът може да бъде добър при оцелелите бебета и може да не е необходимо продължително лечение и ограничаване на протеините.
Непрекъсната бъбречна заместителна терапия при педиатрични пациенти
Дейвид Т. Селевски, д-р, Патрик Д. Брофи, д-р, MHCDS, в Наръчник по диализна терапия (пето издание), 2017 г.
Вродени грешки на метаболизма
Хиперамонемията представлява истинско спешно състояние и налага бързо лечение. Използването на CRRT за лечение на вродени грешки в метаболизма (като дефекти на цикъла на уреята) е стандартна практика. При деца с хиперамонемия протоколите за лечение класически започват с цикъл на интермитентна хемодиализа, последван от преход към CRRT, за да се предотврати обичайното възстановяване, свързано с интермитентна HD. Съвсем наскоро, използвайки съвременни CRRT устройства, бяха разработени протоколи за лечение, използващи CRRT в дози от 8 L/h/1,73 m 2 без първоначално провеждане на хемодиализа. Този режим може да осигури полза чрез избягване на хипотония, която може да бъде свързана с хемодиализа при критично болни новородени. Ако се изисква метаболитен коктейл като натриев бензоат, може да се наложи дозата да се увеличи, за да се приспособи увеличеният клирънс на тези коктейли с CRRT. Като цяло установихме, че удвояването на скоростта на инфузия е адекватно и трябва да включва консултации с фармацевти и генетици.
Метаболитни нарушения
Преходна хиперамонемия на новороденото (THAN)
При новородени, родени в периода на бременност от 34 до 36 седмици, може да се появи преходна симптоматична хиперамонемия. Клиничните особености са дихателен дистрес и летаргия, прогресиращи до припадъци и кома в рамките на 4 дни след раждането. Често се наблюдава разширяване на зеницата.
Първоначалните плазмени концентрации на амоняк са 800 до 3400 μg/dL, но могат да достигнат максимум до 7600 μg/dL. Не се доказва недостиг на ензими с уреен цикъл. Въпреки че причината за хиперамонемия не може да бъде определена, засегнатите новородени реагират бързо и напълно на обменна трансфузия или диализа. ТАКА оцелелите имат нормални неврологични оценки и оценки на развитието по-късно и не изпитват повтарящи се епизоди на хиперамонемия. Тази симптоматична хиперамонемия може да е преувеличение на физиологична, несимптомна хиперамонемия, открита при повече от 50% от недоносените деца, която не изисква лечение.
Цикъл на урея: Аспекти на заболяването
Диагноза
Хиперамонемията е обща за всички нарушения на урейния цикъл. За съжаление измерването на амоняк може да бъде трудно при често отбелязвани фалшиви повишения. Кръвта трябва да се взема от свободно течащ източник (обикновено от вена) и да се охлажда бързо, за да се избегне изкуственото производство от кръвни клетки. Всяка клинична лаборатория трябва да установи свои собствени нормални стойности за амоняк в кръвта; някои вариации са често срещани. При деца и възрастни плазмената концентрация на амоняк обикновено е под 35 μmol l -1. Концентрациите в кръвта при здрави новородени бебета често могат да достигнат до 100 μmol l -1 при доносено бебе и 150 μmol l -1 при недоносено бебе. Концентрацията на амоняк в плазмата при болното бебе обикновено е повече от 200 μmol l -1 .
Фигура 2. Клиничен подход към новородено бебе със симптоматична хиперамонемия.
- Лираглутид - общ преглед на ScienceDirect теми
- Диета с високо съдържание на фруктоза - общ преглед на темите на ScienceDirect
- Високофруктозен царевичен сироп - преглед на ScienceDirect теми
- Лимфоидна хиперплазия - общ преглед на ScienceDirect теми
- Mallory Body - общ преглед на ScienceDirect теми