Резюме
Хранителните субстрати, получени от храната, могат да активират вътреклетъчни сигнални каскади за регулиране на метаболитното здраве.
Диетата има огромно въздействие върху много аспекти на нашето здраве, но научният консенсус за това как това, което ядем, влияе върху нашата биология остава неуловим. Това е особено вярно по отношение на продължаващия дебат за затлъстяването. Докато мнозина в научната общност се фокусират върху това как диетите с високо съдържание на мазнини могат да доведат до повишено телесно тегло (1), други твърдят, че трябва да обвиняваме преработените въглехидрати (2). Възможно ли е този фокус върху макронутриентите (т.е. мазнините, протеините и захарите) да е погрешно поставен?
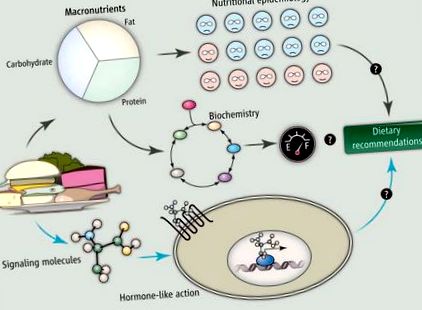
Голяма част от неотдавнашния публичен дискурс за взаимодействието между храната и метаболитното здраве разчита на два основни подхода (вж. Фигурата). Едната е хранителната епидемиология, при която популациите от хора, които ядат различни храни, се сравняват по отношение на здравни показатели като телесно тегло, с цел да се определи кои диети са повече или по-малко „здравословни“. Другото е биохимията, при която целта е да се определи как различните макронутриенти се обработват, за да се получи енергия. Въпреки ценната информация, предоставена от тези два подхода, нито един от тях не е довел до преводима научна основа за препоръчване на диети, които подобряват метаболитното здраве или намаляват телесното тегло за голям процент от засегнатото население, може би защото разглеждането на храната само по отношение на съдържанието на макроелементи пренебрегва сложността на взаимодействието на храната с телата ни.
Хранителната епидемиология и биохимичните подходи, фокусирани главно върху връзката между консумацията на макронутриенти и метаболитните резултати, не осигуряват преводима научна основа за препоръчване на диети, които подобряват метаболитното здраве за широк кръг хора. Като алтернатива, разбирането на нашата диета като колекция от сигнални молекули, имащи хормоноподобни действия чрез сигнализиране на клетъчната повърхност и ядрените рецептори, може да даде нови прозрения за връзката между това, което ядем, и метаболитните заболявания. Нещо повече, тази рамка в крайна сметка може да ни позволи да правим диетични препоръки отдолу нагоре - въз основа на способността на определени храни да променят съответните сигнални пътища.
Все повече доказателства предполагат алтернативна перспектива. Тоест циркулиращите субстрати, получени от храна, имат специфични преки и непреки действия за активиране на рецепторите и сигналните пътища, в допълнение към осигуряването на гориво и основни микроелементи. В крайна сметка храната може да се разглежда като коктейл от „хормони“. Хормонът е регулиращо съединение, произведено в един орган, което се транспортира в кръвта, за да стимулира или инхибира специфични клетки в друга част на тялото. Хормоните оказват своето въздействие върху прицелните тъкани, като въздействат върху рецепторите на клетъчната повърхност, за да променят активността чрез вътреклетъчни сигнални каскади или чрез ядрени рецептори за регулиране на генната транскрипция. Въпреки че храната не се произвежда в тялото, нейните компоненти пътуват през кръвта, а хранителните субстрати могат да действат като сигнални молекули чрез активиране на клетъчната повърхност или ядрените рецептори.
Като пример, хранителната епидемиология изтъква ползите от яденето на омега-3 мастни киселини за защита срещу кардиометаболитен синдром и наддаване на тегло (3). И все пак простата биохимия не може да обясни задоволително защо омега-3 мастните киселини трябва да водят до ползи в сравнение с други мастни киселини. Омега-3 мастните киселини се свързват и активират рецептора на клетъчната повърхност GPR120 (4), който се експресира във важни метаболитни тъкани, включително мастната тъкан и мускулите. Намалената сигнализация на GPR120 е свързана с възпаление, наддаване на тегло и нарушен контрол на глюкозата както при мишки, така и при хора (4, 5). По този начин, за да генерират пълния спектър от благоприятни ефекти върху риска от съдови заболявания, погълнатите омега-3 мастни киселини не просто се обработват, за да генерират енергия, а допълнително действат чрез GPR120 в ключови тъкани за подобряване на метаболитните крайни точки.
Докато активирането на GPR120 изглежда предпазва от наддаване на тегло, други активирани с липиди рецептори имат обратен ефект. Рецепторът, активиран от пероксизомен пролифератор γ (PPARγ), например е ядрен рецептор, който се активира от различни мастни киселини и регулира транскрипцията на гени, важни за липидния и глюкозния метаболизъм. Увеличаването на активността на PPARy с фармакологични агонисти подобрява съхранението на липидите в мастната тъкан, а също така действа в мозъка, за да предизвика хиперфагия, двойни действия, които насърчават натрупването на телесни мазнини (6–8). В съответствие с това, намаляването на активността на PPARγ в мозъка намалява консумацията на диети с високо съдържание на мазнини, като по този начин притъпява наддаването на тегло (6, 8). Тези изследвания поставят основите за разбиране как компонентите на диетите с високо съдържание на мазнини причиняват прекомерна консумация и наддаване на тегло чрез активиране на специфични рецептори на мастни киселини в мозъка.
Освен че действат директно върху тези специализирани рецептори на мастни киселини, има доказателства, че някои хранителни мастни киселини също модифицират действията на класическите хормони. Например, полученият от стомаха хормон грелин увеличава приема на храна и увеличаване на теглото, като се свързва с неговия рецептор, рецептор на секретагога на растежния хормон (GHSR). Въпреки това, за да може грелинът да сигнализира ефективно, мастната киселина трябва първо да бъде прикрепена към пептида като странична верига. Различните странични вериги на мастни киселини, получени от различни хранителни мазнини, променят способността на грелина да увеличава приема на храна (9). Тези странични вериги на мастните киселини идват от погълнатата храна, а не от мастната тъкан (10). По този начин специфични диетични компоненти могат да упражняват хормоноподобни метаболитни ефекти чрез физическо взаимодействие с пептиден хормон.
Мастните киселини не са единственият пряк източник на „хормони“ в нашата храна; някои аминокиселини също могат да активират сигналните пътища. Най-изследвани са аминокиселините с разклонена верига, включително левцин, който активира пътя на рапамицин (mTOR) при бозайниците. mTOR е серин-треонин киназа, която регулира прогресията на клетъчния цикъл, растежа и действието на инсулина (11). Левцинът директно активира mTOR пътя в централната нервна система, за да намали приема на храна и телесното тегло (12, 13).
Хранителните компоненти също взаимодействат с чревната флора, за да предизвикат индиректни сигнални каскади в тялото. Например, несмилаемите сложни въглехидрати, включително диетичните фибри, се метаболизират от чревната микробиота и ферментират до крайни продукти с къса верига на мастните киселини (SCFA) - главно ацетат, пропионат и бутират (14). Тези SCFA се свързват и активират рецепторите на клетъчната повърхност на свободните рецептори на мастни киселини 2 (FFAR2) и FFAR3, за да променят метаболизма на гостоприемника. Например, FFAR2 и 3 се експресират в ентеро-ендокринни L клетки, които произвеждат инкретиновия хормон глюкагон-подобен пептид – 1 (GLP-1). Стимулирането на L клетки със SCFA индуцира секрецията на GLP-1, но този ефект се намалява при липса на FFAR2 или, в по-малка степен, FFAR3 (15). Ацетатът и пропионатът също активират FFAR2 върху адипоцитите, за да увеличат експресията на редуциращия теглото хормон лептин. По този начин специфични диетични въглехидрати, модифицирани от чревната микробиота, могат да сигнализират към специфични рецептори, за да променят енергията на цялото тяло и метаболизма на глюкозата.
Разглеждането на храната като хормон може значително да повлияе на това как правим диетични препоръки за укрепване на здравето или лечение на специфични заболявания. Вместо да използваме само хранителна епидемиология, за да идентифицираме какво консумират здравите хора, ние може да успеем да проектираме диети отдолу нагоре - въз основа на способността им да променят сигналните пътища в определени тъкани, за които знаем, че са свързани с метаболитно заболяване. Освен това тази рамка предполага, че аргументът дали мазнините или захарта са виновни за нарастващата честота на затлъстяване може да бъде погрешен. Макронутриентите се класифицират по техните енергийни биохимични свойства, а не по способността им да активират рецепторите по начин, подобен на този на хормона. Може да е по-продуктивно да се изследват сигналните свойства на дадена диета, за да се разбере дали тя ще насърчи наддаването или отслабването. Идентифицирането на тези взаимодействия между храни и хранителни метаболити и рецептори ще предостави нови възможности за разбиране на връзката между това, което ядем, и болестите, включително затлъстяването.
- Често срещани причини за алергия към храна, симптоми и скрити задействания
- Можете ли да ядете кисело мляко по време на бременност, коя марка е най-добра; Проверка на храните за бременност
- Близнаци с двойна енергия се справят с хранителни алергии - Независимият Санта Барбара
- Египетските свещеници живеели на диета с нездравословна храна
- Общи заместители на съставките, които ще донесат вашите рецепти в Life Food Network Canada