Роза Розания
a Катедри по гастроентерология, хепатология и инфекциозни болести, Магдебург, Германия
Костанца Чиапани
b Катедри по обща, висцерална и съдова хирургия, Университет Ото-фон-Герике Магдебург, Магдебург, Германия
Питър Малфертайнер
a Катедри по гастроентерология, хепатология и инфекциозни болести, Магдебург, Германия
Марино Венерито
a Катедри по гастроентерология, хепатология и инфекциозни болести, Магдебург, Германия
Резюме
Заден план
Хранителното управление на пациенти с рак на стомаха (GC) представлява предизвикателство.
Обобщение
Този преглед предоставя преглед на настоящите доказателства за хранителната подкрепа при пациенти с GC, подложени на операция, както и при пациенти с напреднало заболяване
Ключово съобщение
За пациенти, подложени на операция, предоперативното хранително състояние пряко влияе върху следоперативната прогноза, общата преживяемост и специфичната за заболяването преживяемост. Периоперативната хранителна подкрепа, обогатена с имуностимулиращи хранителни вещества, намалява общите усложнения и престоя в болницата, но не и смъртността след големи планови стомашно-чревни операции. Ранното ентерално хранене след операция подобрява ранния и дългосрочния следоперативен хранителен статус и намалява продължителността на хоспитализацията. Дефицитът на витамин В12 и желязо са често срещани метаболитни последствия след гастректомия и налагат подходящо заместване. При недохранени пациенти с напреднал GC, краткосрочното допълващо домашно парентерално хранене подобрява качеството на живот, хранителния статус и функционалния статус. Общото домашно парентерално хранене представлява единственият начин на прием на калории за пациенти с напреднал ГХ, които не могат да приемат орално или ентерално хранене
Практически последици
Ранните оценки на хранителния статус и хранителната подкрепа представляват ключови аспекти при лечението на пациенти с GC както с оперативно, така и с напреднало заболяване.
Въведение
Въпреки намаляващата честота през последните няколко десетилетия, ракът на стомаха (GC) остава петата най-често срещана злокачествена болест в света и третата водеща причина за смъртност от рак и при двата пола в света [1]. GC често е безсимптомна или може да причини само неспецифични симптоми в ранните си етапи, което е една от основните причини за често отлаганата диагноза [2] и относително лошата прогноза [3].
Загуба на тегло се съобщава за 31-87% от пациентите при първа диагноза злокачествено заболяване, а обхватът на загуба на тегло зависи пряко от вида на рака [4]. По-специално, загуба на тегло> 10% през предходните 6 месеца се наблюдава при 15% от пациентите с диагноза рак на гастроезофагеал, докато недохранването се наблюдава при до 80% от пациентите с ГХ в напреднал стадий [5,6].
Синдромът на анорексия-кахексия [7,8], често описан при пациенти с напреднал рак, се характеризира с намален прием на храна, хипоалбуминемия, загуба на тегло и загуба на мускулна тъкан и е свързан с повишена заболеваемост и смъртност [9,10,11]. При пациенти с GC това състояние се причинява главно от запушване на горната част на храносмилателния тракт поради механичните ефекти на тумора [12]. Може да последват дисфагия, ранно засищане, гадене и повръщане. При пациентите с GC синдромът на анорексия-кахексия е свързан със съкратена обща преживяемост [13]. Заедно със симптоми като гадене, повръщане, ранно засищане и дисфагия след химиотерапия, лъчетерапия или операция, това състояние може да допринесе за недохранване, свързано с рака [14,15,16]. По този начин идентифицирането и лечението на недохранването в началото на GC е от решаващо значение за подобряване на резултатите от пациентите.
Хранително лечение
Оценка на хранителния статус
Трябва да се извърши оценка на хранителния статус, приема на храна и тежестта на заболяването, като се започне с първи контакт редовно и през кратки интервали от време (поне на всеки 4-8 седмици), за да се разпознае всяко намаляване на хранителния статус възможно най-рано [17]. Разработени са няколко въпросника за ранно откриване и лечение на недохранени болнични пациенти [21,22]. По-специално, повишените резултати от инструмента за скрининг на хранителен риск 2002 (NRS 2002) са свързани с повишен процент на следоперативни усложнения и увеличена продължителност на престоя [23]. Освен това, в скорошно проучване, оценяващо ефикасността на въпросника за кратка хранителна оценка (SNAQ) при прогнозиране на риска от следоперативна смъртност след операция на GC, SNAQ резултат ≥1 е свързан с повишена смъртност в сравнение със SNAQ резултат 0 (OR = 5,1; 95% CI: 1,01-23,8) [24].
В скорошно ретроспективно проучване върху 775 пациенти, претърпели гастректомия за GC, индексът на телесна маса (ИТМ) сам по себе си не повлиява периоперативната заболеваемост или без рецидиви или общата преживяемост [25]. Въпреки това, пациенти с ИТМ 3 седмици [36]. Наскоро рандомизирано контролирано проучване (RCT) върху 106 пациенти, подложени на гастректомия за GC, показа, че предоперативната ЕН подобрява следоперативния хранителен статус, облекчава възпалителния отговор и улеснява възстановяването на пациентите [37]. Хранителна подкрепа чрез PN може да се наложи при пациенти с нефункционален или недостъпен стомашно-чревен тракт [38].
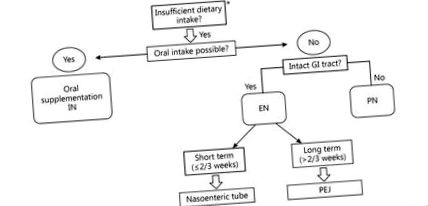
Перорално или ентерално приложение на хранителен разтвор, обогатен с имуностимулиращи хранителни вещества (аргинин, ω-3 мастни киселини и нуклеотиди) се нарича имунонутриция (IN) [39]. В неотдавнашен мета-анализ на 9 проучвания е оценено имунологичното въздействие на ентералното IN при пациенти, подложени на операция за GC [40]. В сравнение със стандартния EN, IN повишава имунитета на гостоприемника чрез повишаване на нивото на имуноглобулини, Т-хелперни клетки 17 и естествени клетки убийци и намаляване на нивото на възпалителни цитокини като IL-6 и TNF-α. Друг мета-анализ, базиран на 21 RCTs, сравнява периоперативния IN със стандартен EN при пациенти, подложени на голяма планова стомашно-чревна операция. Периоперативният IN значително намалява общите усложнения и престоя в болница, но не и смъртността [41]. Съответно, насоките ESPEN, германските насоки S3 [17] за GC и Северноамериканската среща за хирургично хранене [42] препоръчват орално/ентерално IN за пациенти с рак на горната част на стомашно-чревния тракт 5-7 дни преди операцията и през следоперативния период. Фигура Фигура 1 1 показва алгоритъм за пътя на доставка на периоперативно хранене при пациенти, подложени на операция за GC.
Алгоритъм за вземане на решение за пътя на доставка на периоперативно хранене при пациенти, подложени на операция за GC. * Перорален прием на храна 3+) в по-абсорбиращата се железна форма (Fe 2+) [55]. Реконструкцията след гастректомия може да намали абсорбцията на желязо поради байпас на основните места на абсорбция на желязо: дванадесетопръстника и проксималната йеюнум.
В ретроспективно проучване върху 119 пациенти, претърпели дистална гастректомия с реконструкции на Billroth I или Roux-en-Y за етап I GC, еднофакторни и многовариантни анализи показват, че реконструкцията на Roux-en-Y е единственият рисков фактор (p = 0,0487; ИЛИ = 2.755; 95% CI: 1.01-7.91) за намаляване на хемоглобина [56]. Съобщава се и за по-висока честота на анемия и дефицит на желязо след пълна гастректомия в сравнение с субтотална гастректомия [57].
Лечението на желязодефицитна анемия след гастректомия изисква коригиране на дефицита в циркулиращия хемоглобин, попълване на дефицита на съхранение и корекция на всеки лечим източник на анормална загуба на кръв. Също така, профилактичното лечение на очаквания дефицит с прости препарати, под формата на железен сулфат или глюконат, обикновено е ефективно [17].
Предполага се панкреатична недостатъчност като възможна причина за малабсорбция след пълна гастректомия [64]. Въпреки че панкреатичната екзокринна недостатъчност е доказана след гастректомия, ключовият въпрос остава дали добавките на панкреатичните ензими могат да подобрят клиничния резултат на пациентите с GC. В проспективно, двойно-сляпо, рандомизирано, паралелно, плацебо контролирано многоцентрово проучване, добавката на панкреатични ензими не доведе до значителна разлика между плацебо и ензимно-третирана група по отношение на чревните навици или малсимилацията на мазнините [65]. Ефектът от добавянето на високи дози на панкреатичния ензим върху симптомите и стеатореята след пълна гастректомия е незначителен и не оправдава рутинната употреба. В обобщение може да се посочи следното:
Анемията се развива при 50% от пациентите, претърпели тотална гастректомия
Малабсорбцията на хранително желязо поради намаляване на секрецията на стомашна киселина и байпас на дванадесетопръстника е основната причина за анемия след гастректомия
Лечението на желязодефицитна анемия изисква коригиране на дефицита в циркулиращия хемоглобин, попълване на дефицита на съхранение и коригиране на всеки лечим източник на анормална загуба на кръв
Недостигът на витамин В12 може да се развие още 1 година след пълната гастректомия
Настоящите насоки препоръчват добавки с витамин В12 след гастректомия
Ефектът от добавянето на високи дози панкреатични ензими върху симптомите и стеатореята след пълна гастректомия е незначителен и не оправдава рутинната употреба
Хранене при пациенти с напреднал GC
Винаги, когато е посочена хранителна подкрепа, оралният и ентералният път са за предпочитане пред парентералния. При пациенти с GC със стеноза на кардия или пилорус, поставянето на стент може да позволи орално хранене, подобрявайки качеството на живот. Насоките на Европейското общество за клинично хранене и метаболизъм препоръчват прилагането на PN, когато „може да се очаква неадекватен прием на храна под 60% от очаквания енергиен прием за повече от десет дни“ [19]. За пациенти на химиотерапия, изпитващи свързани с химиотерапията нежелани реакции от страна на стомашно-чревния тракт (т.е. анорексия, гадене, повръщане, запек и диария), се препоръчва допълнителна HPN за стабилизиране на теглото и продължаване на терапията [17]. Освен това, въз основа на нашия опит, краткосрочно допълващи се HPN могат да се предоставят безопасно и ефективно на пациенти със загуба на тегло въпреки адекватен прием през устата или перорално добавяне (т.е. ракова кахексия), както и в случаи на непоносимост към EN (т.е. диария).
За пациенти с перитонеална карциноза и тежко увреждане на стомашно-чревната функция, общата HPN е задължителна [15]. Синдромът на късото черво, дължащ се на обширна хирургическа интервенция, е друго показание за HPN [66]. Успехът на PN зависи от спазването на пациента, подкрепата от професионален и отдаден диетолог и сътрудничеството между пациента, диетолога, лекаря и доставчика на домашни грижи [67]. В многобройни проучвания PN не успява да намали токсичността на химиотерапията [68] и да подобри степента на отговор [69]. Особено за пациенти с напреднал GC и за тези, които не са недохранени или хипофагични, рисковете от PN могат да надвишат ползите [70]. От друга страна, при пациенти с напреднал рак и с умерено до тежко недохранване HPN подобрява качеството на живот, хранителния статус и функционалния статус, независимо от вида на тумора [71]. Най-голяма полза се наблюдава при пациенти с 3 месеца допълнителна HPN, въпреки че пациентите, получаващи HPN в продължение на 1 или 2 месеца, също показват значителни подобрения. В обобщение може да се посочи следното:
За пациенти с напреднал GC, които не могат да приемат орално хранене или EN, общата HPN е задължителна
При пациенти с напреднал GC, които не са недохранени или хипофагични, рисковете от PN могат да надвишат ползите
При недохранени пациенти с напреднал рак, краткосрочната допълваща HPN е свързана с подобряване на качеството на живот, хранителния статус и функционалния статус
Упътвания за бъдещето
Съвременната терапия на пациенти с локализиран GC, подходящ за операция, включва неоадювантна радиохимиотерапия и периоперативна химиотерапия, които представляват източници на катаболен стрес и недохранване. Ролята на хранителната подкрепа по време на неоадювантно/периоперативно лечение на пациенти с GC все още предстои да бъде определена. Понастоящем в Европа контролирано проучване фаза III тества дали IN може да подобри качеството на живот на пациенти, лекувани с неоадювантна радиохимиотерапия и периоперативна химиотерапия за рак на хранопровода (> NCT01423799).
- Хранене за пациенти с рак на яйчниците Здравословни храни и добавки в ежедневното диетично здраве
- Хранене за пациенти с рак на гърдата и оцелели Център за гърди Джон Хопкинс
- Хранене при пациенти с рак на стомаха Актуализация - FullText - Стомашно-чревни тумори 2015, Vol
- Хранителни съвети за пациенти с рак на костите - Център за рак на костите
- Хранене Хюстън, Кингвуд, Тексас Здравословна диета за пациенти с рак Пролет, Горските земи, Тексас