Излишъкът от инсулин и хипоксия, връзки със затлъстяването и диабет тип 2
Корейски ресурсен център, Ellicott City, MD, САЩ
Тексаски университет, Училище за медицински сестри, Остин, Тексас, САЩ
Тексаски университет, Училище за медицински сестри, Остин, Тексас, САЩ
Резюме
Ключови думи
излишък от инсулин, хипоксия, затлъстяване, диабет тип 2, гликиране
Въведение
Затлъстяването, пандемия в САЩ [1], продължава да се влошава. През 2013–2014 г. повече от една трета от възрастните американци (37,7%) са били със затлъстяване, с индекс на телесна маса (ИТМ) ≥30. Тази цифра представлява увеличение от 7,2% в периода 1999–2000 г., приблизително еквивалентно на 16 милиона души. През същия период в САЩ разпространението на заболелите от затлъстяване (ИТМ ≥40) се е увеличило от 4,7% на 7,7% през 2013–2014 г., което представлява 6,7 милиона. Може би не е изненадващо, че бариатричната хирургия е нараснала от 158 000 случая през 2011 г. до 216 000 през 2016 г. [2].
Затлъстяването, натрупването на излишни телесни мазнини, е свързано с много хронични състояния или заболявания като причина за съпътстващи заболявания, които включват астма [3], диабет тип 2 [4,5], ревматоиден артрит [6], сърдечно-съдови заболявания [7, 8], рак [9], депресия [10,11] и деменция [12,13]. Средно човек със затлъстяване е направил 3429 щатски долара повече разходи за здравеопазване (през 2013 г. в долари) от 2006 до 2013 г., отколкото човек, който не е със затлъстяване [14]. Освен това социалните разходи за затлъстяването са неизчислени.
Добре известно е, че инсулинът регулира усвояването на хранителни вещества (глюкоза, мастни киселини и аминокиселини) [17]. Освен това, концентрацията на инсулин модулира чернодробната липогенеза при мишки [18], което показва, че излишъкът от инсулин може да доведе до затлъстяване. Независимо от това, инсулинът се счита за несъществен за затлъстяването [19], с индуцирана от затлъстяване инсулинова резистентност, водеща до диабет тип 2 [20,21], или просто като част от непрекъсната, едновременна прогресия заедно със затлъстяването. Във въглехидратно-инсулиновия модел на затлъстяването [22], който идентифицира инсулина като причина за затлъстяването, инсулиновата резистентност работи селективно, за да накара неадипоцитите да умрат от глад, а адипоцитите да затлъстяват едновременно [23]. В тази статия представяме поредица от анализи на национален набор от данни, за да демонстрираме посредническата роля на инсулина и кислорода при затлъстяване. Също така обсъждаме последиците и приложимостта на тези знания за предотвратяване и управление на затлъстяването и свързаните със затлъстяването хронични състояния.
Методи
Теоретична рамка
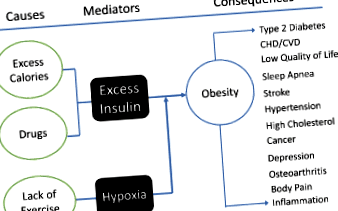
Предполагаме, че свързващите механизми между причините, идентифицирани от ICD-10 (напр. Излишните калории и лекарства) и затлъстяването са два медиатора: (а) излишък на инсулин и (б) хипоксия. Тези медиатори са катализатори за превръщането на хранителните вещества в енергия чрез клетъчно дишане. Фигура 1 схематично изобразява тази връзка.
Фигура 1. Теоретична рамка на затлъстяването, при която излишъкът от инсулин и хипоксия медиират лични фактори (излишни калории, лекарства и заседнал начин на живот) за затлъстяването, което от своя страна води до други физически и/или психични проблеми. Тъй като затлъстяването е непрекъснат процес, може да има цикъл за обратна връзка, който може да подсили/ускори процеса, но ефектите от обратната връзка могат да бъдат незначителни.
Инсулинът като пазител
Гръбначният инсулин е пептиден хормон, секретиран от бета клетки на панкреаса. Инсулинът има 51 аминокиселинни остатъка в две вериги; молекулярните структури на гръбначните инсулини са толкова сходни, че са клинично заменяеми [24]. Простата структура и универсалната функция на инсулина показват, че той се е развил, за да изпълнява специфична и съществена функция - да съхранява хранителни вещества [25]. Освен това инсулинът е структурно и функционално стабилен срещу мутации; само три случая на глупости мутантни човешки инсулин са докладвани от 60-те години на миналия век [26,27].
Тъй като инсулинът е толкова мощен хормон, той е строго контролиран и регулиран. Инсулиновата секреция се влияе от плазмената глюкоза, която от своя страна се влияе от приема на храна, вегетативния циркаден ритъм, неврологични реакции като памет или физиологични състояния като остри и хронични заболявания или упражнения [28-30]. Когато глюкозата навлезе в порталната вена, панкреасните бета клетки секретират и освобождават инсулин в кръвта почти веднага. Механизмите на панкреаса за усещане на глюкоза при месоядни и нежадни са фундаментално сходни [31]. Сензорът за глюкоза на панкреаса открива нивото на глюкозата, което съответно предизвиква каскада от секреция на инсулин в порталната вена [32]. Освен това, тъй като рецепторите, чувствителни на мазнини, съществуват в бета-клетките на панкреаса [33], секрецията се увеличава в присъствието на мастни киселини и евентуално други хранителни вещества (например аминокиселини, триглицериди). Следователно е разумно да се приеме, че количеството плазмен инсулин е пропорционално на това на плазмените хранителни вещества, които включват не само глюкоза, но и мастни киселини и евентуално аминокиселини.
Плазмените хранителни вещества трябва да се прехвърлят възможно най-бързо от кръвния поток и интерстициалното пространство към вътреклетъчното пространство; бързата обработка може да бъде задължителна, за да се намалят шансовете за гликиране [34,35]. Чрез действието на инсулина те се съхраняват в три различни типа клетки за различни периоди от време: (а) адипоцити, в продължение на дни или месеци; б) хепатоцити за няколко часа; (в) всички останали клетки, за няколко минути. Точният механизъм на разпределяне на хранителните вещества в трите отделения за съхранение е неизвестен, но могат да участват фактори, включително анаболния капацитет на хепатоцитите (напр. Гликогенеза и липогенеза), излишните хранителни вещества и енергийните нужди на клетката. Тъй като инсулинът увеличава вътреклетъчното усвояване на глюкоза и мастни киселини чрез увеличаване на броя на транспортерите на глюкоза (например GLUT4) [36] и транспортерите на мастни киселини [37], всички хранителни вещества (глюкоза, мастни киселини и евентуално аминокиселини) се съхраняват независимо на клетъчните типове.
Ако излишните хранителни вещества навлязат в порталната вена, излишните хранителни вещества преминават през черния дроб, за да се освободят директно в кръвния поток, като същевременно допълнително увеличават секрецията на инсулин. Чрез засиленото действие на инсулина, повече хранителни вещества навлизат във вътреклетъчните отделения, вероятно заедно с инсулина и инсулиновия рецепторен комплекс [38].
Хипоксия в дишането на клетките
След като хранителните вещества се преместят в клетки, различни от адипоцити или хепатоцити, те не могат да се върнат в междуклетъчното пространство или кръвния поток. Кислородът е толкова важен за клетъчното дишане, че той трябва непрекъснато да се доставя. Ако доставката на кислород спре за няколко минути, започва разрушаването на клетките (т.е. смъртта). Живите организми не носят допълнителни резервоари за кислород, тъй като кислородът е изобилен и повсеместен. Но вездесъщото изобилие от кислород не означава, че той е по-малко значим от излишните хранителни вещества за затлъстяването, за което храните са оскъдни и спорадични. Въздействието на хипоксия или хипероксия може да бъде смъртоносно и непосредствено.
Няколко фактора влияят върху доставката на кислород в клетките, включително концентрацията на O2 и CO2, киселинността в плазмата и температурата [39]. Освен дисфункции на дихателната система (напр. Алвеоларна хиповентилация), здравето на хемоглобина е от решаващо значение, тъй като хемоглобинът пренася кислород до тъканите. Ако плазмената глюкоза е прикрепена към хемоглобина (т.е. гликирана), засегнатият хемоглобин вече не е в състояние да движи кислород поради афинитета на глюкозата към кислорода: той задържа кислорода в съда на желязото (Fe) завинаги и уловеният кислород не се освобождава, независимо от концентрацията на CO2. Следователно доставката на кислород е обратно пропорционална на гликирания хемоглобин (т.е. хемоглобин А1с или накратко А1С), тъй като скоростта на гликиране е постоянна във времето [40]. Колкото по-висок е A1C, толкова по-малко кислород се доставя до клетките, което води до фактическа хипоксия.
Молекулата на глюкозата навлиза в гликолиза, която генерира 2 молекули аденозин трифосфат (АТФ) и 2 пирувата и този процес не изисква кислород в цитозола. Пируватът навлиза в митохондриите в цикъла на лимонената киселина (т.е. дишането на клетките), когато кислородът е достатъчен. Мастните киселини преминават през по-сложния процес, за да станат ацетил коензим А (ацетил-КоА) чрез бета окисление, за да влязат в цикъла на лимонената киселина [41], който изисква повече кислород.
При хипоксично състояние, когато енергийното търсене е ниско, излишъкът от ацетил-КоА се връща обратно в липогенезата, за да синтезира триглицериди [42], което е най-вероятно да увеличи клетъчния обем и тегло. Когато търсенето на енергия се увеличи, пируватът преминава през млечнокисела ферментация. Този процес не само генерира по-малко енергия, но също така произвежда млечни киселини, смъртоносна комбинация, която води до няколко проблема: „(а) колапс на градиентите Na + и K +, (б) деполяризация на мембраните, (в) клетъчно поемане на Cl -, (г) клетъчно подуване, (д) повишена цитозолна концентрация на Са2 + и накрая, (е) намалено цитозолно рН, което води до вътреклетъчна ацидоза в туморни клетки “[43, с. 267].
Избор и анализ на проби
- Ферментиралото соево мляко, приготвено с помощта на кефирни зърна, предотвратява и подобрява затлъстяването, диабет тип 2,
- Диабетна кетоацидоза при човек със захарен диабет тип 1, лекуван с инсулинова помпа, докато
- Оценка на DOK5 като ген за чувствителност към диабет тип 2 и затлъстяване в Северна Индия
- Продължителност на коремното затлъстяване, започващо при диабет в млада възраст и инцидент през средната възраст
- Дуоденум, храносмилане и диабет тип II