Резюме
Заден план
Астроцитомите до голяма степен зависят от гликолизата, за да задоволят своите биоенергийни изисквания за растеж и оцеляване. Терапиите, насочени към гликолиза, могат потенциално да управляват растежа и прогресията на астроцитома. Диетичното ограничение на кетогенната диета с високо съдържание на мазнини/ниско съдържание на въглехидрати (KD-R) намалява гликолизата и е ефективно при управлението на експериментални миши и човешки астроцитоми. Неметаболизиращият се глюкозен аналог, 2-дезокси-D-глюкоза (2-DG), е мощен гликолитичен инхибитор, който може да имитира ефекта на ограничаване на енергията както инвитро и in vivo, но може да доведе и до неблагоприятни ефекти, когато се прилага в дози над 200 mg/kg. Целта тук беше да се определи дали ниските дози 2-DG могат да действат синергично с KD-R за по-добро управление на растежа на CT-2A злокачествен миши астроцитом.
Методи
Терапевтичният ефект на KD-R, допълнен с ниска доза 2-DG (25 mg/kg), беше изследван при възрастни мишки C57BL/6J, носещи сингеничен CT-2A злокачествен астроцитом, отглеждан ортотопно. Мишките бяха хранени със стандартната неограничена диета през първите 3 дни след имплантирането на тумор преди отделянето им в една от четирите диетични групи, хранени или със стандартна диета за гризачи в неограничени количества (SD-UR), или с KD-R със или без 2-DG за 10 дни. KD-R беше ограничен за намаляване на телесното тегло с около 20%. 2-DG е започнат 6 дни след туморната имплантация и е продължен 7 дни. Мозъчните тумори бяха изрязани и претеглени.
Резултати
Енергийният прием, телесното тегло и теглото на CT-2A тумори са сходни в групите мишки SD-UR и SD-UR + 2-2DG през периода на диетично лечение (дни 3-13). Теглото на тумора е било с около 48% и 80% по-ниско в KD-R и в KD-R + 2-DG групите, съответно, отколкото в SD-UR групата. Здравето и жизнеността на мишките бяха по-добри в групата KD-R, отколкото в групата KD-R + 2-DG.
Заключение
Растежът на астроцитома е намален повече в групата на мишките KD-R, допълнена с 2-DG, отколкото в групите мишки, получаващи диетични ограничения или самостоятелно 2-DG, което показва синергично взаимодействие между лекарството и диетата. Резултатите показват, че управлението на злокачествен астроцитом с ограничени кетогенни диети може да бъде подобрено, когато се комбинира с лекарства, които инхибират гликолизата.
Заден план
Злокачествените астроцитоми представляват водеща причина за смърт, свързана с рак [1–4]. Невъзможността за ефективно управление на тези тумори се дължи отчасти на уникалната анатомична и метаболитна среда на мозъка, която предотвратява пълната резекция на туморната тъкан и възпрепятства доставката на терапевтични агенти [5]. За разлика от нормалните мозъчни клетки, които могат да метаболизират както глюкоза, така и кетонни тела за енергия, мозъчните тумори имат намален капацитет да метаболизират кетонни тела и, подобно на повечето злокачествени тумори, силно зависят от гликолизата за своята метаболитна енергия според теорията на рака на Варбург 6–9]. Следователно терапиите, които могат да използват разликите в енергийния метаболизъм между нормалните мозъчни клетки и мозъчните туморни клетки, трябва да бъдат ефективни за управление на тумори [5, 6, 9].
Мишки и експериментален астроцитом
Мишки от щама C57BL/6J (B6) са получени от лабораторията Jackson (Bar Harbor, ME, САЩ) и са размножавани в Бостънския колеж за грижа за животните, както е описано по-горе [30]. Възрастни мъжки мишки (
14-седмична възраст) бяха използвани в това проучване и бяха настанени индивидуално в пластмасови клетки с филтърни плотове, съдържащи постелки Sani-Chip (P.J. Murphy Forest Products Corp., Montville, NJ, USA). Сингенният злокачествен миши астроцитом е имплантиран в мозъчната кора, както е описано по-рано [31]. Процедурите за използване на животни бяха в стриктно спазване на Ръководството на NIH за грижа и използване на лабораторни животни и бяха одобрени от Институционалния комитет за грижа за животните в Бостънския колеж. Други условия на отглеждане бяха както описаните по-рано [30].
Диетични режими, измервания на телесното тегло и приема на храна
В проучването са използвани два вида диетични режими: стандартната PROLAB RMH 3000 чау диета (SD) (Lab Diet, Richmond, IN, USA) и кетогенна диета на основата на свинска мас (KD) (Zeigler Bros., Inc., Gardners, Пенсилвания, САЩ). Всички мишки са получили PROLAB RMH 3000 чау преди имплантиране на тумор. SD съдържа баланс от хранителни съставки на мишки и доставя 4,1 kcal g -1 брутна енергия, където мазнините, въглехидратите, протеините и фибрите представляват съответно 55, 520, 225 и 45 g kg -1 от диетата. KD също съдържа баланс между хранителни съставки на мишки. Според спецификацията на производителя KD доставя 7,8 kcal g -1 брутна енергия, където мазнините, въглехидратите, протеините и фибрите съставляват съответно 700, 0, 128 и 109 g kg -1 от диетата. Мазнините в тази диета се получават от свинска мас и диетата има кетогенно съотношение (мазнини: протеини + въглехидрати) от 5,48: 1. Телесното тегло и приема на храна на всички мишки се записват ежедневно (13:00 - 15:00). Вода беше осигурена ad libitum за всички мишки.
Всички мишки бяха хранени със стандартната диета без ограничения през първите 3 дни след имплантиране на тумор. След това те бяха разделени в една от четирите диетични групи, хранени или със стандартна диета в неограничени количества (SD-UR), или с KD-R със или без 2-DG (25 mg/kg) в продължение на 10 дни. Четирите групи бяха съпоставени по телесно тегло (
28,8 g) преди започване на диетичните режими. Лечението с ниски дози с 2-DG е започнато 6 дни след имплантиране на тумор и е продължено 7 дни (Фиг. 1В и Фиг. 1С). Парадигмите за хранене за групите KD-R и KD-R + 2-DG са проектирани да намалят телесното тегло на мишката чрез
20% спрямо стойностите, записани преди започване на диетите (3 дни след имплантиране на тумор). Всички мишки бяха евтаназирани 13 дни след имплантиране на тумор.
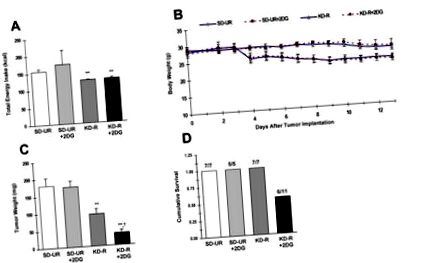
Влияние на ограничената кетогенна диета със или без 2-DG върху общия енергиен прием (A), телесното тегло (B), растежа на тумора (C) и върху кумулативната преживяемост (D) при мишки, носещи ортотопно имплантирания CT-2A злокачествен астроцитом. Всички мишки бяха хранени със стандартната диета с високо съдържание на въглехидрати в UR през първите 3 дни след имплантирането на тумора преди разделянето им в една от четирите диетични групи (n = 5-11 мишки/група), хранени или с SD-UR, или с KD- R със или без 2-DG (25 mg/kg) за 10 дни. Четирите групи бяха съпоставени по телесно тегло. 2-DG е започнат 6 дни след туморната имплантация и е продължен 7 дни (Б. &° С). Както е показано в (Б.), парадигмата за хранене за групите KD-R и KD-R + 2-DG е проектирана да намали телесното тегло чрез
Резултати и дискусия
Общият енергиен прием е бил сходен през периода на диетично лечение (между 3 и 13 дни след имплантиране на тумор) в групите SD-UR + 2-DG и SD-UR, но е забелязана по-голяма вариабилност в групата SD-UR + 2-DG (Фигура 1А). Приемът на енергия е сходен между групите KD-R и KD-R + 2-DG през периода на диетично лечение. Теглото на тялото е намалено до подобна степен (
20%) в двете групи, хранени с KD-R (фиг. 1А и фиг. 1В). Преди това показахме, че съвпадението на телесното тегло в контролните и лечебните групи е абсолютно критично за правилната интерпретация на данните [13, 18]. В настоящото проучване установихме, че прилагането на ниска доза 2-DG няма значително влияние нито върху телесното тегло, нито върху растежа на тумора CT-2A при мишки, хранени със SD-UR (фиг. 1В и фиг. 1С). Тези резултати контрастират с тези на Zhu et al., Които показват, че прилагането на ниска доза 2-DG при неограничена стандартна диета с високо съдържание на въглехидрати може да намали растежа на тумора на млечната жлеза при плъхове [21]. Разликите в резултатите между двете проучвания могат да се отдадат на различните използвани видове гризачи, начина на доставяне на лекарството или местоположението на тумора (мозък срещу подкожен фланг).
Заключение
Нашите открития предоставят нови доказателства, че KD-R, допълнен с ниска доза 2-DG, е ефективен за намаляване на интрацеребралния растеж на тумора в по-голяма степен, отколкото е било приложено самостоятелно 2-DG или KD-R, което предполага синергично взаимодействие между лекарството и диетата. Въпреки че здравето и жизнеността не бяха толкова силни в групата на лекарството/диетата, отколкото в групата на KD-R, корекциите в концентрацията на 2-DG или в диетичните ограничения могат да смекчат вредните последици за здравето. Нашите резултати показват, че комбинирането на лекарства, които инхибират гликолизата с ограничени кетогенни диети, може да засили инхибирането на растежа на злокачествен астроцитом.
Препратки
Nicholson HS, Kretschmar CS, Krailo M, Bernstein M, Kadota R, Fort D, Friedman H, Harris MB, Tedeschi-Blok N, Mazewski C, Sato J, Reaman GH: Изследване на фаза 2 на темозоломид при деца и юноши с повтарящи се тумори на централната нервна система: доклад от Детската онкологична група. Рак 2007 г., 110: 1542-1550.
Lowry JK, Snyder JJ, Lowry PW: Мозъчни тумори при възрастни хора: последните тенденции в кохортното проучване в Минесота. Арх Неврол 1998 г., 55: 922-928.
Fisher PG, Buffler PA: Злокачествени глиоми през 2005 г.: къде да отидем оттук? Джама 2005 г., 293: 615-617.
Jukich PJ, McCarthy BJ, Surawicz TS, Freels S, Davis FG: Тенденции в честотата на първичните мозъчни тумори в САЩ, 1985–1994. Невро-онкол 2001 г., 3: 141-151.
Marsh J, Mukherjee P, Seyfried TN: Akt-зависими проапоптотични ефекти на диетичните ограничения върху управлението на късен стадий на астроцитом с дефицит на PTEN/TSC2. Clin Cancer Res 2008 г.,14.(23): 7751-7762.
Kiebish MA, Han X, Cheng H, Chuang JH, Seyfried TN: Аномалии на кардиолипин и електронна транспортна верига в митохондрии на мозъчен тумор на мишка: Липидомични доказателства, подкрепящи теорията на Варбург за рака. J Lipid Res 2008 г.
Warburg O: Метаболизмът на туморите. Редактиран от: . Ню Йорк, Ричард Р Смит; 1931 г.
Warburg O: Относно произхода на раковите клетки. Наука 1956 г., 123: 309-314.
Seyfried TN, Mukherjee P: Насочване на енергийния метаболизъм при рак на мозъка: преглед и хипотеза. Nutr Metab (Лонд) 2005 г., 2: 30.
Freeman JM, Kossoff EH, Freeman JB, Kelly MT: Кетогенната диета: лечение за деца и други с епилепсия. Четвърто издание. Ню Йорк, Demos; 2007 г.
Veech RL: Терапевтичните последици от кетонните тела: ефектите от кетонните тела при патологични състояния: кетоза, кетогенна диета, редокс състояния, инсулинова резистентност и митохондриален метаболизъм. Простагландини Leukot Essent мастни киселини 2004 г., 70: 309-319.
Prins ML: Церебрална метаболитна адаптация и метаболизъм на кетони след мозъчна травма. J Cereb Blood Flow Metab 2008 г., 28: 1-16.
Mantis JG, Centeno NA, Todorova MT, McGowan R, Seyfried TN: Управление на многофакторна идиопатична епилепсия при EL мишки с калорично ограничение и кетогенна диета: роля на глюкозата и кетонните тела. Nutr Metab (Лонд) 2004 г., 1: 11.
Hartman AL, Vining EP: Клинични аспекти на кетогенната диета. Епилепсия 2007 г., 48: 31-42.
Seyfried TN, Sanderson TM, El-Abbadi MM, McGowan R, Mukherjee P: Роля на глюкозните и кетонните тела в метаболитния контрол на експерименталния рак на мозъка. Br J Рак 2003 г., 89: 1375-1382.
Yamada KA, Rensing N, Thio LL: Кетогенната диета намалява причинената от хипогликемия невронална смърт при млади плъхове. Neurosci Lett 2005 г., 385: 210-214.
Gasior M, Rogawski MA, Hartman AL: Невропротективни и модифициращи заболяването ефекти на кетогенната диета. Behav Pharmacol 2006 г., 17: 431-439.
Zhou W, Mukherjee P, Kiebish MA, Markis WT, Mantis JG, Seyfried TN: Калорично ограничената кетогенна диета, ефективна алтернативна терапия за злокачествен рак на мозъка. Nutr Metab (Лонд) 2007 г., 4: 5.
Greene AE, Todorova MT, Seyfried TN: Перспективи за метаболитно управление на епилепсия чрез диетично намаляване на глюкозата и повишаване на кетонните тела. J Neurochem 2003 г., 86: 529-537.
Nebeling LC, Miraldi F, Shurin SB, Lerner E: Ефекти на кетогенната диета върху туморния метаболизъм и хранителния статус при педиатрични онкологични пациенти: два случая. J Am Coll Nutr 1995 г., 14: 202-208.
Zhu Z, Jiang W, McGinley JN, Thompson HJ: 2-дезоксиглюкоза като миметичен агент за ограничаване на енергията: ефекти върху канцерогенезата на млечната жлеза и върху растежа на туморните клетки на млечната жлеза in vitro. Изследване на рака 2005 г., 65: 7023-7030.
Зад RL, Zhang FW, Gius D: Оценка на 2-дезокси-D-глюкозата като химиотерапевтично средство: механизъм на клетъчна смърт. Br J Рак 2002 г., 87: 805-812.
Singh D, Banerji AK, Dwarakanath BS, Tripathi RP, Gupta JP, Mathew TL, Ravindranath T, Jain V: Оптимизиране на лъчетерапията на рака с проучвания за повишаване на дозата на 2-дезокси-d-глюкоза при пациенти с мултиформен глиобластом. Strahlenther Onkol 2005 г., 181: 507-514.
Lin X, Zhang F, Bradbury CM, Kaushal A, Li L, Spitz DR, Aft RL, Gius D: Индуцираната от 2-дезокси-D-глюкоза цитотоксичност и радиосенсибилизация в туморните клетки се медиират чрез нарушения в метаболизма на тиола. Рак Res 2003 г., 63: 3413-3417.
Laszio J, Humphreys SR, Goldin A: Ефекти на аналозите на глюкозата (2-дезокси-D-глюкоза, 2-дезокси-D-галактоза) върху експериментални тумори. J Natl Cancer Inst 1960 г., 24: 267-281.
Kang HT, Hwang ES: 2-дезоксиглюкоза: противораково и антивирусно терапевтично средство, но вече не е миметик с ниско ниво на глюкоза. Life Sci 2006 г., 78: 1392-1399.
Dills WL Jr, Kwong E, Covey TR, Nesheim MC: Ефекти на диети с недостиг на глюкоза и предшественици на глюкозата върху растежа на карциносаркома на Walker 256 при плъхове. J Nutr 1984 г., 114: 2097-2106.
Cay O, Radnell M, Jeppsson B, Ahren B, Bengmark S: Инхибиращ ефект на 2-дезокси-D-глюкозата върху растежа на чернодробния тумор при плъхове. Рак Res 1992 г., 52: 5794-5796.
Landau BR, Laszlo J, Stengle J, Burk D: Определени метаболитни и фармакологични ефекти при пациенти с рак, получаващи инфузии на 2-дезокси-D-глюкоза. J Natl Cancer Inst 1958 г., 21: 485-494.
Flavin HJ, Wieraszko A, Seyfried TN: Подобрено освобождаване на аспартат от хипокампални филийки епилептични (El) мишки. J Neurochem 1991 г., 56: 1007-1011.
Seyfried TN, el-Abbadi M, Roy ML: Разпределение на ганглиозидите при миши невронни тумори. Mol Chem Neuropathol 1992 г., 17: 147-167.
Seyfried TN, Mukherjee P: Антиангиогенни и проапоптотични ефекти на диетичните ограничения при експериментален рак на мозъка: Роля на глюкозните и кетонните тела. В Интеграция/взаимодействие на онкологичния растеж. Рак и прогресия на рака. Том 15. Редактиран от: Meadows GG. Ню Йорк: Kluwer Academic; 2005: 259-270.
Таненбаум А: Генезисът и растежът на туморите: II. Ефекти от ограничаването на калориите сами по себе си. Рак Res 1942 г., 2: 460-467.
Таненбаум А: Хранене и рак. В Физиопатология на рака. Редактиран от: Homburger F. NY: Paul B. Hober; 1959: 517-562.
Mukherjee P, Abate LE, Seyfried TN: Антиангиогенни и проапоптотични ефекти на диетичното ограничение върху експериментални миши и човешки мозъчни тумори. Clin Cancer Res 2004 г., 10: 5622-5629.
Mukherjee P, El-Abbadi MM, Kasperzyk JL, Ranes MK, Seyfried TN: Диетичните ограничения намаляват ангиогенезата и растежа в ортотопичен модел на мозъчен тумор на мишка. Br J Рак 2002 г., 86: 1615-1621.
Благодарности
Изследването е подкрепено от безвъзмездни средства от NIH (NS 055195 и CA102135) и от фонда за разходи за научни изследвания в Бостън Колидж.
Информация за автора
Принадлежности
Отдел по биология, Бостънски колеж, Chestnut Hill, MA, 02467, САЩ
Джеръми Марш, Пурна Мукерджи и Томас Н Сейфрид
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Автора за кореспонденция
Допълнителна информация
Конкуриращи се интереси
Авторите заявяват, че нямат конкуриращи се интереси.
Принос на авторите
JM проектира проучването, извърши изследването, анализира данните и изготви ръкописа; ПМ помогна за проектирането на изследването и тя също така предостави полезни коментари по време на изготвянето на този ръкопис; TNS замисли първоначалното проучване, осигури подкрепа за изследването и помогна за подготовката на ръкописа. Всички автори са прочели и одобрили окончателната версия на ръкописа.
Оригинални подадени файлове на автори за изображения
По-долу са връзките към оригиналните подадени файлове за изображения на авторите.
- CF пациенти, Храната може да бъде лекарство за управление на болестта Диетолог; s Изглед
- Диета за управление на киселинния рефлукс при деца
- Индуцираното от диетата затлъстяване повишава TNF-α на дебелото черво при мишки и е придружено от активиране на Wnt
- Куркуминът предотвратява индуцирана от диета чернодробна стеатоза при ApoE - мишки чрез подобряване на чревния тракт
- Гранични антидиабетни ефекти на тибетската медицина Tang-Kang-Fu-San при dbdb мишки чрез активиране на