1 Институт по правна медицина, Университет в Мюнхен, Nussbaumstraße 26, 80336 Мюнхен, Германия
Резюме
Ние съобщаваме за нетипичния клиничен ход на преди това здраво двегодишно момиче, което почина внезапно и неочаквано след епизод на повръщане. При съдебната аутопсия не могат да бъдат диагностицирани други патологични находки освен множество червеникави, хлътнали области в мозъчния ствол, мезенцефалона и моста. Хистологично те се представят като области на спонгиоза на невропила с изявена ендотелна хиперплазия и съдова пролиферация, докато нервните клетки са добре запазени. Въз основа на характерните невропатологични находки в комбинация с възрастта на детето, трябваше да вземем предвид, че детето може да е умряло от подостра некротизираща енцефаломиелопатия (болест на Leigh) въпреки нетипичния, фулминантно клинично протичане.
1. Въведение
Обикновено подострата некротизираща енцефаломиелопатия се проявява с клиничен ход от поне няколко месеца и впечатляващи клинични признаци. Но евентуално има документирани неочаквани смъртни случаи, които биха могли да бъдат диагностицирани като подостра некротизираща енцефалопатия само при следсмъртно изследване, ако се извърши, поради нетипична прогресия.
2. Доклад за случая
По-рано здраво 24-месечно момиче със съпътстващи страбизъм, свързано с нистагъм, беше представено в педиатрична болница. Освен това майката на момичето съобщава за неспецифични симптоми като дефицит на вниманието, намаляване на бдителността, повишена нервност и „проблеми с взаимодействието“.
При прегледа момичето е установено, че е в добро здравословно състояние с подходящо хранене. Документирано е, че физическото и психомоторното развитие са нормални. Клиничните прегледи, включително лабораторни изследвания, както и неврологично изследване с ядрено-магнитен резонанс (ЯМР), което беше извършено като предпазна мярка за изключване на вътречерепно заболяване, бяха установени като нормални. Електроенцефалографията показва слабо намаляване на бдителността, свързано с активността на остри вълни и тета ритъм. Офталмологично е диагностициран страбизъм, съпътстващ дивергенция. На детето беше позволено да се върне у дома, но се препоръчва офталмологично проследяване.
Три месеца по-късно детето започнало да повръща у дома. Накрая са извикани фелдшерите, тъй като момичето е загубило хеморагична слуз от носа си. Малко след това тя загуби съзнание и когато пристигнаха фелдшерите, тя вече беше клинично мъртва. Реанимацията беше неуспешна. Смъртта се дължи на аспирацията по време на предполагаем епилептичен припадък.
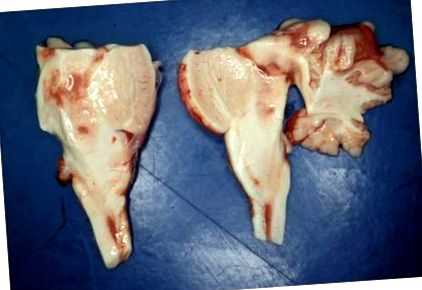
Съдебномедицинската експертиза на момичето показа малко нередности; по-специално сърцето и белите дробове са без никакви патологични находки. Лабораторните изследвания на метаболизма на глюкозата, както и химико-токсикологичните изследвания показват нормални резултати, с изключение на повишена концентрация на лактат в кръвта (47,9 mmol/l; справка: Фигура 1
След фиксацията мозъкът е изследван хистологично (хематоксилин и еозин, крезил-виолетово, Luxol-Fast-Blue, van-Gieson Elastica, PAS и пруско синьо).
m-дебели срезове бяха имунооцветени с метода ABC. За маркиране на астроцитите е използвано моноклонално антитяло срещу глиален фибриларен киселинен протеин (GFAP, разреждане 1: 100, DAKO, Германия); за микроглия беше използвано моноклонално антитяло срещу HLA-DP, DQ, DR антиген (CR 3/43, разреждане 1: 100, DAKO, Германия, предигестиране с мравчена киселина). Антигените бяха открити с комплект за пероксидаза Histostain-Plus (Zytomed, Германия).
При хистологично изследване е имало широко разпространено увреждане на хипоксично-исхемичните нервни клетки в основните лобове, зъбното ядро и клетъчния слой на Пуркине. В участъци от опашните ядра, таламус, хипоталамус, мезенцефалон, мост и продълговати мозък имаше широко разпространени огнища на спонгиоза на невропила с подчертана ендотелна хиперплазия и съдова пролиферация. Освен хипоксично-исхемичните промени, нервните клетки са относително добре запазени (Фигура 3). Имунооцветяването за GFAP разкрива изразена астроглиоза. Бялото вещество на мозъчните полукълба, хипокампалната формация, продълговатият мозък и мамиларните тела бяха незабележими.
3. Дискусия
Рядката подостра некротизираща енцефаломиелопатия е описана за първи път от Leigh [1] като клинично и етиологично силно променлив, прогресиращ синдром, наблюдаван особено при педиатричната популация, въпреки че са известни няколко случая на младежи и възрастни [2, 3].
Неспецифичните, хетерогенни и очевидно зависими от възрастта вариации в клиничните симптоми и протичане може да се отдадат на идентифициране на различни ензимни дефекти при това заболяване. Вече са открити дефекти на митохондриални, както и ядрени ДНК ензими [2, 4, 5], които определят подобни клинични течения, но се срещат на различна възраст. Клиничните симптоми също се определят от това коя област на мозъка е засегната.
Инфантилната форма обикновено започва през първите две години от живота с неспецифични симптоми и забавяне на психомоторното развитие. Други симптоми включват дефицит на вниманието, хипотония на крайниците, зрителни нарушения, включително нистагъм, лоша сила, повръщане, нежелание за ядене и загуба на тегло [2, 4, 6]. Често се развиват неврологични симптоми като атаксия, дефицити на пирамидалния тракт, апраксия и миоклонус, последвани от офталмоплегия и дихателни затруднения като признак на увреждане на мозъчния ствол [2].
Известно е, че вроденият дефицит на цитохром-с-оксидаза, дефицитът на пируват-дехидрогеназа, както и дефицитът на биотинидаза причиняват тези клинични симптоми [4, 7, 8]. Тези състояния вероятно имат автозомно-рецесивно наследство, въпреки че се обсъждат наследяването на митохондриите и майките и са известни спорадични случаи [3, 4]. Генетични нарушения могат да бъдат открити само при приблизително 50% от всички пациенти, което показва, че има много други биохимични нарушения, които могат да доведат до клиничния синдром на болестта на Leigh [8].
Все още липсват специфични биохимични тестове, но почти винаги се открива лактатна ацидоза и повишен коефициент на лактат-пируват в плазмата и ликвора [4]. Търсенето на митохондриални ДНК мутации като честа причина за болестта на Leigh и биохимичното изследване на мускулните биопсии все още остават златният стандарт в диагностиката [9, 10].
При невропатологично изследване на мозъка симетрично, макроскопски могат да бъдат идентифицирани централни лезии с червенокафяв цвят в области на мозъчния ствол, путамени, базални ганглии, таламус и заден рог на гръбначния мозък [6].
В ранен стадий невропилът се уврежда от спонгиоза, последван от капилярна пролиферация, астроглиоза и увеличен брой макрофаги. В хода на заболяването настъпва демиелинизация, която оставя нетроните и аксоните почти непокътнати. Това позволява, например, диференциация от исхемични/хипоксични лезии [1, 2, 6, 7]. По-специално се засягат мезенцефалонът, мостът, опашката, продълговатият мозък, централните черепно-мозъчни ядра, долните оливарни ядра, малкият мозък, базалните ганглии и зрителният нерв [6].
Разрушаването на мозъчната тъкан причинява прогресивна неврологична дисфункция, която редовно завършва със смърт около две години след поставяне на диагнозата поради парализа на централната дихателна система. Понастоящем не съществува лечебна терапия [3, 4, 6].
ЯМР показва симетрични, хиподензни (Т1) и хипердензни (Т2) лезии в базалните ганглии, засягащи особено областта на опашката и путамена. Подобни лезии се наблюдават и при енцефалопатия на Вернике, множествена склероза, болест на Уилсън, аминокиселинна урея, митохондриални енцефаломиелопатии и различни форми на интоксикация [3]. За разлика от енцефалопатията на Вернике, мамиларните тела са пощадени от патологични промени [3]. Диференциация на болестта на Уилсън е възможна чрез лабораторни изследвания на кръвта [4].
В момента повечето симптоматични терапии се опитват да подобрят окислителните и биоенергийните способности на митохондриите [6]. Използването на коензим Q10, тиамин и карнитин може да причини намаляване на тежестта на симптомите в няколко случая [6]. Cacic и сътр. съобщават, че симптоми на 19-годишен мъж се поддържат стабилни поне четири години от терапия, включваща леводопа, карбидопа и креатинин монохидрат [8].
4. Заключения
В представения случай диагнозата Leigh’s Disease може да бъде достигната само след смъртта, въпреки че три месеца преди смъртта са били извършени MRI сканирания и лабораторни изследвания. Те показаха нормални находки, освен това други типични симптоми - като забавяне на психомоторното развитие, слабост, затруднено хранене или типични неврологични симптоми - не бяха наблюдавани. Клиничните симптоми в деня на смъртта вероятно са били предимно с остър мозъчен произход. Въпреки това, следсмъртното изследване показа морфологични находки на мозъка на детето, които са специфични за болестта на Leigh. Повишената концентрация на лактат в кръвта и ликвора може да бъде потвърдена при изследване след смъртта, което е типично за болестта на Leigh, но може да се види при много аутопсии поради генерализираната агонална клетъчна хипоксемия.
Трябва да се приеме, че този доклад за случая описва необичаен, „остър“ ход на нормално подострата некротизираща енцефаломиелопатия с поразително кратък и предимно незабележим клиничен ход.
Благодарности
Авторите биха искали да благодарят на г-н A. Nerlich, директор на Института по патология на болница Мюнхен-Богенхаузен и г-н W. Feiden, директор на Института по невропатология на университетската болница Саарланд за техните консултации.
Препратки
- D. Leigh, „Подостра некротизираща енцефаломиелопатия при бебе,“ Вестник по неврология, неврохирургия и психиатрия, об. 14, стр. 216–221, 1951. Изглед в: Google Scholar
- Р. Дж. Хънтсман, Д. Б. Синклер, Р. Бхаргава и А. Чан, „Нетипични представяния на синдрома на Лий: поредица от случаи и преглед“, Детска неврология, об. 32, бр. 5, стр. 334–340, 2005. Преглед на: Издателски сайт | Google Scholar
- M. Spranger, S. Schwab, M. Wiebel и C.-M. Бекер, „Das adulte Leigh-syndrome,“ Nervenarzt, об. 66, бр. 2, стр. 144–149, 1995. Изглед в: Google Scholar
- R. Tomczak, A. Rieber, H. Zeitler и H.-J. Brambs, “Neugeborenes mit zerebraler simptomatik,” Radiologe, об. 36, бр. 7, стр. 591–592, 1996. Преглед в: Google Scholar
- S. Savasta, G. P. Comi, M. P. Perini et al., „Болест на Leigh: клинично, неврорадиологично и биохимично изследване на три нови случая с дефицит на цитохром с оксидаза“, Списание за детска неврология, об. 16, бр. 8, стр. 608–613, 2001. Преглед в: Google Scholar
- A. A. S. R. Mannan, M. C. Sharma, P. Shrivastava et al., „Синдром на Leigh“, Индийски вестник по педиатрия, об. 71, бр. 11, стр. 1029–1033, 2004. Изглед в: Google Scholar
- M. Crimi, A. Papadimitriou, S. Galbiati et al., „Нова митохондриална ДНК мутация в ND3 ген, причиняваща тежък синдром на Leigh с ранна леталност“, Педиатрични изследвания, об. 55, бр. 5, стр. 842–846, 2004. Преглед на: Издателски сайт | Google Scholar
- M. Cacic, E. Wilichowski, V. Mejaski-Bosnjak et al., „Свързана с частичен дефицит на цитохром с оксидаза болест на Leigh, представяща се като екстрапирамиден синдром“ Списание за детска неврология, об. 16, бр. 8, стр. 616–619, 2001. Преглед в: Google Scholar
- Е. Проничка, Д. Пиекутовска-Абрамчук и М. Проницки, „Метаболитни заболявания при деца, включително синдром на Лий - биохимичен и молекулярен фон,“ Postepy Biochemii, об. 54, бр. 2, стр. 161–168, 2008. Преглед в: Google Scholar
- K. Naess, C. Freyer, H. Bruhn et al., „MtDNA мутациите са честа причина за тежки фенотипи на заболяването при деца със синдром на Leigh“ Biochimica et Biophysica Acta, об. 1787, бр. 5, стр. 484–490, 2009. Преглед на: Издателски сайт | Google Scholar
- Влияние на наднорменото тегло и затлъстяването върху функционалните и клиничните резултати от ранната болест на Паркинсон
- Болест или синдром на Leigh UMDF
- Дългосрочни резултати след остър некротизиращ панкреатит Какво се случва с панкреаса и
- Информационна страница за болестта на Leigh Национален институт по неврологични разстройства и инсулт
- Мерки за начин на живот при лечение на стомашно-езофагеална рефлуксна болест клинични и