Свързани данни
Суровите данни, подкрепящи заключенията на тази статия, са на разположение на NCBI под BioProject PRJNA573643. Допълнителни данни, като например кода за генериране на цифри, ще бъдат предоставени, без ненужна резервация, на всеки квалифициран изследовател.
Резюме
Въведение
Проучванията, които характеризират профилите на микробната общност на различни видове насекоми, получават все по-голямо внимание, но все още не се знае много за микробиома на зелевата муха Delia radicum. Този вредител по културите може да причини опустошителни загуби на добив на много популярни зеленчукови култури, например зеле, колраби или рапица (Soroka et al., 2004; Dosdall et al., 2012). Женските от този вид отлагат яйцата си върху или близо до стъблото на кръстоцветните растения и новопоявили се ларви се отварят в кореновата тъкан. Обикновено ларвите остават вътре в растителната тъкан, само за да се преместят в почвата непосредствено преди какавидирането и впоследствие да се появят като възрастни (Smith, 1927). Метаморфозата причинява драстични промени в анатомията и физиологията на насекомите, а проучванията върху други насекоми съобщават, че тя също може да има драстични ефекти върху свързания микробиом (Geib et al., 2009; Hammer et al., 2014; Hammer and Moran, 2019).
Материали и методи
Delia radicum Отглеждане
Яйцата, образували изходната колония на D. radicum, са получени от университета Вагенинген (Лаборатория по ентомология, проф. Йооп ван Лун). Мухите се държат в ентомологична клетка (60 × 60 × 120 cm) с свободен достъп до вода и смес от 1: 1: 1 суха храна, състояща се от екстракт от мая, обезмаслено мляко на прах и захароза. Клетките се държат в лаборатория без контрол на влажността при стайна температура и при естествено осветление. За целите на развъждането малък пластмасов контейнер (12 × 12 × 6 см, сега наричан кутия за яйца) беше напълнен с 1 см мокър речен пясък, върху който беше поставена ряпа (B. rapa subsp. Rapa), за да се улесни отлагането на яйца . Яйцеклетките бяха преместени от ентомологичната клетка след една седмица и ларвите бяха оставени да се хранят с доставената ряпа за около 4 седмици до какавидирането. След това какавидите се отделят от речния пясък чрез наводняване на кутията за яйца и пресяване на водата, след което какавидите се поставят обратно в ентомологична клетка до еклозия, маркирайки началото на ново поколение.
Придобиване на проби
Ряпа (TURN1-5)
Кожата на ряпата (B. rapa subsp. Rapa) беше нарязана повърхностно с повърхностно стерилизиран бръснач, с дебелина приблизително 2 mm. Приблизително 5 g от този материал се хомогенизират в течен азот с помощта на хоросан и пестик. Приблизително 0,25 g хомогенен материал бяха използвани надолу по веригата с PowerSoil ДНК екстракция.
Разлагаща се ряпа (PULP1-5)
Приблизително 200 mg проби от мацерирана тъкан от заразена с личинка D. radicum ряпа се прехвърлят директно в тръба на PowerSoil с повърхностно стерилна шпатула.
Яйца (EGGS1-5)
Приблизително 200 яйца от D. radicum бяха събрани чрез заливане на кутиите за яйца с (нестерилизирана) демивода и събиране на оттока в мерителна колба с тънко гърло, за да се концентрират плаващите яйца в горната част на колбата. След това те бяха събрани с филтър Whatman и поставени в държач на филтър. Отгоре се поставя друг филтър за Whatman и яйцата се измиват с 5 ml от следните разтвори с помощта на спринцовка: milliQ вода, 6,5% белина, 70% етанол и milliQ вода. Впоследствие филтрите на Whatman, съдържащи яйцата, се хомогенизират чрез замразяване в течен азот и след това смачкване с хоросан и пестик. Хомогенатът се използва надолу по веригата при екстракция на ДНК, като се използва комплектът PowerSoil.
Ларви (MAGG1-10)
Двадесет ларви бяха събрани със стерилни форцепс и съхранявани при -20 ° C до екстракция на ДНК. Преди екстракцията на ДНК, всички бяха измити в 5 ml стерилна MQ вода, след това в 5 ml 70% етанол, след това в 5,5–7,5% активен хлорен белина и накрая отново изплакнати в 5 ml MQ. Впоследствие всички цели ларви се хомогенизират от хоросан и пестик в течен азот.
Какавиди (PUPA1-5)
40-100 какавиди бяха събрани чрез заливане на кутия за яйца с чешмяна вода и пускане на горната течност, съдържаща какавидите, през родово сито. Преди екстракцията на ДНК, всички какавиди бяха повърхностно стерилизирани по идентичен начин с пробите на ларвите. Впоследствие всички цели какавиди се хомогенизират от хоросан и пестик в течен азот.
Мухи
30-40 мухи бяха събрани от ентомологични клетки с аспиратор и впоследствие умъртвени с хлороформ. Мухите бяха сексирани въз основа на морфологията на корема; мухите с подути кореми, които са характерни за гравидните жени (FLYF1-5), са определени като жени, а мухите със свити кореми (FLYM1-5) са определени като мъже. Хората с неубедителни екстериори бяха изхвърлени. Мухите се стерилизират на повърхността по идентичен начин с пробите на ларвите и впоследствие се хомогенизират от хоросан и пестик в течен азот. За подробни описания на съответния произход и количества биологичен материал, който е бил използван за проба, както и концентрациите на ДНК след екстракция, се позоваваме на таблицата с метаданни (допълнителна таблица 1).
Последователност и анализ на 16S rRNA ген V3-V4 регион
Резултати
Предварителна обработка
Сдвоеното секвениране на V3-V4 региона на 16S рРНК гена доведе до общо 1 249 018 четения от 40 проби. Профилите на качествения рейтинг са типични за последователността на MiSeq, с висококачествени резултати за> 250 цикъла в посока напред и ∼200 цикъла в обратна посока (допълнителна фигура 1). Кривите на разреждане показват, че обхватът на бактериалното разнообразие е достатъчен и поради това избрахме да не вземаме проби с еднаква дълбочина за проба. Наскоро разработените методи ни позволиха да разрешим вариантите на ампликонната последователност (ASV), вместо да прибягваме до по-класическата конструкция на молекулярни оперативни таксономични единици (OTU). Предимствата на този метод включват по-висока разделителна способност и възпроизводимост и позволява лесно сливане между независимо обработени набори от данни (Callahan et al., 2017). Освен ако не е посочено друго, данните и анализите на този ръкопис изключват четения, които са били таксономично присвоени на митохондрии, хлоропласт или където таксономичното разпределение не е било разрешено на ниво фила.
Състав на бактериалната общност
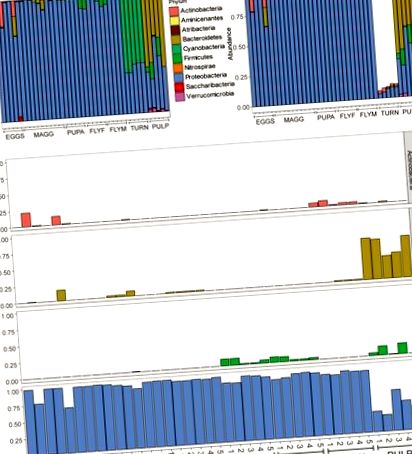
Общо 1006 варианта на последователност на ампликон (ASV) бяха идентифицирани в целия набор от данни. Филтрирането на ASV с относително изобилие означава по-малко от 5e – 5, оставя общо 357 обилни ASVs в десет вида (Фигура 1А). Всички проби от D. radicum, независимо от етапа на живот, са доминирани до голяма степен от протеобактерии. Повечето от данните за последователността, събрани от пробите на непокътната ряпа (~ 90%), се състоят от ASV, които идват от хлоропласти и поради това не са подходящи за определяне на нейния микробиом (Фигура 1В). Умерени количества Firmicutes се появяват при възрастни мухи D. radicum, но не и в предишни етапи от живота (Фигура 1C). Останалите ASV на ряпа са класифицирани най-вече като протеобактерии и актинобактерии. Пробите от разлагаща се тъкан от ряпа съдържат голям брой Bacteroidetes, както и протеобактерии (Фигура 1C), и уникално приютяващи Verrucomicrobia ASV (не са показани). Замърсяването от хлоропласт не е очевидно в тези проби. Преглед на 20-те най-разпространени рода във всички проби е представен на Фигура 2А, а на Фигура 2Б може да се види топлинна карта, изобразяваща относителното изобилие на различни бактериални семейства в групи от проби. .
(А) Всички четения са представени като относително изобилие, след филтриране на четения с ниско изобилие (средно (x)> 5e – 5). (Б) Бар участък след премахване на четения, където класът е определен като „хлоропласт“ или „неидентифициран“, или където семейството е обозначено като „митохондрии“. Имайте предвид, че над 80% от четенията са отстранени от проби в групата проби „ряпа“, което може да се обясни с големия брой хлоропласти в тъканта. (° С) Относителни показания на Actinobacteria, Bacteroidetes, Firmicutes и Proteobacteria във всички проби, оградени от филум. ЯЙЦА, яйца Delia radicum; MAGG, ларви на Delia radicum; PUPA, какавиди D. radicum; FLYF, възрастни жени от D. radicum; FLYM, Възрастни мъже от D. radicum; TURN, Кожа от прясна, незаразена Brassica rapa subsp. рапа; PULP, Мацерирана тъкан на инвазиран от D. radicum индивид от B. rapa subsp. рапа.
(А) Преглед на 20-те най-разпространени рода, свързани с лабораторна култура на Delia radicum, включително проби от множество етапи на живот и от прясна и разложена ряпа. Данните първо бяха агломерирани на ниво род, след което бяха обединени по проба. (Б) Топлинна карта, която показва относителното изобилие от четения за групи от проби, където изобилието е обединено на ниво семейство. ЯЙЦА, яйца от D. radicum; MAGG, ларви на D. radicum; PUPA, какавиди D. radicum; FLYF, възрастни жени от D. radicum; FLYM, Възрастни мъже от D. radicum; TURN, Кожа от прясна, незаразена Brassica rapa subsp. рапа; PULP, Мацерирана тъкан на инвазиран от D. radicum индивид от B. rapa subsp. рапа.
Гамапротеобактерии
(А) Относително изобилие от четения в класа на гамапротеобактериите, агломерирани по група проби. (Б) Гамапротеобактериални щамове, които могат да бъдат идентифицирани до видово ниво въз основа на секвениране на региона V3-V4. MAGG, ларви на Delia radicum; PUPA, какавиди D. radicum; FLYF, възрастни жени от D. radicum; FLYM, Възрастни мъже от D. radicum; TURN, Кожа от прясна, незаразена Brassica rapa subsp. рапа; PULP, Мацерирана тъкан на инвазиран от D. radicum индивид от B. rapa subsp. рапа.
Волбахия
Родът Wolbachia включва ендосимбиотични бактерии и е известно, че заразява голямо разнообразие от членестоноги и нематоди (Serbus et al., 2008). В нашия набор от данни ASV, които са били таксономично присвоени на рода Wolbachia, са съставлявали 52% от общия брой четения, което включва десет проби не насекоми, девет от които са лишени от Wolbachia четения. Тъй като ние извличаме ДНК на множество индивиди за всяка проба от D. radicum, степента на заразяване на културата не може да бъде определена с тези данни и е възможно не 100% от индивидите да носят Wolbachia. Една от пет проби от гниеща ряпа („PULP4“) дава 34 отчитания на Wolbachia, което най-вероятно се дължи на случайното включване на ларвена тъкан по време на вземането на проби. Общо девет различни ASV бяха определени като Wolbachia, като едната беше представена от 478723 четения, докато останалите осем съдържаха само между 2 и 25 четения. По всяка вероятност откриването на последните варианти е резултат от грешки в последователността и/или артефакти в алгоритъма за извикване на ASV на DADA2. Изменението на относителното изобилие на Wolbachia в пробите между етапите на живот на D. radicum е представено на Фигура 4 .
Относително изобилие от четения, отнесени към рода Wolbachia в проби Delia radicum. MAGG, ларви на D. radicum; PUPA, какавиди D. radicum; FLYF, възрастни жени от D. radicum; FLYM, Възрастни мъже от D. radicum; TURN, Кожа от прясна, незаразена Brassica rapa subsp. рапа; PULP, Мацерирана тъкан на инвазиран от D. radicum индивид от B. rapa subsp. рапа.
Примерно разнообразие
(А) Точкови графики на алфа разнообразието (индекси Chao1 и Shannon-Weaver) на свързаната с Delia radicum микробиота и техните диетични субстрати преди хранене (ряпа_ кожа) и след хранене от ларви D. radicum (ряпа_пулпа). (Б) Принципен координатен анализ на 30 D. radicum и 10 проби Brassica rapa, базиран на непретеглени и претеглени разстояния UniFrac. MAGG, ларви на D. radicum; PUPA, какавиди D. radicum; FLYF, възрастни жени от D. radicum; FLYM, Възрастни мъже от D. radicum; TURN, Кожа от прясна, незаразена B. rapa subsp. рапа; PULP, Мацерирана тъкан на инвазиран от D. radicum индивид от B. rapa subsp. рапа.
МАСА 1
Двойни сравнения на много нива, използващи адонис с 999 пермутации.
| Pr (> F) | D. radicum | D. radicum | D. radicum | D. radicum | D. radicum | Мацериран |
| Яйца | Ларви | Какавиди | Възрастни жени | Възрастни мъже | ряпа | |
| D. radicum Ларви | 0,002 ** | |||||
| D. Radicum Pupae | 0,009 ** | 0,001 *** | ||||
| D. radicum Възрастни жени | 0,010 ** | 0,007 ** | 0,010 ** | |||
| D. radicum Възрастни мъже | 0,016 * | 0,001 *** | 0,012 * | 0,206 | ||
| Мацерирана ряпа | 0,009 ** | 0,001 *** | 0,012 * | 0,007 ** | 0,011 * | |
| Прясна ряпа | 0,008 ** | 0,003 ** | 0,010 ** | 0,010 ** | 0,011 * | 0,009 ** |
Дискусия
В това проучване ние изследвахме разнообразието на микробната общност, което е свързано с яйцата, ларвите, какавидите и възрастните етапи от живота на зелената коренна муха D. radicum. Всички етапи на живота съдържат значителни количества Wolbachia, но също така съдържат разнообразна микробна общност от други бактерии. Тъй като диетата и околната среда също са фактори, които оказват влияние върху микробиома, ние включихме микробното разнообразие на растението гостоприемник (ряпа) и на разлагащия се гостоприемник, заразен с ларви на D. radicum. Разлагащият се растителен материал се характеризира с много високо алфа разнообразие.
Освен това пробите от прясна и мацерирана ряпа се различават значително от микробните съобщества на D. radicum по структура и състав, но също така споделят редица таксони, които евентуално се прехвърлят между околната среда и гостоприемника, или обратно.
Всички етапи на живота на D. radicum се характеризират с голямо количество протеобактериални симбионти, но всеки от тях има уникални характеристики, които могат да бъдат разрешени чрез сравняване на различни показатели за разнообразие.
Сравненията с други изследвания, които секвенираха гена 16S rRNA на чревни бактерии, свързани с насекоми, показват някои интересни паралели, както и различия.
За бъдещи проучвания може да е интересно да се комбинират резултатите от секвенирането от различни лабораторно отгледани видове насекоми, за да се види дали вариацията на микробното разнообразие е по-голяма между различните етапи на живот на едно насекомо или между два вида насекоми в един и същ жизнен етап. Изследвания върху домашни мухи показват, че географският произход и отглеждането в лаборатории могат да окажат значително влияние върху микробиома (Park et al., 2019).
Доказано е, че присъствието на Wolbachia играе роля при определянето на микробиомния състав при дрозофила (Simhadri et al., 2017).
Дали таксоните, докладвани в това проучване, са преходни или пребиваващи, или дори мъртви или живи, не може да бъде разрешено чрез методите, представени в тази работа. Бъдещите проучвания биха могли да изяснят потенциала на хранителните взаимности между D. radicum и пребиваващите микроби.
Тази работа даде възможност за по-задълбочено разбиране на бактериалните играчи, свързани с D. radicum на различни етапи от живота, и на бактериалната природа на растителното гниене, свързано с заразяването с D. radicum. Като такъв той може потенциално да даде нови улики за симбиотични бактерии, които могат да бъдат използвани в програмите за биоконтрол. Изясняването на моделите на предаване и специфичните функции на тези видове бактериални играчи са интересни платформи за по-нататъшни изследвания.
Декларация за наличност на данни
Суровите данни, подкрепящи заключенията на тази статия, са на разположение на NCBI под BioProject PRJNA573643. Допълнителни данни, като например кода за генериране на цифри, ще бъдат предоставени, без ненужна резервация, на всеки квалифициран изследовател.
Принос на автора
TB и CW са проектирали изследването. TB проведе изследването, анализира данните и написа ръкописа с принос от CW.
- Деликатната страна на зелето - изживейте живота
- Първите месеци от живота критичен период за развитие на затлъстяване
- Тези личностни черти ще удължат живота ви най-добрия живот
- Храната с плоски кореми, която не знаете за Kefir HuffPost Life
- Защо започвам деня си с топла кайенска лимонена вода Зает съпруга Зает живот