Yawei Guo
1 Болница Xuanwu Capital Medical University, Пекин 100053, Китай
Сяохуй Жу
1 Болница Xuanwu Capital Medical University, Пекин 100053, Китай
Ша Дзен
2 Централна болница Ксиантан, Ксиантан 411100, Китай
Mingyi He
1 Болница Xuanwu Capital Medical University, Пекин 100053, Китай
Xiurong Xing
1 Болница Xuanwu Capital Medical University, Пекин 100053, Китай
Чанюан Уанг
1 Болница Xuanwu Capital Medical University, Пекин 100053, Китай
Свързани данни
Данните, използвани в подкрепа на констатациите от това проучване, са включени в статията.
Резюме
1. Въведение
Спиралните нива на затлъстяване и захарен диабет тип 2 са световен здравен проблем, засягащ милиони хора. Преяждането и намаленото физическо натоварване са основните причини за тези тревожни явления. Сред многото фактори, за които е доказано, че участват в развитието на затлъстяване, хипергликемия и инсулинова резистентност, чревната микробиота играе важна роля. Дългосрочният прием с високо съдържание на мазнини (HFD) може да доведе до дисбиоза на чревната микробиота, а затлъстелите лица често се характеризират с ниско микробно разнообразие и влошаване на състава на микробиотите [1–3].
Циркадната ритмичност играе критична роля за поддържане на физиологичната хомеостаза и цялостното здраве. Нарушаването на циркадния ритъм често е свързано с появата и развитието на затлъстяване, диабет тип 2 и други метаболитни синдроми [4]. Предишни проучвания, използващи модели на гризачи за циркадни смущения, показват, че HFD храненето има неблагоприятно модулирано циркадно сигнализиране, което предполага двупосочна регулация между циркадната сигнализация и диетата [5]. Свързаните механизми обаче се нуждаят от допълнително изясняване. Наскоро беше установено, че чревният микробиом, жизненоважен медиатор за увличане на диетичния състав, участва в поддържането на циркадния ритъм [6]. Важно е, че чревният микробиом проявява дневен ритъм и произвежда трептения в своите метаболити и тези дневни вариации могат да бъдат нарушени от приема на HFD [6, 7].
МикроРНК (miRNAs), клас ендогенно малки некодиращи РНК, състоящи се от 19-25 нуклеотида, могат да упражняват инхибиращи или стимулиращи ефекти върху експресията на целевите гени посттранскрипционно. Наскоро беше показано, че тези важни генно-регулаторни звена модулират циркадния локомоторен ритъм и изходните пътища [8, 9]. Например, miRNA-276a и let-7 могат да регулират експресията на гена на пейсмейкъра без време [10, 11], докато miRNA-276b може да контролира циркаден локомоторен ритъм чрез потискане на експресията на Beadex [12]. Освен това се предполага, че miRNAs могат да модулират генната експресия в техните целеви бактерии и да насърчават растежа им, като по този начин оформят чревната микробиота [13]. Следователно, ние предполагаме, че miRNA-10a, която се експресира ритмично и регулира гените, участващи в метаболизма на липидите и глюкозата [14], може да има ефект върху чревната микробиота и инсулиновата чувствителност. В това проучване установихме, че miRNA-10a-5p облекчава индуцираното от HFD затлъстяване, непоносимостта към глюкоза и инсулиновата резистентност. Освен това, miRNA-10a-5p поддържа дневни модели на триглицериди и чревна микробиота, които са нарушени от приема на HFD.
2. Материали и методи
2.1. Животни и експериментален дизайн
2.2. Тест за интраперитонеална глюкоза и инсулинова толерантност
Интраперитонеален глюкозен тест (IGTT) и инсулинов толеранс (ITT) бяха направени след седем седмици лечение. Животните се инжектират интраперитонеално с 1,0 g глюкоза или 0,65 U инсулин на kg телесно тегло след шестчасово гладуване. След инжектиране на глюкоза или инсулин, кръвта от вената на опашката се използва за измерване на концентрацията на глюкоза на 0, 30, 60 и 120 минути, като се използва глюкометър Ultra Touch Ultra Easy.
2.3. Анализ на генната експресия
Общата РНК беше извлечена от черния дроб, както беше описано по-рано [15]. cDNA беше синтезирана с помощта на SuperScript II (Invitrogen, Шанхай, Китай). Праймерите се смесват със смес от SYBR Green PCR (Invitrogen) за усилване на Clock, Per2 и Cry1 чрез количествен PCR анализ в реално време. Резултатите от генната експресия бяха изчислени, използвайки сравнителния CT метод, нормализиращ прицелната тРНК до β-актин. Грундовете се използват, както е описано по-рано [6] и са изброени в таблица 1 .
маса 1
Грундове за RT-qPCR.
| Часовник | F: ACCACAGCAACAGCAACAAC |
| R: GGCTGCTGAACTGAAGGAAG | |
| По2 | F: TGTGCGATGATGATTCGTGA |
| R: GGTGAAGGTACGTTTGGTTTGC | |
| Cry1 | F: CACTGGTTCCGAAAGGGACTC |
| R: CTGAAGCAAAAATCGCCACCT | |
| β-актин | F: TGTCCACCTTCCAGCAGATGT |
| R: AGCTCAGTAACAGTCCGCCTAGA | |
| Но | F: TCAAATCMGGIGACTGGGTWGA |
| R1: TCGATACCGGACATATGCCAKGAG | |
| R2: TCATAACCGCCCATATGCCATGAG | |
| 16 с | F: TCCTACGGGAGGCAGCAGT |
| R: GGACTACCAGGGTATCTAATCCTGTT |
2.4. Определяне на серумна концентрация на глюкоза, триглицериди и холестерол
Концентрацията на глюкоза се анализира с наличния в търговската мрежа комплект (Институт по биоинженеринг в Нанкин Jiancheng, Нанкин, Китай), а съдържанието на триглицериди (TG) и холестерол (Chol) се определя с налични в търговската мрежа комплекти (Beijing Strong Biotechnologies, Inc., Пекин, Китай).
2.5. Профилиране на микробиота
Проби от дигеста на дебелото черво бяха използвани за извличане на обща ДНК на генома и амплификацията беше направена с помощта на специфичен праймер с баркод (16S V3 + V4). Библиотеките за секвениране бяха генерирани и анализирани, както беше описано по-горе [16]. Оперативни таксономични единици (OTU) бяха извършени за геномно прогнозиране на микробни общности чрез анализ Tax4Fun, както беше описано по-рано [17].
2.6. Определяне на концентрациите на SCFA
След добавяне на дейонизирана предварително студена вода, проби от дигеста на дебелото черво се поставят периодично върху вихров миксер за 2 минути. След това пробите се поддържат при 4 ° С в продължение на 15 минути и се центрофугират при 5 000 g в продължение на 15 минути при 4 ° С. Супернатантата се определя чрез инжектиране върху хроматографската система, както е описано по-рано [18].
2.7. Количествено определяне на бактериални гени
За определяне на бутирил-CoA: ацетат CoA-трансфераза (But) номер на копие на гена са използвани проби от дегестация на дебелото черво. Гените се определят количествено чрез определяне на стандартна крива и се използват праймери, както е описано по-рано [6] и са изброени в таблица 1 .
2.8. Статистически анализ
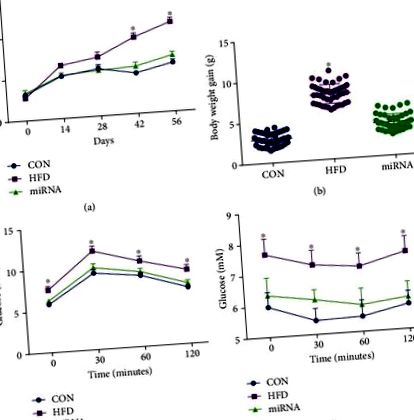
Статистическите анализи бяха извършени с помощта на ANOVA и последвани от множество сравнения, използващи анализ на Bonferroni (софтуер SPSS 18). За времевите редове е извършен многовариантният дисперсионен анализ чрез теста на Дънкан. Данните са представени като средни стойности ± SEM. Значението беше прието при P Фигура 1 (а), телесното тегло значително се увеличи след прием на HFD в продължение на 8 седмици, докато прилагането на miRNA-10a-5p предотврати тази промяна. Повишаването на телесното тегло на контролните мишки по време на експеримента е значително по-ниско от това на мишки, хранени с HFD, докато не се наблюдава значителна разлика в телесното тегло между контролните мишки и мишките, хранени с HFD, прилагани с miRNA-10a-5p (Фигура 1 (b )). Резултатите от IGTT (Фигура 1 (c)) и ITT (Фигура 1 (d)) показват, че HFD-хранените мишки имат намален глюкозен толеранс и чувствителност към инсулин, докато прилагането на miRNA-10a-5p подобрява тези параметри при HFD-хранени мишки.
Ефекти на miRNA-10a-5p върху наддаването на телесно тегло, IGTT и ITT при мишки, хранени с високо съдържание на мазнини. а) телесно тегло; (б) наддаване на телесно тегло; (в) интраперитонеален глюкозен тест; (г) тест за толерантност към инсулин. Данните бяха изразени като Средно ± SEM. ∗ P 2 (a) - 2 (c), HFD променя циркадния часовник на експресия на чернодробен часовник, Per2 и Cry1 mRNA, както е показано в предишни проучвания [6, 7]. Експресията на mRNA на Clock, Per2 и Cry1 при мишки, прилагани с miRNA-10a-5p, показва дневни ритми, подобни на тези при контролните мишки (Таблица 2). Установихме, че HFD значително повишава нивата на глюкоза, триглицериди и холестерол в серумите на мишки в сравнение с тези в серумите на мишки на диета с ниско съдържание на мазнини, докато няма значителна разлика в тези параметри между контролните мишки и HFD хранените мишки, администрирани с miRNA-10a-5p (Фигури 2 (d) - 2 (f)). Въпреки това, нивото на серумна глюкоза показва ритмичност само при контролни мишки, докато съдържанието на серумни триглицериди показва ритмичност както при контролни мишки, така и при мишки, хранени с HFD, прилагани с miRNA-10a-5p (Таблица 3).
Таблица 3
Мезор, амплитуда и акрофаза на глюкозата и триглицеридите в серума на мишките.
| Глюкоза | CON | 23.10 | 6.04 | 0,22 | ∗ |
| miRNA | NS | ||||
| Триглицериди | CON | 22.63 | 2.22 | 0,51 | * NS: не е значимо. |
За да определим дали ритмичността на серумните триглицериди е свързана с експресията на гена в чернодробния часовник, проведохме корелационен анализ на Пиърсън между нивата на триглицеридите и експресията на циркадния часовник. Наблюдавана е силна положителна корелация между съдържанието на серумен триглицерид и експресията на чернодробния часовник при контролни мишки (r = 0.9078) (Фигура 2 (g)). Междувременно имаше по-малко положителна корелация между нивата на серумните триглицериди и експресията на чернодробния часовник и при двете контролни мишки (r = 0.6728) (Фигура 2 (h)) и при мишки, хранени с HFD, администрирани с miRNA-10a-5p (r = 0.7925) ( Фигура 2 (i)).
3.3. Ефекти на miRNA-10a-5p върху дневните ритми на чревната микробиота при HFD-Fed мишки
Циркадните ритми на чревната микробиота и обезпокоителните ефекти на HFD са докладвани по-рано [6, 19]. Нашите резултати допълнително потвърдиха, че три рода микроби, Oscillospira, Ruminococcus и Lachnospiraceae, претърпяват дневни трептения (Таблица 4; Фигури 3 (а) - 3 (в)). Както беше описано по-рано [6, 7], HFD нарушава дневните им ритми. Важното е, че HFD намалява изобилието на Lachnospiraceae при ZT0, докато увеличава изобилието на Ruminococcus през всички времеви точки. Прилагането на miRNA-10a-5p поддържа дневните ритми на гореспоменатите микроби.
R коефициентът на Pearson показва положителни корелации между експресията на чернодробния часовник и относителното изобилие на Lachnospiraceae, както при контролни мишки (r = 0,877) (Фигура 3 (d)), така и при HFD-хранени мишки, прилагани с miRNA-10a-5p (r = 0,853) (Фигура 3 (е)). Въпреки това се наблюдава само незначителна отрицателна корелация между експресията на чернодробния часовник и относителното изобилие на Lachnospiraceae при HFD-хранени мишки (r = -0,03935) (Фигура 3 (д)).
3.4. Ефекти на miRNA-10a-5p върху дневните ритми на съдържанието на бутират и експресията на но гени при HFD-Fed мишки
Както е показано на Фигура 4 (а), наблюдавахме дневни трептения във фекалния бутират и нарушаване на неговия дневен ритъм от HFD. Прилагането на miRNA-10a-5p поддържа дневния ритъм на нивото на бутирата. Освен това, администрирането на miRNA-10a-5p възстановява дневното трептене на обилната експресия на микробния ген But, който кодира ензима, участващ в синтеза на бутират, след прекъсването, причинено от приема на HFD (Таблица 4; Фигура 4 (b)).
Ефекти на miRNA-10a-5p върху дневните ритми на съдържанието на бутират и генната експресия на But при мишки, хранени с високо съдържание на мазнини. (а) Относително изобилие на бутират във фекалиите; (б) относително изразяване на Но. Данните бяха изразени като Средно ± SEM. * P Singh R. K., Chang H. W., Yan D., et al. Влияние на диетата върху микробиома на червата и последици за човешкото здраве. Списание за транслационна медицина. 2017; 15 (1): стр. 73. doi: 10.1186/s12967-017-1175-y. [PMC безплатна статия] [PubMed] [CrossRef] [Google Scholar]
- Без хранителни вещества пълното затлъстяване, инсулиновата резистентност и хиперандрогенизмът опосредстват връзката между
- Затлъстяването и инсулиновата резистентност са свързани с намалена активност в основните области на паметта на
- Моят живот с инсулинова резистентност; Рецепти от Джен
- MiR-483-5p се свързва със затлъстяването и инсулиновата резистентност и независимо се свързва с нови
- Хранителни хранителни вещества за отслабване и инсулинова резистентност - Марти Кендъл