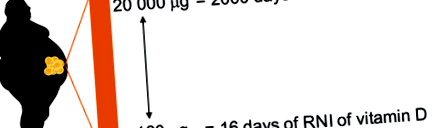Департамент по здравеопазване, Университет на Бат, Бат, Великобритания
Департамент по здравеопазване, Университет на Бат, Бат, Великобритания
Департамент по здравеопазване, Университет на Бат, Бат, Великобритания
Департамент по здравеопазване, Университет на Бат, Бат, Великобритания
Институт по метаболизъм и системни изследвания, Университет в Бирмингам, Бирмингам, Великобритания
Институт по метаболизъм и системни изследвания, Университет в Бирмингам, Бирмингам, Великобритания
NIHR BRC Nutritional Biomarker Laboratory, University of Cambridge, Cambridge, UK
NIHR BRC Nutritional Biomarker Laboratory, University of Cambridge, Cambridge, UK
Департамент по здравеопазване, Университет на Бат, Бат, Великобритания
Кореспонденция: Проф. Дилън Томпсън, катедра по здравеопазване, Университет на Бат, Клавертън Даун, Бат BA2 7AY, Великобритания.
Департамент по здравеопазване, Университет на Бат, Бат, Великобритания
Департамент по здравеопазване, Университет на Бат, Бат, Великобритания
Департамент по здравеопазване, Университет на Бат, Бат, Великобритания
Департамент по здравеопазване, Университет на Бат, Бат, Великобритания
Институт по метаболизъм и системни изследвания, Университет в Бирмингам, Бирмингам, Великобритания
Институт по метаболизъм и системни изследвания, Университет в Бирмингам, Бирмингам, Великобритания
NIHR BRC Nutritional Biomarker Laboratory, University of Cambridge, Cambridge, UK
NIHR BRC Nutritional Biomarker Laboratory, University of Cambridge, Cambridge, UK
Департамент по здравеопазване, Университет на Бат, Бат, Великобритания
Кореспонденция: Проф. Дилън Томпсън, катедра по здравеопазване, Университет на Бат, Клавертън Даун, Бат BA2 7AY, Великобритания.
Резюме
Въведение
Витамин D има ефекти далеч отвъд класическите си действия върху калциевата хомеостаза и метаболизма на костите и се смята, че недостатъчността на витамин D засяга много физиологични системи и широк спектър от резултати за човешкото здраве (Добниг и др. 2008; Ginde и др. 2009; Семба и др. 2010). Състоянието на витамин D обикновено се определя чрез измерване на концентрациите на основната циркулираща форма на витамин D, 25-хидроксивитамин D [25 (OH) D]. Приблизително 30–40% от населението на Обединеното кралство има циркулиращи 25 (OH) D 2016) и корекцията на ниски системни концентрации от 25 (OH) D е признат приоритет за общественото здраве (Palacios & Gonzalez 2014; Cashman и др. 2016).
Витамин D: Преглед
Двете основни форми на витамин D са витамин D2 (ергокалциферол) и витамин D3 (холекалциферол) (Askew и др. 1930; Уиндаус и др. 1936). Превитамин D3 се синтезира от кожата, когато слънчевата ултравиолетова (UV) радиация (дължина на вълната 290–320 nm) проникне в кожата и се абсорбира от 7-дехидрохолестерол (Maclaughlin и др. 1982), преди спонтанно и бързо да се изомеризира до витамин D3. Витамин D3 се метаболизира в черния дроб до 25 (OH) D - основната циркулираща форма на витамин D (тъп и др. 1968; Blunt & Deluca 1969). Витамин D2 и витамин D3 могат да бъдат получени от диетата и от добавки (Holick 2007). Витамин D2 се синтезира чрез ултравиолетово облъчване на ергостерол и приемът се осъществява главно чрез консумация на UV-облъчени гъби или добавки. За разлика от тях, витамин D3 е по-широко разпространен в храните и по-често се използва в добавки и обогатени храни, отколкото витамин D2. Една от причините за използването на серум 25 (OH) D като мярка за състоянието на витамин D е, че той има период на полуразпад
2–3 седмици и следователно количественото определяне на този метаболит не се влияе от преходни промени в хранителния витамин D или остро излагане на слънце в същата степен като другите метаболити на витамин D (Джоунс и др. 2015). Методите за оценка на 25 (OH) D са разгледани от Le Goff и др. (2015). В този преглед позоваването на „витамин D“ означава или витамин D3 (холекалциферол), или 25 (OH) D.
Основната метаболитно активна форма на витамин D in vivo е секостероидният 1,25-дихидроксивитамин D [1,25 (OH) 2D], наричан още калцитриол. Това е 1,25 (OH) 2D, което обикновено се счита за отговорно за физиологичните функции на витамин D. Производството на 1,25 (OH) 2D се осъществява предимно в бъбреците и действието му се медиира чрез свързване с витамин D рецептор (VDR), който обикновено се намира в ядрата на целевите клетки и който регулира експресията на целевия ген, когато е свързан с 1,25 (OH) 2D (Haussler и др. 2013 ). Изследване на абстралирани с VDR мишки демонстрира множество функции на витамин D (Bouillon и др. 2013 ).
Витамин D свързващ протеин (DBP) в серума се свързва с различни метаболити на витамин D с различен афинитет (Daiger и др. 1975). Витамин D е свързан с DBP за транспортиране до съответните тъкани и за регулиране на бионаличността (Safadi и др. 1999). Обикновено
85% от циркулиращия 1,25 (OH) 2D е свързан с DBP, с
0,4% са свободно циркулиращи (Bikle и др. 1984, 1985) и
88% от циркулиращия 25 (OH) D е свързан с DBP с
0,04% безплатно (Bikle и др. 1986). Витамин D може също да се свързва с албумин и хиломикрони на липопротеините при по-нисък афинитет (Haddad и др. 1993). Въпреки че по-голямата част от циркулиращите метаболити на витамин D са свързани с DBP или албумин, понастоящем има значителен дебат относно това дали свързаните или несвързаните форми на витамин D са биологично активни (Bikle и др. 2017), като някои тъкани изискват усвояване на свързан с DBP витамин D, а други изглежда имат достъп до свободен или несвързан витамин D (Chun и др. 2014).
Потенциално значими количества витамин D са наблюдавани в кожата, черния дроб, скелетните мускули и мастната тъкан на хората (Mawer и др. 1972), с доказателства, че извънбъбречните тъкани (като плацентата) са способни да метаболизират витамин D (Weisman и др. 1979; Adams & Hewison 2012). Настоящият преглед ще се съсредоточи върху ролята на мастната тъкан, изследвайки натрупването на витамин D в това значително хранилище, като същевременно изследва потенциалните механизми, лежащи в основата на мобилизирането на витамин D от мастна тъкан в контекста на добре установени физиологични концепции.
Натрупване на витамин D в мастна тъкан
Докато мастната тъкан може да натрупва както витамин D3, така и 25 (OH) D, наличните ограничени данни предполагат, че концентрациите на витамин D3 са много по-големи (Piccolo и др. 2013; Дидриксен и др. 2015). Публикуваните стойности за количеството витамин D3, присъстващо в подкожната мастна тъкан, варират значително, вариращи от
500 ng/g, което предполага голяма индивидуална вариабилност и зависимост от състоянието на добавки (Didriksen и др. 2015). За индивид с тегло 100 kg, с 40% телесни мазнини, това може да се равнява на 160–20 000 μg витамин D3, което е еквивалентно на някъде между 16 и 2000 дни от дневния референтен хранителен прием (RNI) от общия хранителен витамин D (10 μg) за населението на Обединеното кралство (фиг. 1). Средната стойност за витамин D3 в мастната на не-допълващи хора с наднормено тегло или затлъстяване е 32 ng/g (Didriksen и др. 2015), което се равнява на 128 дни от RNI. По този начин мастната тъкан има потенциал да натрупа значително количество витамин D, особено когато мастната маса се разшири (т.е.. при наднормено тегло и затлъстяване).
Затлъстяване и състояние на витамин D
Ранните проучвания предполагат, че повишеното циркулиране на 1,25 (OH) 2D със затлъстяване намалява серума 25 (OH) D чрез намаляване на чернодробния синтез на 25 (OH) D чрез отрицателна обратна връзка (Bell и др. 1984, 1985). Съществува обаче слаба отрицателна връзка между мастната маса и циркулиращите 1,25 (OH) 2D (Parikh и др. 2004), поставяйки под въпрос съществуването на механизъм за отрицателна обратна връзка, чрез който производството и натрупването на излишък от 1,25 (OH) 2D би намалило синтеза на 25 (OH) D. Алтернативно, ниско циркулиращият витамин D при лица със затлъстяване може да се дължи на повишен метаболитен клирънс и засилено усвояване на витамин D от мастната тъкан (Liel и др. 1988). Повишеното регулиране на ензимите, отговорни за метаболизма на 25 (OH) D до 1,25 (OH) 2D, е малко вероятно да допринесе за намаляване на серума 25 (OH) D поради значително по-ниските нива на циркулация от 1,25 (OH) 2D спрямо 25 (OH) D (
1: 400) (Устни 2007). Вамберг и др. (2013) анализира експресията на редица хидроксилази на витамин D във висцералната и подкожната коремна мастна тъкан на слаби жени и жени със затлъстяване. Няма разлика в експресията на CYP24A1 (основен ензим, отговорен за катаболизирането на витамин D) между слаби индивиди и лица със затлъстяване. Оттогава подобни резултати се възпроизвеждат в група от лица със затлъстяване (Di Nisio и др. 2017). Заедно тези проучвания показват, че CYP2J2-25-хидроксилирането и 1α-хидроксилирането са нарушени, а не регулирани в мастната тъкан на лица със затлъстяване, така че не подкрепят идеята, че намалените системни концентрации на 25 (OH) D, наблюдавани при затлъстяване са причинени от повишен метаболизъм на витамин D в адипоза. Други скорошни проучвания, използващи стабилни изотопи, показват, че няма разлика в общия период на полуразпад 25 (OH) D при затлъстяване (Walsh и др. 2016). Следователно адипозът не метаболизира активно повече витамин D при лица със затлъстяване и изглежда няма ефект от затлъстяването върху общия метаболизъм и оборота на 25 (OH) D. Вместо това, най-поразителният ефект от затлъстяването изглежда е, че мастната става мивка или резервоар за витамин D.
Роля на витамин D в мастната тъкан?
Мастната тъкан включва хетерогенни клетки, включително адипоцити, различни имунни клетки и преадипоцити. Клетъчният състав на мастните въздействия върху мастното възпаление (Bourlier и др. 2008) и секрецията на възпалителни медиатори (Maury & Brichard 2010), което е особено подходящо за лица със затлъстяване, тъй като допринася за системно нискостепенно възпаление (Trim и др. 2018).
Лечение на човешки адипоцити инвитро с 1,25 (OH) 2D намалява секрецията на интерлевкин 6 (Mutt и др. 2012), което предполага, че 1,25 (OH) 2D инхибира фосфорилирането на IкBα, което има инхибиращ ефект върху NF-кB (Baeuerle & Baltimore 1988). NF-кB индуцира транскрипция на противовъзпалителни пътища (Baldwin 1996), така че витамин D е потенциално противовъзпалителен за мастната тъкан, ако е на разположение за упражняване на физиологични действия. Витамин D може също да е важен за образуването на нови адипоцити и това е прегледано подробно другаде (Dix и др. 2018). Смята се, че активираният от пероксизома пролифератор гама рецептор (PPARγ) е „главният регулатор“ на адипогенезата, като диференциацията се поддържа чрез съпътстваща експресия на PPARγ и CCAAT енхансер-свързващ протеин α (Rosen и др. 2002). Изследване на човешки преадипоцити предполага, че 1,25 (OH) 2D насърчава адипогенезата (Nimitphong и др. 2012). Нарваес и др. (2013) установяват подобни ефекти в човешките мезенхимни прогениторни клетки (hMPCs), където 1,25 (OH) 2D повишава експресията на адипогенни маркери гени, включително синтаза на мастни киселини, протеини, свързващи мастни киселини и PPARγ.
Инвитро проучванията дават интригуваща представа за потенциалните функции на витамин D в самата мастна тъкан. За съжаление се знае много малко за количеството/разпределението на метаболитите на витамин D и действията на 1,25 (OH) 2D в мастната тъкан in vivo. Освен това е важно да се отбележи, че простото измерване на витамин D3 или 25 (OH) D в проби от мастна биопсия не разкрива до каква степен активният 1,25 (OH) 2D е на разположение за биологична активност.
Потенциално положителните ефекти на витамин D върху физиологията и функцията на мастната тъкан представляват много интересна възможност за по-нататъшни изследвания. Тъй като обаче витамин D вероятно е секвестиран в липидни капчици на адипоцити, може да се очаква да упражнява физиологични ефекти в рамките на адипоза, след като бъде мобилизиран в цитозола и/или интерстициума. Интригуващ парадокс е, че при лица със затлъстяване витамин D изглежда „заклещен“ в липидните капчици на адипоцитите в непосредствена близост до места, които потенциално биха могли да се възползват, ако само биха могли да го направят бионаличен.
Физическа активност/упражнения и състояние на витамин D
Липолизата като ключов механизъм на мобилизиране на витамин D с упражнения?
По време на тренировка има повишаване на плазмения глюкагон, адреналин и предсърден натриуретичен пептид (ANP) (Galbo и др. 1975; Блум и др. 1976; Гинтелберг и др. 1977; Йезова и др. 1985; МакМъри и др. 1987; Моро и др. 2007) и намаляване на плазмения инсулин (Hodgetts и др. 1991), съпътстваща повишен кръвен поток в мастната тъкан (Thompson и др. 2012). Глюкагонът, адреналинът и ANP са стимулиращи липолитични хормони (Arner и др. 1990; Перея и др. 1995; Моро и др. 2007) и потискането на инсулина води до мощно нарастване на липолизата (Jensen и др. 1989). Това води до хидролиза на триацилглицерол от липидната капка на адипоцитите чрез действието на мастната триглицеридна липаза (ATGL) (Jenkins и др. 2004; Вилена и др. 2004; Цимерман и др. 2004) и хормоночувствителна липаза (HSL) (Vaughan и др. 1964). Упражненията на гладно или на сито състояние водят до приблизително двукратно до трикратно увеличение на липолизата на мастната тъкан (Wolfe и др. 1990; Клайн и др. 1994; Еневолдсен и др. 2004) и, когато съхраняваният триацилглицерол се хидролизира, метаболитите на витамин D също могат да се освободят от липидната капка (фиг. 3).
Липолитичният отговор на мастната тъкан при упражнения е нарушен при лица със затлъстяване. Ex vivo експланти на мастна тъкан от лица със затлъстяване показват намален максимален липолитичен отговор на адренергична стимулация в сравнение с мастна тъкан от лица без затлъстяване (Reynisdottir и др. 1994; Голям и др. 1999; Hellstrom & Reynisdottir 2000), съвпадащи с намалена генна експресия на ATGL и HSL (Голяма и др. 1999; Лангин и др. 2005; Джокен и др. 2007; Маккуейд и др. 2011). Тези констатации се подкрепят in vivo, тъй като хората със затлъстяване показват по-ниски нива на липолиза по време на тренировка, отколкото слабите контроли (Stich и др. 2000; Митендорфер и др. 2004). Въпреки че това може да предпази хората със затлъстяване от повишени циркулиращи мастни киселини (McQuaid и др. 2011), той може също да допринесе за секвестиране на витамин D. В подкрепа на това твърдение мастните експланти, взети от лица със затлъстяване, освобождават по-малко витамин D, когато се стимулират с липолитични хормони, отколкото експланти от постно управление (Di Nisio и др. 2017). В това проучване мобилизацията на витамин D е пропорционална както на липолитичния отговор (освобождаване на глицерол), така и на протеиновата експресия на бета-адренергичните рецептори (Di Nisio и др. 2017); допълнително подкрепящо схващането, че мобилизацията на витамин D е свързана по същество с липолизата.
Упражнението може също да е насочено към дисфункция на мастната тъкан при затлъстяване. Добре установено е, че увеличаването на физическата активност хронично подобрява функцията на адипоцитите (Thompson и др. 2012). Обучението с упражнения повишава чувствителността към различни медиатори като инсулин и адреналин в мастната тъкан с наднормено тегло/затлъстяване (Томпсън и др. 2012). Също така наскоро беше показано, че обучените лица показват по-голямо съдържание на протеин в липолитичните ензими в подкожната мастна тъкан на корема (Bertholdt и др. 2018). По този начин, в допълнение към острия ефект върху освобождаването на витамин D, свързан с всяка тренировка, редовното упражнение подобрява функцията на адипоцитите и способността да реагира при стимулиране, което може да включва способността да мобилизира витамин D в отговор на множество стимули (напр. обичайна физическа активност, гладуване и стрес).
Ефектът от упражненията върху мобилизирането на витамин D: Проектът VitaDEx
Друг потенциален риск по време на упражнения е променливостта в енергийния баланс и загубата на тегло поради различна степен на диетична компенсация (Turner и др. 2010), така че ще компенсираме увеличаването на енергийните разходи с предписана храна, за да компенсира напълно енергията, изразходвана по време на тренировка (като по този начин поддържаме енергийния баланс). По време на тренировките ще се следи енергийният разход, за да ни позволи да заменим изразходваната енергия с храни, които не съдържат витамин D, и ще проверим адекватността на тази енергийна заместителка чрез проследяване на промените в телесния състав чрез двойна рентгенова абсорбциометрия (DEXA). Диетичният прием ще бъде записан с 3-дневен претеглен диетичен запис през седмицата преди и през последната седмица на интервенцията, заедно с ретроспективен въпросник за честотата на храната и в двата момента за по-конкретно улавяне на хранителните източници на витамин D обичайно консумирани.
Заключения
Благодарности
Тази работа се финансира от безвъзмездна помощ от BBSRC (BB/R018928/1). KSJ и AK се поддържат от Националния институт за здравни изследвания (NIHR) Cambridge Biomedical Research Center (IS ‐ BRC ‐ 1215‐20014). Центърът за биомедицински изследвания NIHR Cambridge е партньорство между Университетските болници в Кеймбридж NHS Foundation Trust и Университета в Кеймбридж, финансиран от NIHR. Изказаните мнения са на авторите, а не непременно на NHS, NIHR или Министерството на здравеопазването и социалните грижи.
Конфликт на интереси
Авторите нямат конфликт на интереси за разкриване.
Принос на автора
AH и DT концептуализират работата; AH и DT написаха първия проект; JTG предостави първоначални интелектуални прозрения; KSJ и MH предоставиха допълнителни интелектуални прозрения; всички автори са редактирали ръкописа и всички автори са се съгласили с окончателната версия на ръкописа преди изпращането му.
- Здраво ранно възпаление на пери-панкреатичната висцерална мастна тъкан по време на диета
- Роли на периваскуларната мастна тъкан при хипертония и атеросклероза Антиоксиданти и редокс
- Полиненаситените мастни киселини набират кафява мастна тъкан с повишено съдържание на UCP и капацитет на NST
- Не само мастната тъкан за съхранение на мазнини е сложен ендокринен орган De Gruyter Science
- Безплатни пълнотекстови ефекти на NutritionDiet върху кафявата мастна тъкан при хората Систематично