Суфин Яп
1 Отдел за наследствени метаболитни заболявания, Sheffield Children’s NHS Foundation Trust, Шефилд, Великобритания
Дебора Анесли-Уилямс
2 Катедра по радиология, Медицински център Куинс, Университетски болници в Нотингам NHS, Нотингам, Великобритания
3 Отделение по радиология, болница Бомонт, Дъблин, Великобритания
Орла Хардиман
4 Отделение по неврология, болница Бомонт, Дъблин, Великобритания
5 Тринити Колидж Дъблин, Дъблин, Великобритания
Резюме
Проявата на мозъчна венозна синусова тромбоза може да бъде остра или хронична с прогресиращ клиничен ход. Диагнозата може да бъде предизвикателна и има няколко клинични синдрома, свързани с болестта. Това също е необичайно, но признато усложнение на хомоцистинурията. Описваме случай, когато ранната антикоагулация, заедно с диетична намеса, е свързана с благоприятен клиничен резултат.
Съдова оклузия, както артериална, така и венозна, е водещата причина за заболеваемост и смъртност при нелекувани пациенти с хомоцистинурия (HCU) поради дефицит на цистатионин β-синтаза (CBS). 1 Вероятността да страдате от съдово събитие е 30% преди 20-годишна възраст и се увеличава до 50% преди 30-годишна възраст при нелекувани пациенти. 1 Нелекуваните пациенти имат тежка хиперхомоцистеинемия, хиперметионинемия и хипоцистеинемия.
Мозъчно-венозната синусова тромбоза (CVST) е необичайно, но признато усложнение на нелекуваната HCU. CVST може да се прояви с неспецифични клинични прояви, включително главоболие, фокални неврологични дефицити и гърчове и може да последва прогресивен курс. 2 Описваме пациент с HCU, който е развил гърчове и еволюиращ синдром на лявото полукълбо, вторичен за CVST, и обсъждаме ролята на понижаващата хомоцистеина терапия и ранната антикоагулация за постигане на добър клиничен резултат.
Доклад за случая
24-годишен мъж има внезапна поява на преходна парестезия на десния горен крайник и слабост, свързана с преходно изтръпване от дясната страна на езика. Имаше анамнеза за тежко ляво теменно-тилно главоболие 3 дни по-рано. Преди това е бил диагностициран с пиридоксин, който не реагира на HCU чрез скрининг за новородено, и е започнал с диета с добавка на цистин, ограничена с метионин, в рамките на 6 седмици след раждането. 3 Той беше известно съединение хетерозигот за c.919G> A, p (Gly307Ser) и c.785C> T, p (Thr262Met) на гена CBS и няма други признати усложнения на HCU. 4 Съответствието на диетата с лечението първоначално е било добро, но постепенно се е влошило през 6-те години преди представянето, което е отразено от рядко вземане на кръвни проби и повишаване на нивата на свободен хомоцистин (Фигура 1).
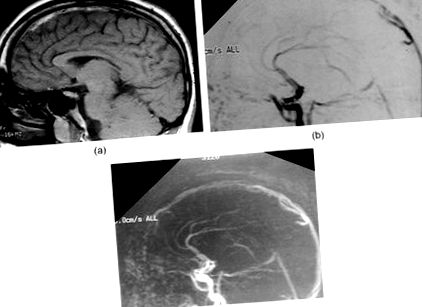
(а) Сагитално T1-претеглено изображение показва увеличен сигнал от подостър тромб в горния синус, (b) сагитален 2D PC MRV показва липса на сигнал от предните две трети от горния сагитален синус поради оклузия и (c) сагитален 2D PC MRV показва реканализация на горния сагитален синус при 6-месечно проследяване.
Първоначална клинична оценка
Физикалният преглед при постъпване в болница разкрива парализа на седмия нерв на горния двигателен неврон, лека слабост на десния горен крайник и десен разширителен плантарен отговор. През следващите 24 часа той развива генерализиран тоничен клоничен припадък, последван от влошаване на нивото на съзнанието му, афазия и развиваща се дясна хемипареза, по-изразена в горния, а не в долния крайник.
Клинични изследвания
Нивата на свободен хомоцистин (fHcy) и общ хомоцистеин (tHcy) при постъпване бяха значително повишени съответно на 86 и 290 μmol/L (норма: 0 и фигура 2). Съответният метионин е бил повишен при 102 μmol/L, а цистинът е бил нисък при 22 μmol/L. Първоначалните серумни нива на В12 и фолиевата киселина бяха нормални. Профилът му на коагулация е в нормални граници. Предишен скрининг за тромбофилия чрез мутационен анализ, включващ фактор V Leiden, термолабилна метилентетрахидрофолат редуктаза и протромбин 20210 A е отрицателен.
Диетичен прием на естествен протеин със съответстващи общи и свободни нива на хомоцистеин.
Компютърната томография (КТ) на мозъка показва разпръснати области с високо затихване върху двете париетални парасагитални изпъкналости с оток на лявото полукълбо. Ядрено-магнитен резонанс, претеглен с T1 на мозъка, показва повишен сигнал в горния сагитален синус отпред (Фигура 1 (а)), съответстващ на липса на сигнал от предните две трети от синуса при двумерна фазово-контрастна магнитно-резонансна венография (2D PC MRV; Фигура 1 (б)). Няма данни за венозен инфаркт при ЯМР въпреки фокусните неврологични находки.
Управление
Той е започнал антиконвулсантна терапия и е антикоагулиран с интравенозен хепарин, последван от варфарин, за да поддържа международно нормализирано съотношение (INR) от 2–2,5 пъти нормално. Неговият нормален диетичен (естествен) протеин е спрян, за да намали серумните нива на хомоцистеин. Постепенно беше въведен отново и титруван, за да се поддържа безсерумен хомоцистин (Фигура 2). Той се стабилизира при толеранс от 30 g диетични (естествени) на ден. Смес от аминокиселини с добавка на цистин без синтетичен метионин се дава при 1 g/kg телесно тегло. Добавката на кофактори, участващи в метаболизма на метионин, включва пиридоксин (В6) 200 mg три пъти дневно, фолиева киселина 2,5–5 mg дневно и витамин В12 4 μg три пъти дневно. Реметилиращ агент, бетаин безводен 2 g три пъти дневно, се дава за реметилиране на хомоцистеин до метионин. Предписан е калориен прием от 3000 kcal/ден за предотвратяване на катаболизма и минимизиране на хиперхомоцистеинемията.
Клиничен ход и резултат
Наблюдава се разрешаване на афазията и слабостта на лицето с почти пълно възстановяване на силата на десния горен крайник в рамките на 24–36 часа от началото на антикоагулационната и диетична терапия. Клиничният му курс е прекъснат от преходни епизоди на дизартрия и изтръпване на десния горен крайник. Въпреки че отговорът на тези събития към фенобарбитон предполагаше фокална припадъчна активност, електроенцефалограма (ЕЕГ) не показа фокални разряди. Повторният ЯМР мозък не показва разширение на тромба.
Безсерумен хомоцистин и общ хомоцистеин бяха намалени до Фигура 2). Изписан е добре с INR от 2–2,5 пъти над нормата и остава антикоагулиран в продължение на 1 година след събитието. Той е възстановил пълната си неврологична функция и остава асимптоматичен и с добър биохимичен контрол на HCU, за период на проследяване от повече от 10 години. Повторна MRI/MRV мозък при 6-месечно проследяване разкри пълна реканализация на горния сагитален синус (Фигура 1 (в)).
Дискусия
Венозната тромбоза е най-честата причина за съдови събития в HCU. 1 Това може да е представяща характеристика 2 или може да се появи при установено заболяване, както е илюстрирано от нашия пациент. CVST при млад човек без очевидни тромбофилни тенденции трябва да повдигне диагнозата HCU. По същия начин, диагнозата CVST трябва да бъде особено обмислена при тези с установена HCU.
Диагнозата на CVST може да бъде пропусната, тъй като спектърът на представяне е изключително променлив и може да бъде подвеждащ. Курсът му е непредсказуем с възможност за внезапни влошения. По този начин първата стъпка в успешното управление е да се подозира и разпознае състоянието. Нелекуваните или лошо контролирани пациенти с HCU имат предразположение за венозна тромбоза и се изисква висок индекс на подозрение за CVST.
Обосновката за антикоагулация при CVST е да се предотврати разпространението на тромб и засягане на кортикални вени. В миналото е имало повишено внимание поради съпътстващия риск от хеморагичен инфаркт. Използването на антикоагулант при CVST обаче в момента се подкрепя от много изследвания. 5 Ранното установяване на антикоагулация при нашия пациент и последващият клиничен отговор подкрепят това мнение.
Важен аспект на управлението на този случай беше ранното въвеждане на подходяща диетична терапия за понижаване на хомоцистеина. Други диетични модификации включват осигуряването на метаболитни кофактори, реметилиращ агент и достатъчно калории за предотвратяване на катаболизъм и хиперхомоцистеинемия. От съществено значение е да се поддържа свободен хомоцистин Mudd SH, Skovby F, Levy HL, et al. Естествената история на хомоцистинурия поради дефицит на цистатионин β-синтаза. Am J Hum Genet 1985; 37: 1–31. [PMC безплатна статия] [PubMed] [Google Scholar]
- Церебрална венозна синусова тромбоза (CVST) Джон Хопкинс медицина
- Мозъчна венозна тромбоза (CVT) Симптоми и лечение
- Диетична интервенция при кучешка епилепсия Два случая
- Ефекти на „плоския модел“ като част от диетичната интервенция върху модификацията на избрания
- Промени в серумния ентеролактон, генистеин и дайдзеин в диетично интервенционно проучване във Финландия