Линда Буребаба
1 Катедра по експериментална биология, Факултет по биология и животновъдство, Вроцлавски университет за науки за околната среда и живота, Norwida 27B, 50-375 Вроцлав, Полша
Майкъл Рьокен
2 Факултет по ветеринарна медицина, Клиника по конете - Хирургия на конете, Университет Justus-Liebig, 35392 Gießen, Германия
Кшищоф Марич
1 Катедра по експериментална биология, Факултет по биология и животновъдство, Вроцлавски университет за науки за околната среда и живота, Norwida 27B, 50-375 Вроцлав, Полша
2 Факултет по ветеринарна медицина, Клиника по конете - Хирургия на конете, Университет Justus-Liebig, 35392 Gießen, Германия
Резюме
Въведение: Общ преглед
Болестите на развитието на скелета на еднокопитните, които включват всяко разстройство (наследствено или придобито), което може да попречи на нормалното развитие, моделиране или ремоделиране на костите, включват широк спектър от различни състояния, които могат да се проявят като частичен или пълен провал през ранните етапи на костите или развитие на крайниците, или като хондродисплазии и остеодисплазии, които ще засегнат целия скелет. От многото признати състояния при коня, остеохондрозата се счита за мъжествена, свързана с комплекса от „ортопедични заболявания в развитието“ [1].
Остеохондрозата (ОК) е мултифокална патология, която протича както в ставно-епифизарния хрущялен комплекс (незрял ставен хрущял, покриващ краищата на растящите дълги кости), така и в растежната плоча при различни видове бозайници. Разстройството се характеризира с неуспех на ендохондралната осификация и се счита за една от най-честите основни причини за дегенеративно заболяване на ставите при домашни животни [2, 3]. Една от най-често повтарящите се прояви на ОК е остеохондрозният дисекан (OCD), който се счита за замесен в неуспех на клетъчната диференциация в растящия хрущял, което води до драматично удебеляване или задържане, поява на пукнатини и евентуална фокална загуба на хрущялни клапи ставната кухина. Откъснатите фрагменти могат да бъдат отговорни за тежко възпаление на ставите, което може да доведе до последващо развитие на вторичен остеоартрит (ОА) [4].
Първоначално терминът „остеохондрит дисеканс“ е въведен за първи път от германския хирург Франц Кьониг (1832–1910), когато провежда изследване върху разхлабени тела в ставите; той предложи три възможни основни причини за заболяването. Първите две са с травматичен произход, включително тежка фрагментация или субхондрална костна некроза, което косвено води до загуба на фрагменти. Съобщава се, че лезиите от трета категория се появяват без значителна травма и изглежда са свързани с някои други фактори [5]. След това се съобщава за OCD през 1947 г. при коне като абразия на страничния трохлеарен хребет със странична пателарна луксация. След това се наблюдават подобни лезии и се съобщава, че са остеохондрални фрактури и остеохондрит дисекани. През 1968 г. интракапсуларни костни фрагменти на дисталната част на пищяла бяха диагностицирани при няколко коня и описани по-късно като ОКР на тибиотарзалната става и хирургично отстраняване на фрагменти е полезно лечение [6]. По-късно, проучванията установяват, че тази лезия е фокусно нарушение на ендохондралния процес на осификация. В наши дни именно това последно определение е широко използвано във ветеринарната литература [5].
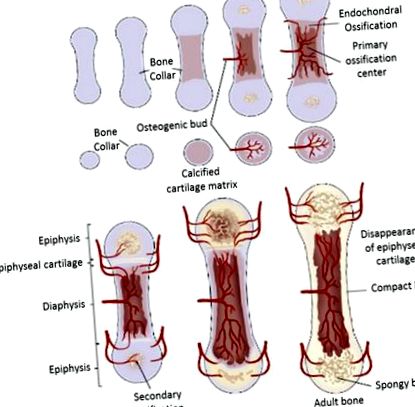
Ендохондрална осификация в здравето
Процес на осификация на дългата кост при бозайници [19]
Ако ставният хрущял започне да се дегенерира и освен това да се отдели от костната повърхност, състоянието на остеохондроза дисекан (OCD) се установява и в крайна сметка се развива свързана куцота. Редица смущаващи и отключващи фактори са свързани с патогенния процес на дисхондроплазия; в момента обаче има много малко информация относно първите стъпки, водещи до появата на първични лезии, характерни за състоянието, поради късното начало на ранните клинични признаци при засегнатите животни [20].
Етиология
Остеохондрозата (OC) се счита за първоначален процес на заболяване в развитието, което в крайна сметка води до остеохондрална фрагментация и последващо развитие на OCD. Когато се появят ранни лезии на OC, те са склонни или да се излекуват спонтанно, или да се развият в по-напреднал стадий, което води до появата на дисекционни лезии, характерни за OCD [16].
Извлечени от хрущял стволови/прогениторни клетки (CSPC)
Хрущялът е тъкан, характеризираща се с нисък потенциал за саморегенерация, когато е повреден, тъй като е аваскуларен, аневричен и кръвообращението там е слабо концентрирано в различни растежни фактори, необходими за клетъчното размножаване и регенерация. [34]. В действителност, хрущялната тъкан се характеризира с опростено структуриране, включващо само един клетъчен тип (хондроцити) и изобилен ECM с високо съдържание на влакнести протеини (главно колаген тип II) и свързващи водата, най-вече сулфатирани гликозаминогликани (sGAG) [35] . Развитието на ставния хрущял обаче се организира от каскада от молекулярни събития, регулирани от различни растежни фактори, чиито взаимодействия позволяват създаването на добре проектирана архитектура [34].
Характеризиране на CSPCs, изолирани от човешки, конски и говежди ставен хрущял. а експресия на повърхностни маркери, свързани със стволови клетки; б Свойства на CSPCs и използване за лечение на остеоартрит (OA) [41]
Когато развитието на OC (D) индуцира появата на хрущялни лезии, стволовите/предшествените клетки, пребиваващи в ставните тъкани (например синовиум), ще започнат да се самообновяват чрез асиметрично разделение, за да инициират формирането на група от функционални клетки, които ще регенерират и възстановят увредените тъкани [45]. Предишен анализ на човешкия OC ставен хрущял разкрива наличието на CSPC клетки, експресиращи редица маркери, специфични за мезенхимални прогениторни клетки, включително Stro-1, VCAM (CD166) и Notch-1; по-интересното, предварителното откриване на същия тип клетки в здравия хрущял се оказа отрицателно. Следователно тези наблюдения предполагат, че тези клетки-предшественици могат да реагират на стимули за набиране от увредени хрущяли, включително остатъци от мъртви тъкани и хромозомни протеини [46]. Впоследствие бяха изследвани няколко потенциални източника на MSC-подобни клетки, включително предимно трабекуларна кост (епифиза, метафиза), костен мозък, надкостница, синовиум, инфрапателарна мастна подложка, синовиална течност и скелетна мускулатура в жизненоважната мускулно-скелетна система на възрастни; и в по-малка степен сухожилия и сухожилия [47].
Освен това се съобщава, че транскрипционният фактор 2 (Runx2), както и определящият пола Y-box 9 (Sox9) играят решаваща роля в процесите на регулация и мобилизиране на CSPCs клетки. Следователно, фактор Sox9 представлява един от основните елементи, регулиращи синтеза на ключови компоненти, участващи в моделирането на хрущялната матрица, в съзряването на хондроцитите и в потискането на хондралния процес на осификация. От друга страна, изглежда, че Runx9 участва мъжествено в регулирането на развитието на остеобласти и следователно е от съществено значение за развитието на костите [48].
Освен факта, че MSC са клетки, получени от строма, последните са показали силна способност да синтезират и регулират различните протеини, които съставляват ECM, както и матрични метотропротеинази. Всъщност, когато тези прогениторни клетки се развиват в хондрогенна среда, последните инициират процес на диференциация и нивата на експресия на хондроспецифични протеини, агреган и хрущялен олигомерен матричен протеин (COMP), колаген II и X, се увеличават значително, това явление предполага, че би било по-изгодно да се използват вече диференцирани стволови клетки, за да се повиши ефективността на клетъчната терапия [49]. Последният напредък в регенеративната медицина направи MSC клетките перфектни кандидати за лечение на хрущялни и костни заболявания. По този начин, липсата на имунологично ко-стимулираща експресия на протеини на клетъчната повърхност и ниската експресия на основния комплекс за хистосъвместимост (MHC) II правят тези клетки лошо имуногенни; и им придават имуносупресивни и имуномодулиращи свойства, отваряйки големи перспективи при алогенни трансплантации на MSC [35].
Патофизиологични механизми в основата на развитието на OCD
По време на развитието на епифизарни и метафизарни растежни плочи OC причинява нарушение на ендохондралната осификация и последващ неуспех на съзряването на хрущяла в резултат на отсъствието на проникващи капиляри в зоната на хипертрофичния растеж. След това настъпва прекъсване на ендохондралната осификация, което води до задържане на удебелен слой хрущял. Хрущялният комплекс на растежната плоча е отслабен поради аваскуларна некроза на базалните слоеве и появата на лезии, проявяващи се като субхондрални фрактури, субхондрални кисти и фрактури на хрущялните клапи в случай на ОКР, свързваща връзка с отделянето на ставни хрущялни фрагменти с течение на времето (Фиг. 3) [56].
Схематично представяне на развитието на комплекса лезии на остеохондроза при коне и свързаните с тях фактори, участващи в патогенезата [1]
Въпреки че участието на няколко фактора в развитието на ОКР сега е широко прието; през последните години изследванията се фокусираха върху ранната патогенеза на ОК при конете, за да предоставят повече подробности за произхода му, както и за причинителите. По този начин отказът на хрущялните канали, биомеханичното срязване на остеохондралната връзка, молекулярните промени в ендохондралната осификация и генетичните основи се очертават като най-правдоподобните причини [57].
Въпреки че изглежда, че точният произход на заболяването е много сложен, може ясно да се разграничи диаграма от четири основни етапа на патофизиологичното развитие на ОКР. По време на първия етап OCD лезиите започват да се развиват на нивото на субхондралната кост, където се извършва голяма субхондрална вътрекостна остеопения. За втори път тези лезии бързо ще бъдат придружени от вътрекостен оток на субхондралната кост. Първите трабекуларни микрофактури на етапа, вероятно проявяващи се като костно натъртване, могат да корелират с едематозния морфологичен аспект на костния мозък. Така наранената тъкан ще се превърне в склеротичен пръстен, видим по радиология, ограничавайки лезиите на здрава костна тъкан и носейки център на лезии, отнасящи се до остеонекроза. От друга страна, хрущялът изглежда все още непокътнат на този етап. Еволюцията на болестта води до последващо омекотяване и промяна на механичните свойства на хрущяла, което води до освобождаване на остеохондрален фрагмент и образуване на единично хлабаво тяло или отлепване на няколко фрагмента, характерни за OCD [58].
Съдови събития в ранната остеохондроза
Промени в матрицата на хрущяла
Молекулярни събития
Когато настъпят промени в ставния хрущял, менискус, лигамент или синовиална мембрана, някои молекули могат да бъдат освободени в синовиалната течност, докато биомаркерите на костната тъкан обикновено ще бъдат освободени в кръвта, ако е включена подлежащата кост на ставата [12 ]. За да се изяснят молекулните основи на развитието на ОКР, няколко изследвания са фокусирани върху изучаването на различните биохимични промени, които могат да се появят по време на ставни заболявания, както и модела на разпределение на основните матрични молекули (тип II колаген, хрущялен олигомерен матричен протеин, големи агрегатни протеогликани, фибронектин, протеин на хрущялната матрица и бигликан) след развитието на ранни лезии, водещи до некроза на епифизарния хрущял [4]. В допълнение, значителни промени в маркерите на хрущялния оборот, участващи в метаболизма на колагена и протеогликана са демонстрирани по време на анализа на синовиалната течност или серума на жребчето с OCD [66, 72].
Матрични металопротеинази (MMP)
Хрущялен олигомерен матричен протеин
Пептид от α-спиралната област на тип II колаген (Coll2–1)
Напоследък някои маркери за разграждане на колагена като Coll2–1 са въведени в медицината за хора и еднокопитни животни за оценка на ставни заболявания [91]. Coll2–1 е пептид ([92] HRGYPGLDG [93]), разположен в тройната спирала на молекулата на колаген тип II и е специфичен за ставни заболявания, тъй като е компонент само на колаген. При различни патологии, включващи стави като OC (D) или OA, колагенът тип II, който представлява основният структурен протеин на хрущяла, съставляващ около 50% от извънклетъчния хрущялен матрикс, обикновено се разгражда от ензимни и механични действия, което води до освобождаване на фрагменти в синовиалната течност като Coll2–1 [94, 95]. Синовиалните нива на Coll2–1 при OCD и нормалните тарсокрурални стави при конете са анализирани преди това. Конете с OCD имат значително по-високи синовиални нива Coll2-1 в сравнение със здрави коне, което показва напредъка в процеса на разграждане на хрущяла в тези увредени стави; следователно се постулира, че Coll2-1 може да бъде по-ранен и по-чувствителен маркер от C2C, маркер, който обикновено се използва за откриване на дегенеративни лезии на хрущяла при коне [96].
Остеокалцин
Остеокалцинът или костният гла-протеин (BGP) е малък протеин, синтезиран от остеобласти и одонтобласти, съдържащ карбоксиглутаминови части и съставляващ по-голямата част от неколагеновата костна матрица. Много изследвания показват, че серумният остеокалцин осигурява полезен маркер на костния метаболизъм при няколко костни заболявания [97]. По време на процеса на минерализация калциевият фосфат първо се отлага в матрични везикули, получени от клетки, диспергирани в хипертрофичната зона, преди да бъде последователно преобразуван в хидроксиапатит. Освен това, скоростта на кристална пролиферация се благоприятства от изобилието на калций, фосфат, колаген и се забавя от протеогликаните и неколагеновите протеини, фиксиращи калция, като остеокалцин. Свръхпроизводството и хиперактивността на минерализационните инхибитори, представени главно от остеокалцин, водят до дефектна калцификация и задържане на хрущяла, което води до промени и увреждания на OC (D) [50]. Освен това беше установено, че серумните концентрации на остеокалцин значително корелират с тежестта на остеохондрозата при жребчетата през първата година след раждането [98].
Хондроитин сулфат 846 (CS-846)
Хондроитин сулфатът е компонент на протеогликаните на хрущяла. Епитопът на хондроитин сулфат 846 (CS846) е разположен върху страничните вериги на хондроитин сулфата близо до G3 домейна и като такъв представлява новосинтезирани агреганови молекули; освобождава се от извънклетъчния матрикс в синовиалната течност, след като се отдели от агрекановия протеин. Тези големи фетални форми на агреган присъстват естествено при младите животни, но след това намаляват в хрущяла с възрастта [12]. Хондроитин сулфат 846 (CS846) е неразделен маркер за степента на нараняване на ставите в няколко случая на DOD. CS846 с гликозаминогликан (GAG) са директни биомаркери за разграждане на протеогликан в хрущялната матрица. Особено високи нива на CS-846, открити в серума и синовиалната течност, линейно корелирани със степента на тежест на остеохондралните лезии, показват, че този епитоп е тясно свързан с OC (D) и предполагат участие на повишен синтез на хрущялен агреган и проколаген тип II по време на патофизиологичното развитие на условието [99].
Въздействие на оксидативния стрес в хода на развитието на ОКР
Реактивните кислородни видове (ROS) могат да бъдат отговорни за разграждането на няколко ключови компонента на ставния хрущял, по-специално колаген, протеогликани и хиалуронан [100]. Когато настъпи травма на ставите, клетъчните нарушения и последващото фагоцитно активиране стимулират производството на ROS, което влошава травматичното увреждане на тъканите [101]. В резултат на това ROS изглежда е широко включен в патогенезата на ставни заболявания при хора, но също така и при атлетични коне [102, 103].
Митохондриална дисфункция и стрес на ендоплазмения ретикулум
Напоследък се откриват аномалии в митохондриите и ендоплазмения ретикулум на дълбоки хрущялни тъкани. Предполага се, че нарушението на сигналния път Wnt, ключов регулатор на митохондриалната функция, типично характерен за OC конски хрущял, може да бъде отчасти отговорен за митохондриалната дисфункция.
Управление на OCD
Ставата е орган, редовно подложен на различни травматични лезии, което води до драматично и окончателно разграждане на хрущяла, който се намира в него. Бързото управление на синовит и капсулит е съществена стъпка в медицинския подход за намаляване или предотвратяване на по-нататъшно разграждане на хрущялната матрица. Лечението на ставни травматични образувания е описано с цел първо да се върне ставата в естественото й състояние по бърз и ефективен начин и второ да се предотврати появата на по-тежки усложнения, които могат да доведат до разрушаване на ставните тъкани. В случая на ОКР, медицинското лечение ще се фокусира върху отстраняване на фрагменти от остеохондрални чипове, намаляване на преобладаващите вътреставни фрактури и точно диагностициране на връзки и менискални лезии [118].
Най-широко възприетата стратегия за лечение на OCD при коне е хирургичното отстраняване на остеохондралните лезии. Когато обаче минималните лезии засягат жребчета в ранна възраст и не предизвикват никакви клинични признаци на безпокойство, продължителната почивка и рентгенографията са достатъчни за отстраняване на състоянието. Следователно артроскопската хирургия все още е необходима за най-сериозните случаи, при които може да се наблюдава куцота на животните и преобладаващо подуване на засегнатата област. По време на процедурата засегнатата става се изследва подробно, за да се открият всички възможни лезии. След това всички части на увредените стави ще бъдат премахнати (разхлабени тъкани и тела). След това се извършва дебридиране, докато остане само здрава тъкан. Специално внимание трябва да се обърне по време на отстраняването на младите жребчета, за да се избегне увреждане на субхондралната кост, която все още е мека на този етап [119].
Заключение
- Физикална терапия в Linwood за коляно - остеохондрит дисекани
- Остеохондрит Dissecans - симптоми; Лечение на костите и гръбначния стълб
- Orthomolecular Ortho Molecular Peter s Promise Peter Leeds; Болест; Отслабване
- Лятото не отслабва Славей дейности, лято, без загуба на тегло, славей фон
- Остеохондроза (OCD) в болница за животни на коне VCA