Кевал Чандарана
1 Център за изследване на затлъстяването, Медицински департамент, Университетски колеж в Лондон, Институт Рейн, Лондон, Великобритания.
Cigdem Gelegen
1 Център за изследване на затлъстяването, Катедра по медицина, Университетски колеж в Лондон, Институт Рейн, Лондон, Великобритания.
Ефтимия Кара
1 Център за изследване на затлъстяването, Катедра по медицина, Университетски колеж в Лондон, Институт Рейн, Лондон, Великобритания.
Agharul I. Choudhury
2 Група за метаболитно сигнализиране, Център за клинични науки на Съвета за медицински изследвания, Imperial College, Лондон, Великобритания.
Меган Е. Дрю
1 Център за изследване на затлъстяването, Катедра по медицина, Университетски колеж в Лондон, Институт Рейн, Лондон, Великобритания.
Вероника Фово
3 Institut Cochin, IFR Alfred Jost, Université Paris Descartes, Plate Forme de Microchirurgie, Faculté de Médecine Cochin, Париж, Франция
Беноа Виолет
4 Institut Cochin, Université Paris Descartes, Париж, Франция
5 INSERM, Париж, Франция
6 Center National de la Recherche Scientifique, UMR 8104, Париж, Франция
Фабрицио Андреели
4 Institut Cochin, Université Paris Descartes, Париж, Франция
5 INSERM, Париж, Франция
Доминик Дж. Уидърс
2 Група за метаболитно сигнализиране, Център за клинични науки на Съвета за медицински изследвания, Imperial College, Лондон, Великобритания.
Рейчъл Л. Батърам
1 Център за изследване на затлъстяването, Катедра по медицина, Университетски колеж в Лондон, Институт Рейн, Лондон, Великобритания.
Свързани данни
Резюме
ОБЕКТИВЕН
Бариатричната хирургия причинява трайна загуба на тегло. Чревните хормони са замесени в патогенезата на затлъстяването, диетичната недостатъчност и медиацията на стомашно-чревния байпас (GIBP), загуба на тегло. При мишки определихме ефектите от индуцирано от диетата затлъстяване (DIO), последващи диети и GIBP хирургия върху грелин, пептид YY (PYY) и глюкагон-подобен пептид-1 (GLP-1). За да оценим ролята на PYY в медиирането на загуба на тегло след GIBP, предприехме операция на GIBP при мишки PyyKO.
ПРОЕКТИРАНЕ И МЕТОДИ НА ИЗСЛЕДВАНИЯТА
Мъжки мишки C57BL/6, рандомизирани на диета с високо съдържание на мазнини или контролна диета, бяха убити на интервали от 4 седмици. DIO мишките преминаха към диета с ниско съдържание на мазнини ad libitum (DIO-превключвател) или ограничение на калориите (CR) в продължение на 4 седмици, преди да бъдат убити. Мишките PyyKO и техните DIO диви видове (WT) бяха подложени на GIBP или фалшива операция и бяха отбранени 10 дни следоперативно. Определят се ацил-грелин на гладно, общ PYY, активни концентрации на GLP-1, експресия на грелин в стомаха и експресия на Pyy и глюкагон в дебелото черво. Концентрациите на PYY и GLP-1 на гладно и след хранене се оценяват 30 дни след операцията в GIBP и фалшиви групи, хранени с двойки (фалшиви PF).
РЕЗУЛТАТИ
DIO прогресивно намалява нивата на ацил-грелин, PYY и GLP-1 на гладно. CR и DIO-превключвателят причиняват загуба на тегло, но не успяват да възстановят циркулиращия PYY до нивата, подходящи за теглото. След GIBP, WT мишките отслабнаха и показаха повишена циркулираща PYY на гладно и експресия на Pyy в дебелото черво и глюкагон. За разлика от това, острите ефекти на GIBP върху телесното тегло бяха загубени при мишки PyyKO. Нивата на PYY на гладно и след хранене PYY и GLP-1 бяха увеличени при GIBP мишки в сравнение с фалшиви.
ЗАКЛЮЧЕНИЯ
PYY играе ключова роля в медиирането на ранната загуба на тегло, наблюдавана след GIBP, докато относителният дефицит на PYY по време на диета може да компрометира опитите за отслабване.
Затлъстяването е глобална грижа за здравето, но нехирургичните терапии остават ограничени. Телесното тегло се контролира от сложни физиологични системи, в които хормоните сигнализират за запасите от енергия на тялото и приема на хранителни вещества към пътищата на централната нервна система, контролиращи енергийната хомеостаза. Чревните хормони играят важна роля в регулирането на телесното тегло (1) и могат да участват в патогенезата на затлъстяването (2–4). Временната връзка между развитието на затлъстяването и променените чревни хормони е неизвестна.
Диетичните модификации, като промяна на състава на макроелементите или ограничаване на приема на калории, са леченията за затлъстяване от първа линия. Поддържането на загуба на тегло обаче често е трудно (5). Индуцираните от диетата компенсаторни промени в чревния хормон могат да допринесат за неуспеха при отслабване чрез диетични средства (6). Стомашно-чревният байпас (GIBP) е ефективно лечение на затлъстяването, значително намалявайки заболеваемостта и смъртността (7). Въпреки че механизмите, залегнали в основата на ефектите от загубата на тегло на GIBP, остават до голяма степен неизвестни, промените в чревните хормони, породени от тези процедури, могат да играят причинно-следствена роля (8,9). Две хормони, замесени в патогенезата на затлъстяването, диетичната недостатъчност и ползите за загуба на тегло GIBP, са орексигенният хормон ацилгрелин и аноректичният хормон пептид YY (PYY) (8,9). Грелинът се произвежда предимно от стомаха; нивата на циркулация се увеличават по време на гладуване и намаляват след хранене (6). Ацилирането от ензима грелин O-ацил трансфераза (GOAT; mBOAT4) е от съществено значение за биологичната активност на грелин (10,11). Индуцираната от диетата загуба на тегло увеличава циркулиращия грелин, което потенциално компрометира поддържането на загуба на тегло (12). Ефектите на GIBP върху циркулиращите концентрации на грелин са противоречиви, като някои проучвания отчитат ниски нива въпреки забележимата загуба на тегло.
Пресечената форма на PYY, PYY3–36, е аноректичен хормон (1). PYY се произвежда от ентероендокринни l-клетки, намиращи се главно в дисталния стомашно-чревен тракт. Концентрациите на циркулиращ PYY3–36 се увеличават след хранене и остават повишени по време на междинния период (15). Плазмените нива на PYY са намалени при затлъстяване (3). Въпреки това, за разлика от лептина, пациентите със затлъстяване остават отзивчиви към аноректичните действия на екзогенния PYY3–36 (2). Генетичните проучвания на мишки също включват PYY в регулирането на телесното тегло: мишките PyyKO са хиперфагични и са със затлъстяване (3), докато свръхекспресиращите мишки на Pyy са защитени срещу развитието на диета и генетично затлъстяване (16). Въпреки че развитието на затлъстяване води до намаляване на циркулиращия PYY (3,4), ефектите от последвалата диета, предизвикана отслабване, са неясни (17–19). Съобщава се, че операцията с GIBP увеличава концентрациите на PYY на гладно и стимулирани от хранителни вещества (20,21). Чревните l-клетки също синтезират инкретиновия хормон глюкагон-подобен пептид-1 (GLP-1) (1). Ефектите от затлъстяването и загубата на тегло чрез диета върху циркулиращите нива на GLP-1 са неясни с докладвани променливи находки. За разлика от това, повечето проучвания съобщават, че стимулираните от хранителни вещества нива на GLP-1 се повишават след GIBP (8).
Гризачите, хранени с диета с високо съдържание на мазнини (HFD), аналогична по съдържание на мазнини и калорийна плътност на западните диети, представляват животински модел на обичайното човешко затлъстяване (22). По този начин ние изследвахме временните промени в грелин, PYY и GLP-1 и промените, които настъпват с развитието на диета, индуцирано затлъстяване (DIO) при мишки в отговор на HFD. След това оценихме ефектите от загубата на тегло, предизвикана от диетична модификация и операция GIBP върху грелин, PYY и GLP-1. За да определим ролята на PYY в медиирането на ранната загуба на тегло, наблюдавана след GIBP, предприехме GIBP при мишки PyyKO.
ПРОЕКТИРАНЕ И МЕТОДИ НА ИЗСЛЕДВАНИЯТА
Мишките се поддържат на 12-часов цикъл светлина/тъмнина (0700–1900 часа) при постоянна температура и се настаняват в специфични съоръжения, свободни от патогени. Всички проучвания са извършени в съответствие със Закона за процедурите за животните в Министерството на вътрешните работи (1986 г.) и принципите и насоките, установени от Европейската конвенция за защита на лабораторните животни. Шестседмични мъжки мишки C57BL/6 са закупени от Charles River U.K. Ltd. (Margate, UK). Мишките PyyKO и контролните мишки на котилото на фон C57BL/6 бяха генерирани и генотипизирани, както е описано по-горе (3). HFD (D12451) и диетата с ниско съдържание на мазнини (LFD) (контролна диета) (D12450B) са получени от Research Diets (New Brunswick, NJ). Диетичният състав е представен в допълнителна таблица 1.
Проучване 1: изследване на временните промени в грелин, PYY и GLP-1 с индуцирано от HFD затлъстяване.
Мъжки мишки C57BL/6, на възраст 88 седмици, бяха рандомизирани за ad libitum HFD или контролна диета (n = 40 на група). Телесното тегло се проследява седмично. Десет мишки от всяка диетична група бяха убити след 16-часово гладуване през нощта след 4, 8, 12 и 16 седмици на диетично излагане. Набрана кръв и тъкани бяха събрани, както е описано по-долу.
Проучване 2: изследване на ефектите от диетичната модификация върху грелин, PYY и GLP-1 при DIO мишки.
Мъжки мишки C57BL/6, на възраст 48 седмици, бяха рандомизирани за ad libitum HFD (n = 30) или LFD (n = 10). След 16 седмици групата с HFD беше рандомизирана в една от двете различни диетични групи в продължение на 4 седмици: продължаване на ad libitum HFD (DIO) (n = 10) или преминаване към диета за контрол ad libitum (n = 20). След преминаване към контролна диета в продължение на 1 седмица, мишките след това бяха допълнително рандомизирани или на диета/ограничение на калориите (CR), или да продължат диета за контрол ad libitum (DIO-превключвател) (n = 10). CR се извършва по понижаващ режим (23). Мишки бяха убити след 16-часово гладуване за една нощ и бяха събрани кръв и тъкани.
Проучване 3: оценка на ефектите от операция GIBP върху грелин, PYY и GLP-1 и ролята на ендогенния PYY в медиирането на загуба на тегло.
Мъжки мишки PyyKO (n = 30) и техните дичи (WT) котила (n = 30) са отбити на 3-седмична възраст. Мишките PyyKO наддават по-голямо тегло при контролна диета и HFD, отколкото техните WT сънародници (3). По този начин, за да се даде възможност за съпоставяне на теглото, 6-седмични WT мишки са започнали на HFD и мишките PyyKO продължават да контролират диетата до 14-седмична възраст, когато са преминали на HFD. На 24-седмична възраст 16 мишки, съответстващи на теглото, от всяка група бяха транспортирани до съоръжения, където трябваше да се извърши операцията. Мишките се аклиматизират в продължение на 1 седмица преди рандомизиране, за да се извърши байпас или фалшива операция (n = 8).
Мишките са гладували една нощ в продължение на 16 h предоперативно. Групата GIBP претърпя ентеро-гастро анастомоза (EGA), както е описано по-рано при изофлуранова анестезия (24). Накратко беше извършена лапаротомия по средната линия и пилорният сфинктер беше лигатуриран, последван от EGA между средната иеюнума и фундуса на стомаха, с изключение на дванадесетопръстника и проксималната йеюнум от хранителния поток (допълнителна фигура 1). Експлоатираните аналози бяха обезболени по еднакъв начин, направен е разрез по средната линия и стомахът и червата бяха изложени и манипулирани. Разрезът се държеше отворен за период от време, съответстващ на този за операцията EGA. Две мишки умряха следоперативно, една WT бутафорна и една PyyKO байпас, оставяйки седем WT фалшиви (WT.S), осем WT байпас (WT.BP), осем PyyKO фалшиви (PyyKO.S) и седем PyyKO байпас ( PyyKO.BP). Мишките се наблюдават ежедневно за общо благосъстояние и се убиват 10 дни следоперативно след 16-часово гладуване за една нощ. Бяха събрани кръв и тъкан. Пилорното лигиране беше проверено и беше непокътнато при всички EGA животни.
Проучване 4: оценка на ефектите от загуба на тегло, предизвикана от GIBP и хранене по двойки върху GLP-1 и PYY на гладно и след хранене.
Мъжки мишки C57Bl6, на възраст 8 седмици, бяха хранени ad libitum с HFD в продължение на 3 месеца. След това групите, съпоставени с теглото, бяха рандомизирани или към EGA, или към фалшиво хранене (фиктивно PF) (n = 5). Постоперативно приемане на храна на ден на мишка се наблюдава в групата на EGA и групата, хранена по двойки, получава същото количество HFD храна (фалшиво PF). Тридесет дни след операцията, мишките са гладували цяла нощ и е взето кръвотечение от опашката. Групата EGA се захранва повторно в продължение на 90 минути и се изчислява количеството консумирана храна (0,3 ± 0,1 g). Взето е кървене от опашката след хранене. Групата с фалшив PF беше захранена със същото количество храна за 90 минути и беше взето кръвотечение от опашката след хранене. Изследвани са гладни и нахранени плазмени активни GLP-1 и общите концентрации на PYY.
Терминални процедури и събиране на тъкани.
Мишки в проучвания 1–3 бяха убити чрез терминална анестезия. Кръвта се събира чрез сърдечна пункция и се обработва, както е описано по-горе (15). Стомашно-чревният тракт беше разрязан; целият стомах и 3-сантиметров участък от низходящо дебело черво бяха бързо отстранени, изчистени от перитонеума, мазнините и храносмилателното съдържание, замразени бързо в течен азот и съхранявани при -80 ° C до анализ.
Количествени PCR анализи на генната експресия.
Общата РНК се екстрахира с помощта на TRIzol реагент и 2 μg РНК се транскрибира обратно в cDNA. Количествената PCR в реално време се извършва, както е описано по-рано, като се използва патентована проба Taqman Gene Expression test FAM/TAMRA сонди (Applied Biosystems, Warrington, UK) (3).
Анализи на хормони.
Всички проби бяха пуснати в два екземпляра. За да се намали вариацията на взаимопробите, всички проби от проучвания 1 и 2 се провеждат в един анализ, както и всички проби от проучвания 3 и 4. Плазменият лептин е измерен в проучвания 1–3 като маркер за затлъстяване (25). Плазмените концентрации на лептин и активни GLP-1 бяха измерени, като се използват търговски налични ELISA комплекти (Millipore, Watford, Великобритания). Няма специфични PYY3–36 тестове за гризачи; по този начин измерихме общия PYY. Плазмените концентрации на ацилгрелин и общите PYY са измерени чрез предлаган в търговската мрежа радиоимуноанализ (Millipore, Watford, UK) (Допълнителна таблица 2 за допълнителни подробности за анализа).
Статистически анализ.
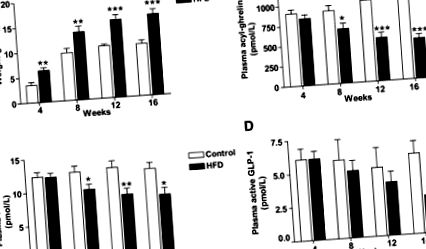
Данните са представени като средни стойности ± SEM. Сравненията между групите бяха направени с помощта на еднопосочен ANOVA с post hoc тестове на Dunnett или Student t тест, където е подходящо. За всички статистически анализи, P Фиг. 1А, Таблица 1). HFD мишките показаха очакваната хиперлептинемия на гладно (Таблица 1). Нивата на циркулиращ ацил-грелин на гладно остават стабилни с течение на времето при мишките с контролна диета, докато циркулиращият на гладно ацил-грелин постепенно намалява при HFD мишки (Фиг. 1В). Отрицателна корелация между телесното тегло и ацилгрелин се наблюдава във всички изследвани моменти от време (допълнителна фигура 2A-D). За разлика от съобщенията за намалена експресия на мРНК на стомашен грелин при DIO мишки (26-28), не са наблюдавани разлики в експресията на стоманен грелин на гладно между контролните и HFD групите (Таблица 1). Към 4-седмичния период от време имаше тенденция към обратна връзка между стомашния грелин и телесното тегло (r = -0,43, P = 0,06). Не се наблюдава разлика в експресията на Mboat4 в стомаха между HFD и контролните групи (Таблица 1). Анализът на корелацията между телесното тегло и експресията на Mboat4 на стомаха разкри обратна връзка в 4-седмичната (r = -0,48, P = 0,03; допълнителна фигура 2Е) и 8-седмичната времева точка (r = -0,49, P = 0,03; допълнителната Фигура 2F). По същия начин след 12 седмици се наблюдава тенденция към отрицателна корелация (r = −0,39, P = 0,09), но след 16 седмици няма връзка (r = 0,02, P = 0,93). Не открихме връзка между експресията на ацил-грелин в плазмата и експресията на Mboat4 в стомаха или между експресията на ацил-грелин и стомашния грелин.
Проучване 2: изследване на ефектите от диетичната модификация върху грелин, PYY и GLP-1 при DIO мишки.
Диетичната модификация, DIO-превключвател или CR, намалява телесното тегло, докато теглото остава стабилно при DIO и контролни мишки (допълнителна фигура 4А). След 4 седмици диетична интервенция, контролните и DIO-превключващите мишки имат сходни телесни тегла и CR мишките тежат значително по-малко (Фиг. 2А). Нивата на лептин на гладно отразяват телесното тегло: най-високо в групата DIO, най-ниско в групата CR и подобно при контролни и DIO-превключващи мишки (фиг. 2В).
Ефект на диетичната модификация върху телесното тегло, концентрациите на лептин, ацил-грелин, гладно, общия PYY, активния GLP-1 и експресията на стомаха на Mboat4. DIO мишките бяха рандомизирани в три групи, продължиха HFD (DIO), преминаха към контролна диета (Switch) или калорично ограничиха (CR), в продължение на 4 седмици и след това бяха убити след гладуване за една нощ. Оценяват се телесно тегло (A), плазмен лептин (B), плазмен ацил-грелин (C), експресия на Mboat4 в стомаха (D), общ плазмен PYY (E) и плазмен активен GLP-1 (F). Данните са изразени като средни стойности ± SE. n = 10. ** P Фиг. 2C). DIO-превключващите мишки са имали концентрации на ацил-грелин на гладно, междинни между тези, наблюдавани в контролната и DIO групи. Концентрациите на ацил-грелин на гладно в групата CR са сравними с тези в контролната група, въпреки че CR мишки с тегло 21,3 ± 2,0% по-малко от контролните мишки. Оценихме връзката между телесното тегло и плазмения ацилгрелин и открихме отрицателна корелация (r = -0,46, P = 0,003; допълнителна фигура 4В). Не се забелязва ефект на HFD или диетична модификация върху експресията на грелин в стомаха (експресия на грелин: контрол = 1,00 ± 0,08 произволни единици [AU], DIO = 0,94 ± 0,06 AU, DIO-превключвател = 0,94 ± 0,06 AU и CR = 0,91 ± 0,08 AU). Експресията на Mboat4 в стомаха обаче е намалена в DIO в сравнение с мишките с контролна диета (P = 0,02, фиг. 2D). Корелационните анализи не разкриват връзка между стомашния грелин, Mboat4 и циркулиращия ацилгрелин (данните не са показани).
DIO мишките са намалили общата концентрация на PYY и активната GLP-1 в циркулация в сравнение с контролните мишки (фиг. 2Е и F). Общите нива на PYY на гладно и активните GLP-1 обикновено се увеличават при DIO мишки, подложени на диетична модификация (DIO-превключвател и CR), но не достигат значимост в сравнение с DIO мишки (Фиг. 2E и F). CR мишките имат циркулиращи на гладно PYY и активни GLP-1 нива, подобни на тези, наблюдавани при контролни мишки, въпреки че тежат значително по-малко. Експресията на дебелото черво Pyy и глюкагон са сходни във всички групи (допълнителна таблица 3).
- Диета за грейпфрут за отслабване, ако следвате тази строга 10-дневна диета с ниско съдържание на въглехидрати NDTV
- Хапчета за отслабване, сварен зрял живовляк добър за отслабване Keto Advanced хапчета за отслабване Резултати и
- Хапчета за отслабване, лекарства за отслабване с рецепта, средства за подтискане на апетита
- Диетичен план за диетични програми за отслабване LloydsPharmacy
- Диета за отслабване Бързо Неапол Отслабване Slim Now MD