Алаа Елхарвили, Клаус Готлиб
Резидентура по вътрешни болести Spokane, филиал на Университета във Вашингтон. Spokane, WA, САЩ
* Автор-кореспондент: Клаус Готлиб
1314 S. Grand Boulevard # 2141 Spokane
WA 99202 САЩ
Телефон: + 1-509.455.3453
Факс: + 1-509.272.0136
Имейл: [имейл защитен]
Получено 19 август 2007 г. - Прието 25 октомври 2007 г.
Резюме
Семейната аденоматозна полипоза е архетипна болест, илюстрираща генетичната основа на човешкия рак. Генът на аденоматозната полипоза коли функционира като туморен супресор със стотици известни мутации, които водят до дефектен аденоматозен протеин на полипозната коли. В допълнение към сигурната съдба на рака на дебелото черво без колектомия, пациентите с фамилаладеноматозна полипоза също са изложени на повишен риск от други видове новообразувания, включително тези, които засягат панкреаса. Този преглед се фокусира върху периампуларни и ампуларни тумори, доброкачествени и злокачествени новообразувания на панкреаса, които са свързани със фамилна аденоматозна полипоза и синдром на Гарднър и панкреатит при тези пациенти. Предлага се индивидуален режим на наблюдение, който за някои пациенти може да включва ендоскопски ултразвук.
Ключови думи
Аденоматозна полипоза коли; Синдром на Гарднър; Болести на панкреаса; Новообразувания на панкреаса
Съкращения
APC: аденоматозен полипозен коли; FAP: фамилна аденоматозна полипоза; GS: Синдром на Гарднър
Заден план
Семейната аденоматозна полипоза (FAP) е автозомно доминиращо заболяване, характеризиращо се със стотици и хиляди аденоматозни полипи на дебелото черво, които най-често се появяват през второто и третото десетилетие от живота. Ракът на дебелото черво е неизбежен, ако дебелото черво не бъде резецирано, за щастие това състояние представлява само един процент от всички колоректални ракови заболявания. Синдромът на Гарднър (GS) е вариант на FAP с добавяне на екстраколонични лезии. Въпреки че екстратестиналните израстъци не определят генетично отделен синдром от FAP, терминът GS се използва доста често от пациентите и лекарите, когато екстраинтестиналните лезии представляват доминираща част от клиничната картина.
FAP е свързан за първи път с екстраколонични прояви през 1923 г. от Никълс, когато той описва връзката на FAP и десмоидни тумори [1]. През 1951 г. Гарднър описва FAP, свързан с редица екстраколонични израстъци, включително фиброми, остеоми и епидермоидни кисти [2]. По-късно бяха разпознати допълнителни прояви на основния генетичен дефект като аномалии на зъбите, десмоидни тумори и други лезии. Вариант на FAP, атенюиран FAP, се характеризира с по-малко полипи, по-късно поява на рак и по-ниска пенетрантност (не всички индивиди с генен дефект ще развият рак). Екстраколоничните прояви при FAP/GS пряко включват панкреаса в приблизително един процент от случаите [3]. Съобщените лезии са доброкачествени, предракови и ракови. Освен това, запушването на панкреатичния канал със или без панкреатит, причинено от доброкачествени или злокачествени тумори, не се наблюдава рядко.
Както FAP, така и GS произтичат от генни мутации на аденоматозна полипоза коли (APC) [4, 5]. Унаследяването е автозомно доминиращо с почти пълна проникване на фенотипа на дебелото черво, но променливо проникване на извън чревните прояви на заболяването. Важно е да се отбележи, че много от различните екстраинтестинални лезии корелират с мутации на специфични места на APC гена [6]. Показано е, че аденоматозата на дебелото черво, дуоденалната полипоза, рискът от рак на дебелото черво и стомаха, свързани с GS, са идентични с FAP; и ако засегнатите пациенти се изследват задълбочено, в много семейства на FAP могат да се открият излишночревни израстъци [7].
GS също не може да бъде отделен от FAP, когато се има предвид общото му разпространение. Оценките за комбинираните синдроми варират от 1 на 6 850 до 1 на 31 250 (2,29 до 3,2 случая на 100 000 души) [8, 9]. Честотата на FAP е 1 случай при 7500 живородени и се дължи на вродено наследство по менделевски доминиращ начин при 80% от пациентите. Останалите 20% представляват спонтанни мутации, без да се съобщава за фамилна анамнеза [8]. Един човек на милион население е диагностициран с GS.
GS е свързан с няколко доброкачествени извънчеревни израстъци и пациентите са изложени на повишен риск от няколко екстраколонични злокачествени заболявания. Доброкачествените екстраинтестинални израстъци включват остеоми и зъбни аномалии, кожни лезии, дезмоидни тумори, вродена хипертрофия на пигментния епител на ретината, аденоми на надбъбречните жлези и назален ангиофиброма. Следните злокачествени заболявания са описани в различни проучвания: дуоденална и периампуларна (3 до 5% от пациентите с GS), щитовидна жлеза (2%), панкреас (2%), хепатобластома (1,6%), централна нервна система (по-малко от 1% ), стомашни (0,6%), тънки черва дистално от дванадесетопръстника и надбъбречната жлеза.
Участие на панкреаса във FAP/GS
Лезиите на панкреаса, свързани или свързани с FAP/GS, са оскъдни. Следващият раздел ще направи преглед и обсъждане на различните видове панкреатични лезии, за които се съобщава във връзка или свързване с FAP/GS, включително доброкачествени, предракови, ракови и други лезии.
FAP/GS и периампуларни лезии
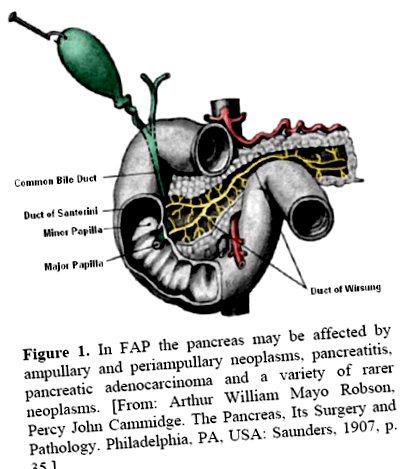
Въпреки че данните предполагат, че много, ако не и повечето ампуларни/периампуларни тумори са по-аналогични на чревните, отколкото панкреатичните новообразувания [3, 10, 11, 12], смятаме, че прегледът на ампуларни/периампуларни тумори във връзка с FAP/GS трябва да бъде включен тук върху клиничното представяне. Освен това туморите могат да се развият в по-дълбоките части на ампулата, които са облицовани от лигавицата на панкреатикобилиарния канал. Чревният тип аденокарцином и панкреатикобилиарният тип аденокарцином представляват основните хистологични видове ампуларен карцином. Интересното е, че молекулярните промени в ампуларните карциноми са подобни на тези при колоректалния, както и при панкреатичния карцином, въпреки че имат различни честоти. Освен това може да е трудно да се разграничи първична ампуларна лезия като карцином от други периампуларни тумори предоперативно [13] (Фигура 1).
Фигура 1. При FAP панкреасът може да бъде засегнат от ампуларни и периампуларни новообразувания, панкреатит, панкреатичен аденокарцином и различни по-редки новообразувания. [От: Артър Уилям Майо Робсън, Пърси Джон Камидж. Панкреасът, неговата хирургия и патология. Филаделфия, Пенсилвания, САЩ: Saunders, 1907, p. 35.]
Доброкачествените новообразувания на ампулата на Vater са редки, представлявайки по-малко от 10% от периампуларните новообразувания [14, 15]. Пациентите с FAP/GS често развиват периампуларни аденоми, които могат да прогресират до периампуларен рак, често срещана причина за смърт при тази популация. Най-честите доброкачествени лезии са вилозни и тубуловилозни аденоми. С широката наличност на гъвкава ендоскопия и широкото приложение на скринингови и надзорни програми за високорискови пациенти с FAP, ампуларните аденоми са все по-широко признати [16, 17, 18, 19, 20]. В аутопсичните серии разпространението на ампуларните аденоми се оценява на 0,04 до 0,12% [21, 22, 23].
Последователността от аденом до карцином, описана другаде в стомашно-чревния тракт, изглежда се отнася и за прогресията на ампуларните аденоми до карцином [14, 24]. Последователността аденом-карцином е морфологично разпозната в минутен карцином в аденом на папилата на Ватер [21]. Независимо от това, тези проучвания [14, 21, 24] не са предназначени да изследват конкретно прогресията до карцином при пациенти с FAP. За разлика от тях, Mizumoto et al. изследва ролята на теломеразата в прогресирането на периампуларния тумор при пациенти с FAP [25]. Установено е, че теломеразата се активира дори в нормална лигавица на пациенти с FAP и се смята, че нивото на активиране на теломеразата отразява злокачествения потенциал на тези периампуларни новообразувания.
Рискът от периампуларен рак при FAP е неясен и променливите, които предсказват появата и биологичното поведение на периампуларните тумори, не са добре разбрани. Sanabria et al. са постулирали, че появата и тежестта на периампуларните новообразувания при пациенти с FAP сегрегати в семейства [26]. Тази фамилна асоциация може да е свързана с все още неидентифицирани модифициращи гени или може би с общи фактори на околната среда.
Хората с FAP/GS могат да имат 100 до 200 пъти повишен риск от развитие на периампуларен карцином в сравнение с общата популация [27]. Честотата на ампуларните тумори се увеличава от 200 до 300 пъти сред пациентите със наследствени полипозни синдроми, като FAP и наследствен неполипозен колоректален рак [28, 29]. Влиянието на FAP върху туморогенезата и смъртността с участието на няколко органа е изследвано от Iwama et al. [30]. В това японско проучване се сравняват специфичните за органите заболеваемост и смъртност от злокачествен тумор при пациенти с FAP с тези на общата популация. Наблюдаваното/очаквано съотношение на смъртност е 250: 1 (95% доверителен интервал: 112-447) за периампуларни и тънкочревни карциноми.
Периампуларните злокачествени заболявания от чревен тип имат по-лоша прогноза от истинския ампуларен рак от панкреатичен произход. За разлика от това, при ампуларен рак от панкреатичен произход, степента на резектабилност е по-висока (над 90% в съвременните серии), а 5-годишната преживяемост е приблизително 30 до 50%, дори при пациенти с увреждане на лимфните възли [13, 31, 32].
Други предракови лезии на панкреаса, за които се съобщава във връзка с FAP/GS, включват три случая на интрадуктални папиларни муцинозни панкреатични новообразувания [33, 34, 35], два аденома на панкреатичния канал [36] и една високостепенна панкреасна интраепителна неоплазия (PanIN- 3) [37]. В последния доклад обаче не беше много ясно дали аденоматозните промени в епитела на панкреатичния канал представляват аденоматозна трансформация (немуцинозна) на основните панкреатични канали или просто разширение от съседния аденоматозен дуоденален епител. Авторите предупредиха, че са необходими повече изследвания и доклади, за да се установи ясна връзка.
Възможна генетична връзка между FAP/GS и интрадуктални папиларни муцинозни панкреатични новообразувания е изследвана от Maire et al. [33]. Пациент с FAP, представен с интрадуктален папиларен муцинозен панкреатичен тумор (IPMT). Хистологичното изследване на резецирания образец потвърждава IPMT с in situ карцином. Генетичният анализ показа загуба на дивия алел на гена APC в IPMT, причинявайки инактивиране на двата алела, показвайки, че IPMT вероятно не е инцидентен при този пациент. Дванадесет месеца след резекцията пациентът остава без рецидивиращ тумор.
Друг доклад на IPMT включва 67-годишен мъж с клинична диагноза атенюиран FAP и минала анамнеза за синхронен рак на дебелото черво в напречното дебело черво. Освен това в дванадесетопръстника са отбелязани няколко огнища на хетеротопна стомашна оксинтична лигавица, осеяна с плоски и полипоидни аденоми. Дуоденалните аденоми показват нискостепенна дисплазия и загуба на експресия на APC протеин, но задържане на бета-катениново оцветяване, локализирано в ядрото и цитоплазмата. IPMN в панкреаса показва идентичен имунохистохимичен профил с дуоденалните аденоми. Въпреки че пациентът не е показал зарязани мутационни APC мутации или мутации в гена MYH, авторите са на мнение, че миналата история, клиничните характеристики и имунохистохимичният профил на различните лезии установяват силна връзка между IPMN и FAP/GS [ 34].
Коморовски и др. [36] представят пациент с FAP/GS, който е развил полипи с карцином in situ на общия жлъчен канал и ампулата на Vater, заедно с обширни аденоматозни промени в дванадесетопръстника, жлъчния мехур, екстрахепаталните жлъчни пътища и главния панкреатичен канал.
Злокачествени заболявания на панкреаса, мутации на зародишни линии и връзка с FAP/GS
Докладите за злокачествени заболявания на панкреаса във връзка с FAP/GS са редки и включват различни клетъчни линии. Екзокринните, ендокринните и стромалните тъкани на панкреаса са докладвани като места за злокачествени заболявания във връзка с FAP/GS. Не е ясно дали има истинска връзка или връзка по стечение на обстоятелствата. Въпреки това, аденокарциномът на панкреаса е описан в различни синдроми на чувствителност към рак, свързани с мутации на зародишна линия в p16, BRCA1, BRCA2 и APC [38]. Излишно е да казвам, че повече доклади и проучвания се считат за необходими в подкрепа на връзката и/или асоциацията. Поради рядкостта на тези и други видове злокачествени заболявания, съобщени във връзка с FAP, истинската връзка ще бъде трудно да се докаже.
Оценява се, че рискът от аденокарцином на панкреаса при FAP/GS е увеличен повече от четири пъти в сравнение с общата популация (RR: 4.46; 95% CI: 1.2 до 11.4). Абсолютният риск през целия живот обаче все още е нисък - около 2%, обаче [39]. FAP се причинява от мутации в локуса на гена 5q21, но повечето карциноми на панкреаса са свързани с други мутации като K-ras (12p12), 17p, 18q (DCC локус), p53 (17p13) и др. [40, 41, 42, 43, 44, 45].
Seymour et al., McKie et al. И Ding et al. не са открити APC мутации при карциноми на панкреаса [44, 49, 50]. Gupta и Mazzara подчертават, че ракът на панкреаса обикновено има изобилна десмопластична строма, заобикаляща злокачествени жлези, и предполагат, че непропорционално вземане на проби от тази реактивна строма може да доведе до фалшиво отрицателен резултат [37].
Друг пример за екзокринен тъканен тумор във връзка с FAP/GS е ацинарният клетъчен карцином. Панкреасът е съставен предимно от ацинарни клетки, но, любопитно е, че ацинарният клетъчен карцином представлява само 1% от всички първични новообразувания на панкреаса. Първото описание на връзката на FAP/GS с ацинарно-клетъчен карцином на панкреаса е съобщено от Seket et al. [51]. 65-годишен пациент с анамнеза за FAP/GS развива напреднала дуоденална полипоза и синхронен 25 mm тумор на шийката на панкреаса. Пациентът е претърпял тотална панкреатектомия и антиректомия. Хистологичното изследване разкрива ацинарен клетъчен карцином на панкреаса и аденомите на дванадесетопръстника показва ниска и висока степен на дисплазия, но не и рак. Към днешна дата това е единственият докладван случай, показващ хистология от този характер. Stewart et al. съобщава за панкреатичен глюкагоном във връзка с FAP [52].
Панкреатобластомите са необичайни злокачествени новообразувания, които обикновено се срещат в педиатричната възрастова група, които също рядко могат да засегнат възрастни. Панкреатобластомите са клинично-патологично различни от дукталните карциноми на панкреаса при възрастни и приличат на други инфантилни ембрионални тумори. Авраам и др. описани молекулярни промени в APC/бета-катениновия път при 6 от 9 пациенти с панкреатобластоми, единият от които е с FAP мутация [53]. Те стигнаха до заключението, че панкреатобластомите могат да представляват екстраколонична проява на FAP.
Ние съобщаваме за случая на 66-годишна жена с GS, която е имала необичайно бързо растящ аденокарцином на опашката на панкреаса след процедура с Уипъл години по-рано за ампуларен карцином (непубликуван ръкопис).
FAP/GS и други неопластични лезии на панкреаса
Доброкачествените лезии на панкреаса, пряко свързани с FAP/GS, са много редки. Десмоидните тумори (наричани още десмоидна фиброматоза) са хистологично доброкачествени фиброзни новообразувания, произхождащи от мускулно-апоневротичните структури. Рядко се срещат в корема и ако са, обикновено са свързани с FAP/GS. Pho et al. съобщават за кистозна панкреатична лезия, включваща дисталния панкреас при 17-годишен мъж с известен FAP [54]. Хистопатологичното изследване на резецирания образец показва доброкачествена панкреатична киста и фиброзна плака с десмоидна фиброматоза, прилепнала към повърхността на панкреаса, серозата на стомаха и дебелото черво. Фиброзната плака е хистологично идентична с фиброзната мезентериална плака, за която се знае, че се среща при FAP и свързаната с нея мезентериална фиброматоза.
Десмоидните тумори могат да представляват малко по-различно заболяване при FAP/GS, отколкото при пациенти без APC генна мутация. Те са редки сред общата популация (5 до 6 на милион годишно) [55], но при FAP засягат от 4 до 20% от пациентите [56, 57, 58]. Когато присъства във всеки член на FAP семейство, традиционно се казва, че семейството има GS, тъй като всички членове на семейството показват една и съща APC мутация. Дезмоидните тумори могат да бъдат първата проява на GS и за някои семейства се съобщава, че имат десмоиди като единствената проява на APC мутация [59, 60]. Дезмоидните тумори при GS са моноклонални израстъци, което предполага, че те са истински новообразувания [61]. Дезмоидите в FAP също възникват от APC инактивиране и последващо натрупване на бета-катенин в клетките [62]. За разлика от него, APC мутациите са необичайни при спорадични десмоиди [63]. Съобщено е също, че високият процент на следоперативни рецидиви при интраабдоминални десмоиди в генетично предразположени случаи се различава значително от ниския процент на рецидиви след резекция на спорадични тумори [64].
Съобщава се за периампуларен карциноиден тумор при пациент с FAP няколко години след тотална колостомия [65]. Съществуват само два предишни случая на случаи, описващи карциноидни тумори във връзка с FAP. Не съществува известна генетична основа, обясняваща връзката между FAP и карциноидни тумори, но наличието на две редки образувания при един и същ пациент може да подскаже асоциация.
Панкреатит при FAP/GS
Наблюдение за панкреатични лезии при пациенти с FAP/GS
Симптомите на рак на панкреаса са неясни и често са неспецифични. Следователно, бдителността, осведомеността и повишената подозрителност от страна на клинициста представляват най-критичния подход за откриване на панкреатични лезии при пациенти с FAP/GS. Трябва да се подозира рак на панкреаса при пациенти с диабет при възрастни, които нямат предразполагащи черти или фамилна анамнеза за диабет; или при пациенти, които са имали необясним епизод на остър панкреатит. Тревожни симптоми и признаци като постоянна болка в гърба, изразена и бърза загуба на тегло, коремна маса, асцит и надключична лимфаденопатия винаги пораждат голямо съмнение за рак на панкреаса. Когато диагнозата злокачествено заболяване на панкреаса се подозира от клинични симптоми и/или констатации на ултразвук на коремната кухина, селективното използване на мултидетекторно CT сканиране с панкреатичен протокол и EUS/FNA точно ще очертае размера на тумора, инфилтрацията и наличието на метастатично заболяване в по-голямата част от дела.
- Миналото, настоящето и бъдещето на хирургията на затлъстяването Insight Medical Publishing
- Представяне на енцефалопатия на Вернике при пациент с тежък остър панкреатит Insight Medical
- Ролята на упражненията и храненето при управление на захарен диабет тип II Insight Medical
- Актуализация FDA казва, че Hill's не е спазил собствените процедури на Американската ветеринарномедицинска асоциация
- Тези 10 храни могат да помогнат за отслабване - Courtney Medical Group