Елиса Агилар-Мартинес
1 Факултет по биология, медицина и здраве, Университет в Манчестър, Манчестър, M13 9PT, Великобритания
Baoqiang Guo
1 Факултет по биология, медицина и здраве, Университет в Манчестър, Манчестър, M13 9PT, Великобритания
Андрю Д. Шарокс
1 Факултет по биология, медицина и здраве, Университет в Манчестър, Манчестър, M13 9PT, Великобритания
ADS замисли проучването. EAM, BG и ADS са проектирали експериментите. EAM и BG проведоха експериментите. EAM, BG и ADS написаха и редактираха ръкописа и се съгласиха с окончателното съдържание.
Свързани данни
Фигура 2А и В. Сурови данни. Показани са пълните уестърн петна и областите, взети за включване в панелите на фигура 2, са подчертани (обозначени с полета).
Фигура 2Б. Необработени данни. Показани са пълните уестърн петна и зоните, взети за включване в панелите на фиг. 2, са подчертани (обозначени с полета).
Данните, свързани със статията, са налични при условията на освобождаването от данни на Creative Commons Zero „Без права запазени“ (CC0 1.0 посвещение в публично достояние). http://creativecommons.org/publicdomain/zero/1.0/
Промени във версията
Преработен. Изменения от версия 1
И двамата съдии направиха няколко ценни предложения за увеличаване на яснотата на този документ. Направихме редица текстови промени и промени в цифрите, за да отговорим на повдигнатите проблеми. Промени във фигурите: Към фиг. 1C са добавени две допълнителни ленти, които показват, че нивата на мулти-SUMOylation, които наблюдаваме, са достатъчни, за да насърчат свързването на RNF4 с ETV4 (тъй като не се наблюдава свързване с не-SUMOylatable ETV4 (K1234R) мутант ). Добавен е допълнителен фигурен панел (1F), за да се демонстрира, че ETV4, модифициран със SUMO (K11R) (който не може да образува вериги), все още се свързва с RNF4 и следователно свързването се медиира от multi-SUMO. През цялото време са добавени маркери за молекулно тегло. Схемите са модифицирани, за да покажат точния брой SIM и SUMO сайтове за модификация на протеините. Промени в текста: Добавена е допълнителна дискусия относно структурните проучвания на взаимодействията RNF4-polySUMO. В допълнение се обсъждат последиците за представянето на SUMO чрез структурни промени в N-терминалната област на ETV4. Добавени са няколко методологични разяснения и е използвана по-голяма точност при описването на различните използвани RNF4 и ETV4 конструкции. Добавено е обсъждане на новите данни, показани на фигурите.
Резюме на партньорска проверка
| 2017 17 февруари | Мануел С. Родригес | Версия 2 | Одобрена |
| 2016 г. 9 дек | Мануел С. Родригес и Елиса Да Силва-Ферада | Версия 1 | Одобрен с резервации |
| 2016 г. 28 ноември | Тони Хънтър | Версия 1 | Одобрена |
Резюме
Протеин SUMOylation представлява важно регулаторно събитие, което променя дейностите на множество протеини. Последните доказателства показват, че полиSUMO веригите могат да действат като задействащ механизъм за насочване на убиквитин лигазата RNF4 към субстрати, за да предизвикат техния оборот по пътя на убиквитина. RNF4 използва множество мотиви за взаимодействие SUMO (SIM), за да се свърже с тези вериги. Въпреки това, в допълнение към polySUMO вериги, мултимерна свързваща повърхност, създадена от едновременното SUMOylation на множество остатъци върху протеин или комплекс, също може да осигури платформа за набирането на мулти-SIM протеини като RNF4. Тук демонстрираме, че multiSUMOylated ETV4 може да се свърже с RNF4 и че е необходима уникална комбинация от SIM, за да взаимодейства RNF4 с тази multiSUMOylated платформа. По този начин RNF4 може да се свърже с протеини, които са или polySUMOylated чрез един сайт, или multiSUMOylated на няколко сайта и повдига възможността такива multiSIM-multiSUMO взаимодействия да са по-широко разпространени.
Въведение
За да разширим разбирането си за мултимерни SUMO взаимодействия, ние изследвахме изискванията за свързване на RNF4 със SUMOylated ETV4 (известен иначе като PEA3 и E1AF). ETV4 е транскрипционен фактор на ETS и представлява пример за протеин с множество места за модификация на SUMO, който образува SUMOylated видове с високо молекулно тегло (Guo & Sharrocks, 2009; Nishida et al., 2007). По-рано беше показано, че SUMOylation е важен за транзактивационната активност на ETV4, но също така задейства неговото разграждане по времево забавен начин, следвайки сигнализиране, опосредствано от растежен фактор през ERK пътя (Guo & Sharrocks, 2009). Показано е, че STUbL RNF4 играе важна роля в контрола както на ETV4-медиираното активиране на целевия ген, така и на разграждането на ETV4 по пътя на убиквитина. Тук изследвахме дали multiSUMOylation може да осигури средство за стимулиране на набирането на RNF4 в ETV4. Използвайки поредица от тестове за свързване, ние показваме, че multiSUMOylation може да насърчи свързването на мулти-SIM съдържащия протеин RNF4 към ETV4.
Материали и методи
Плазмидни конструкции
Следните плазмиди бяха използвани при трансфекции на клетки на бозайници; pSG5-PIAS4 (кодиращ Myc-маркиран PIAS4) (любезно предоставен от Frances Fuller-Pace; Jacobs et al., 2007), pCDNA3-Ubc9/UBE2I, pCDNA3-His-SUMO-3 и pCDNA3-His-SUMO-3 (K11R ) (любезно предоставено от Ron Hay; Tatham et al., 2001). pAS981 (кодира маркирани с цял флаг зебра ETV4/PEA3, клонирани в сайтовете XbaI/KpnI на pCDNA3; конструиран от Аманда Гринал).
маса 1.
| ADS1580 | ATCGGGATCCATGGAGCGGAGGATGAAAGGC |
| ADS1584 | ATCGGAATTCAGTAAGAATATCCACCTCTGTG |
| ADS2581 | GCGGGGAATTCGGTAGTGGTAGTGGTAGTATGTCCGAGGAGAAGCCCAAG |
| ADS2582 | GCGGGCCATGGCTATGTCCGAGGAGAAGCCCAAG |
| ADS2583 | GTGAATCTTTAGAGCCTGCGGCTGCGGACCTGACTCACAATGA |
| ADS2584 | TCATTGTGAGTCAGGTCCGCAGCCGCAGGCTCTAAAGATTCAC |
| ADS2587 | GACTCACAATGACTCTGCTGCGGCTGCTGAAGAAAGGAGAAGGC |
| ADS2588 | GCCTTCTCCTTTCTTCAGCAGCCGCAGCAGAGTCATTGTGAGTC |
Клетъчна култура, анализ на коимунопреципитация и Western blotting
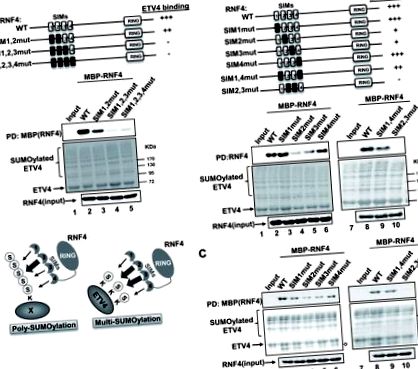
Клетките HEK293T се отглеждат в DMEM, допълнен с 10% фетален говежди серум и където е посочено, клетките се третират с форбол 12-миристат (РМА) (Sigma) (10 пМ) в продължение на 6 часа. Плазмидната трансфекция се извършва с помощта на Polyfect (Qiagen). Уестърн блотинг и имунопреципитация бяха проведени с първичните антитела; заешки поликлонален анти-RNF4 (1: 5000 подарък от Jorma Palvino; Häkli et al., 2005), миши моноклонален анти-флаг M2 (1: 2000 Sigma; F3165) и миши моноклонален анти-MBP (1: 1000 Abcam, ab49923 < Figure 2A > и 1: 1000 клетъчни сигнализиращи мишки моноклонални котка № 2396 < Figure 2B >). Протеините бяха открити, както е описано по-рано (Aguilar-Martinez et al., 2015).
Първо изследвахме дали можем да намерим доказателства за мулти- или polySUMOylation на ETV4 in vivo. Изследвахме състоянието на ETV4 SUMOylation след съвместна трансфекция на клетки с UBE2I/UBC9 и PIAS4 (за да се максимизират нивата на SUMOylation) и мутант от див тип SUMO3 или SUMO3 (K11R). Тази последна форма на SUMO не може да образува полиSUMO вериги (Tatham et al., 2001). Клетките бяха третирани с РМА, за да се повишат нивата на SUMOylation (Guo et al., 2009). Наблюдават се множество SUMO конюгати с високо молекулно тегло в присъствието на див тип SUMO3 (Фигура 1В, пътища 3 и 4) и идентичен модел на конюгация се наблюдава в присъствието на SUMO3 (K11R) (Фигура 1В, линии 5 и 6) . Възникналите многобройни ленти вероятно се дължат на комбинация от събития на едно място SUMOylation и много места SUMOylation, за да се получат видове с по-ниско подвижно молекулно тегло. По този начин, тъй като SUMO3 (K11R) дава същия модел на свързване като див тип SUMO3, множествените видове, които наблюдаваме в клетките, вероятно представляват различни комбинации от multiSUMOylated ETV4, а не polySUMOylated конюгати.
Колективно тези констатации относно взаимодействията ETV4-RNF4 установяват, че multiSUMOylation може да действа като платформа за набиране на мулти-SIM домейн, съдържащ протеин.
Фигура 1 сурови данни. Показани са пълните уестърн петна и областите, взети за включване в панелите на фигура 1, са подчертани (обозначени с полета).
Фигура 2А и В. Сурови данни. Показват се пълните уестърн петна и се подчертават областите, взети за включване в панелите на фигура 2 (обозначени с полета).
Фигура 2Б. Необработени данни. Показани са пълните уестърн петна и зоните, взети за включване в панелите на фиг. 2, са подчертани (обозначени с полета).
- Направо говорим за соята The Nutrition Source Harvard T
- Растителни диетични рецепти - 9-дневен растителен диетичен план
- Седем причини да добавите перфектен изсушен черен дроб към вашата диета - Блог за подхранващия свят
- Много шум за Фидо; s Ветеринарна болница Food Seven Hills
- Закачването на чифт червени уши е всичко, за да отслабнете без усилие - BBC