Резюме
Протеиновата модификация с малкия, свързан с убиквитин модификатор (SUMO) може да повлияе на протеиновата функция, ензимната активност, протеиново-протеиновите взаимодействия, протеиновата стабилност, насочването към протеини и клетъчната локализация. SUMO влияе върху функцията и регулирането на метаболитните ензими в рамките на пътищата и в някои случаи насочва цели метаболитни пътища, като влияе върху активността на транскрипционните фактори или чрез улесняване на транслокацията на цели метаболитни пътища в субклетъчните отделения. Модификацията на SUMO също е ключов компонент на хранителни и метаболитни сензорни механизми, които регулират клетъчния метаболизъм. В допълнение към установените си роли в поддържането на метаболитната хомеостаза, има все повече доказателства, че SUMO е ключов фактор за улесняване на клетъчните стресови реакции чрез регулиране и/или адаптиране на най-основните метаболитни процеси, включително енергиен и нуклеотиден метаболизъм. Този преглед се фокусира върху ролята на SUMO в клетъчния метаболизъм и метаболитни заболявания.
9.1 Въведение: Функции на SUMO в метаболизма
Протеиновата модификация с малкия, свързан с убиквитин модификатор SUMO може да повлияе на протеиновата функция, ензимната активност, протеиново-протеиновите взаимодействия, протеиновата стабилност, насочването към протеини и клетъчната локализация. Броят на идентифицираните сумоилирани протеини и протеини, които взаимодействат със SUMO чрез SUMO взаимодействащи мотиви (SIM), продължава да расте (Becker et al. 2013; Bruderer et al. 2011; Eifler and Vertegaal 2015; Hendriks et al. 2014; Impens et 2014; Jardin et al. 2015; Jentsch and Psakhye 2013; Kaminsky et al. 2009; Kroetz and Hochstrasser 2009; Lamoliatte et al. 2014; Makhnevych et al. 2009; Subramonian et al. 2014; Tammsalu et al. 2014, 2015; Yang and Paschen 2015; Yang et al. 2012). Подобно на други форми на пост-транслационна модификация, сега е известно, че сумоилацията участва в повечето, ако не и във всички клетъчни процеси (Flotho and Melchior 2013; Gareau and Lima 2010; Hecker et al. 2006; Makhnevych et al. 2009; Stehmeier and Muller 2009; Уилкинсън и Хенли 2010). Сумоилирането е обратима модификация: SUMO/специфичните протеини на сентрин (SENP) са способни да премахват SUMO от целевите протеини, допринасяйки за динамичен контрол на сумоилирането (Flotho and Melchior 2013; Hay 2007; Hickey et al. 2012; Mukhopadhyay and Dasso 2007; Yeh 2009).
Не е изненадващо, че сега е известно, че SUMO модифицира и влияе върху функцията и/или регулирането на специфични метаболитни ензими в рамките на пътищата и в някои случаи регулира цели метаболитни пътища, като влияе върху активността на основните контролни протеини или улеснява транслокацията на цели метаболитни пътища към субклетъчните отделения (Gareau and Lima 2010). В допълнение към установените си роли за поддържане на метаболитната хомеостаза, има все повече доказателства, че SUMO е ключов фактор за улесняване на клетъчните стресови реакции. Това се случва чрез регулиране на някои от най-фундаменталните метаболитни процеси, включително енергиен и нуклеотиден метаболизъм, и позволява физиологична адаптация в отговор на клетъчни опашки и опашки от околната среда (Enserink 2015; Makhnevych et al. 2009). SUMO е замесен в сложни човешки заболявания и аномалии в развитието, които също са свързани с хранителни и/или метаболитни смущения, включително болестта на Алцхаймер (Dorval и Fraser 2007; Hoppe et al. 2015; Lee et al. 2013, 2014b; Martins et al. 2016; McMillan et al. 2011; Sarge and Park-Sarge 2009), болестта на Паркинсон (Guerra de Souza et al. 2016) (Eckermann 2013; Krumova et al. 2011), диабет тип I (Li et al. 2005; Wang and She 2008), фамилна частична липодистрофия (Simon et al. 2013), медиирано от диабет сърдечно-съдово заболяване (Chang and Abe 2016), вродено сърдечно заболяване (Wang et al. 2011), кардиомиопатия (Kim et al. 2015c; Zhang and Sarge 2008), артрит (Yan et al. 2010), амиотрофна латерална склероза (Dangoumau et al. 2016; Foran et al. 2013; Niikura et al. 2014) и цепнатина на устната и/или небцето (Alkuraya et al. 2006; Song et al . 2008; Tang et al. 2014).
9.2 SUMO и транскрипционно регулиране на метаболитните пътища
9.2.1 SUMO и главно регулиране на липидния биосинтез
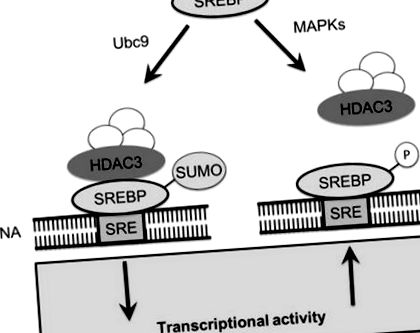
SREBP, освободени от Голджи чрез протеолиза, подлежат на допълнително ниво на регулация в ядрото чрез антагонистично взаимодействие между две посттранслационни модификации, сумоилиране и фосфорилиране (Arito et al. 2008). SREBP са цели за индуцираните от растежния хормон митоген-активирани протеинкинази (MAPKs) ERK1 и ERK2. ERK-зависимото фосфорилиране се случва в непосредствена близост до мястото на модификация на SUMO, но предизвиква много различни функционални ефекти върху активността на SREBP (Arito et al. 2008). Фосфорилирането на SREBP-2 при S455 увеличава транскрипционната му активност, докато модификацията на SUMO при K464 инхибира неговата активност (Arito et al. 2008). Показано е, че фосфорилирането и сумоилирането на SREBP-2 са конкурентни модификации; мутацията на S455 към аланинов остатък засилва сумоилирането, докато S455G мутантът SREBP-2, фосфорилиран имитатор на SREBP-2, показва нарушена сумоилация (Arito et al. 2008). Тъй като не са докладвани директни ефекти на фосфорилирането на S455 върху структурата или функцията на SREBP, физиологичната функция на фосфорилирането на S455 може да бъде за предотвратяване на сумоилирането на SREBP (фиг. 9.1).
Сумоилирането на SREBP набира ко-репресорен комплекс, който включва HDAC3. Набирането на HDAC3, съдържащ комплекс, намалява транскрипционната активност на SREBP. SUMO се изисква само за формирането на ко-репресорния комплекс, тъй като комплексът продължава да потиска, след като SUMO бъде премахнат. Алтернативно, SREBP могат да бъдат фосфорилирани от MAPK, които инхибират сумоилацията, като се конкурират за сайтове в близост до мотива на сумоилация. SREBP фосфорилирането позволява транскрипционно активиране на липидната биосинтеза чрез експресиране на гени, които съдържат елементи на стерол-отговор
Модификацията на SREBP със SUMO предизвиква функционални последици. Сумоилирането на SREBP инхибира транскрипционната активност на SREBP индиректно чрез набирането на корепресорен комплекс, който включва хистонова деацетилаза 3 (HDAC3). След набирането и установяването на репресорния комплекс, частта SREBP-2 SUMO вероятно не е от съществено значение, тъй като повечето SREBP, присъстващи в репресорния комплекс, нямат модификацията SUMO. Активността на HDAC3 влияе пряко върху липидната хомеостаза, тъй като поглъщането и експресията на LDL на LDL рецептора са повишени в HepG2 клетките, когато експресията на HDAC3 е потисната (Arito et al. 2008). Индуцираният от растежния хормон ERK-зависимо фосфорилиране на SREBPs гарантира, че липидният синтез се получава за мембранната биосинтеза по време на периоди на растеж, докато сумоилирането може да потисне липидната биосинтеза и да отслаби липидните сензорни сигнали, които произхождат от ендоплазмения ретикулум и генерират SREBP протеин.
Съществуват също доказателства, че сумоилирането на SREBP-1 играе роля в секрецията на глюког от алфа-клетките на панкреаса. Глюкагонът намалява чернодробния липиден синтез и е известно, че SREBP-1c се регулира надолу чрез гладуване. Метаболитните ефекти на глюкагона се медиират чрез сАМР-зависимата протеин киназа А (PKA). Наскоро беше демонстрирано, че SREBP-1 е един от субстратите за PKA фосфорилиране (Dong et al., 2014). По време на хранителна депривация, PKA се активира, което води до индукция на сумоилация на SREBP-1c от PIASy. Тази каскада води до повишено сумоилиране на SREBP-1, потискане на транскрипционната му активност и изключване на чернодробната липогенеза (Lee et al. 2014a). Този път представлява динамично прецизиране на транскрипционната активност на SREBP-1 в отговор на различни хранителни и хормонални промени, за да се изключи синтеза на липиди по време на гладно или хранителна депривация. По този начин сумоилирането на SREBPs играе важна роля за потискане на чернодробната липогенна програма при сигнали, предизвикани от гладуване.
9.2.2 SUMO и метаболитни ядрени рецептори
9.3 SUMO при фамилна частична липодистрофия
Фамилната частична липодистрофия (FPLD) е метаболитно разстройство, характеризиращо се с необичайна регионална и прогресивна загуба на мастна тъкан след пубертета поради дегенерация на адипоцитите. FPLD често се свързва с инсулиноустойчив диабет с acanthosis nigricans и хипертриглицеридемия. Подгрупа от случаи на FPLD, наричана също фамилна частична липодистрофия от тип Dunnigan или фамилна частична липодистрофия тип 2 (FPLD2), се причинява от мутации в гена LMNA, кодиращ структурни ядрени протеини Lamin A и C (Cao and Hegele 2000; Speckman et al. 2000). Lamin A/C е сумоилиран (Boudreau et al. 2012; Zhang and Sarge 2008) и също така свързва SUMO чрез SUMO-взаимодействащ мотив (SIM) (Moriuchi et al. 2016). Мутациите на ламин А, свързани с фамилна частична липодистрофия, променят сумилацията на ламин А (Simon et al. 2013). Мутациите, причиняващи FPLD, намаляват свързването на ламин А със SREBP1 и усилват регулирането на голям брой целеви гени на SREBP1 (Lloyd et al. 2002; Vadrot et al. 2015). По този начин е предложен модел, при който модифицирането на ламин A K486 чрез SUMO блокира свързването на взаимодействащи протеини, включително SREBP1 (Simon et al. 2013). Тези проучвания включват променено сумоилиране на ламин А при фамилна частична липодистрофия; обаче, молекулярните механизми на FPLD и метаболитните последици от промененото сумоилиране на ламин А остават да бъдат изяснени.
9.4 Метаболитна адаптация към клетъчен и оксидативен стрес
Протеинът на промиелоцитната левкемия (PML) е основният компонент и скеле от ядрени тела на PML (NB), които се събират в отговор на стрес. По време на оксидативен стрес, PML протеинът се окислява и образува медиирани от дисулфид сферични мрежи, които набират UBC9, което подобрява сумоилацията на PML (Sahin et al. 2014). Сумоилираният PML набира SUMO-свързващи протеини, които се секвестират във вътрешното ядро на NB. В отговор на оксидативен стрес, NBs насърчават сумоилирането на тези така наречени партньорски протеини (Sahin et al. 2014).
9.5 SUMO и енергиен метаболизъм
9.5.1 SUMO в мускулния метаболизъм
Сумоилиран KLF5 се намира в транскрипционно-репресивни регулаторни комплекси с несвързан PPARβ/δ и ко-репресорирепресори (Таблица 9.1). Този комплекс потиска карнитин-палмитоил трансферазата-1b (Cpt1b) и експресията на разединяващите протеини 2 и 3 (Ucp2 и Ucp3), които са регулатори на липидното окисление и енергийното разединяване съответно. Cpt1b катализира ограничаващата скоростта стъпка в митохондриалния внос на мастни киселини в митохондриите за β-окисление. Ucp2 и Ucp3 отделят окислителното фосфорилиране от генерирането на АТФ и по този начин генерират топлина, но също така функционират за регулиране на ROS, получени от митохондриите. При свързване на PPARβ/δ лиганд, KLF5 се десумоилира и се асоциира с транскрипционно активни комплекси, което води до подобряване на експресията на Cpt1b, Ucp2 и Ucp3 (фиг. 9.2). В това отношение KLF5 дезумоилирането е компонент на хранителната сигнализация в рамките на PPARβ/δ, съдържащи комплекси на транскрипционен фактор, и действа като регулаторен превключвател, медииращ транскрипционното активиране на потреблението на енергия (Oishi et al. 2008).
а) При базални условия, модифицираният SUMO KLF5 е част от ко-репресорния комплекс, който съдържа несвързан PPAR-δ. Ко-репресорният комплекс KLF5 инхибира транскрипцията на липидния ген за окисление Cpt1b и разединяването на протеиновите гени Ucp2 и Ucp3. (б) При стимулиране на PPAR-δ лиганд, KLF5 се десумоилира от SENP1, позволявайки обмен на ко-репресори за ко-активатори. (° С) Дезомоилирането на KLF индуцира взаимодействието на KLF5 и PPAR-δ, позволявайки индуциране на транскрипция на Cpt1b, Ucp2 и Ucp3
Таблица 9.1
Роля на сумоилацията в метаболизма чрез регулиране на дейностите на транскрипционните фактори
Рецепторът за активиране на ядрен рецептор пероксизомен пролифератор α (PPARα) е силно експресиран в тъкани с висока катаболна активност на мастните киселини, като скелетни мускули, черен дроб и кафява мастна тъкан, тънки черва, сърце и бъбреци. Той регулира противовъзпалителния отговор и енергийната хомеостаза в отговор на ендогенни лиганди като арахидонова киселина, както и други полиненаситени мастни киселини (Kersten 2014). Той се активира в условия на лишаване от енергия и на гладно и насърчава експресията на гени, участващи в липолизата на мастната тъкан. В допълнение към директното свързване на ДНК и регулирането на експресията на метаболитни гени, PPARs могат също да регулират експресията на гени, свързани с възпалението, като инхибират активността на други транскрипционни фактори чрез директни взаимодействия протеин-протеин. Това действие на PPAR се нарича трансрепресия. PPARα се сумоилира от SUMO-1 върху лизин 185 в шарнирната област чрез активността на Е2-конюгиращия ензим Ubc9 и SUMO E3-лигазата PIASy (Таблица 9.1). Модификацията на SUMO-1 на PPARα води до специфичното набиране на корепресор NCoR, което води до намаляване на транс-активността на PPARα и понижаване на подгрупа от целеви гени PPARα (Kim et al. 2015c; Pourcet et al. 2010).
9.5.2 SUMO в синтеза и секрецията на инсулин
9.5.3 SUMO в транспорта и метаболизма на глюкозата
9.5.4 SUMO в митохондриалната биогенеза и метаболитни заболявания
Функцията на митохондриите, включително окислителния капацитет и скоростта на окислително фосфорилиране, са намалени в скелетните мускули по време на метаболитно заболяване (Aon et al. 2014; Civitarese and Ravussin 2008). Диабет тип II, затлъстяване и инсулинова резистентност са свързани с абнормна митохондриална морфология, намалена функция и общ намален брой митохондрии (Goodpaster 2013; Kelley et al. 2002; Koves et al. 2008). Намаляването на клетъчния окислителен капацитет води до чернодробна стеатоза, което от своя страна увеличава производството на чернодробна глюкоза и хипергликемия (Anderson et al. 2009; Sonoda et al. 2007). Митохондриите са динамични органели, които непрекъснато се подлагат на делене и сливане в отговор на промени в клетъчния метаболизъм. Предполага се, че сливането на митохондрии е механизъм, чрез който непокътнатите митохондрии могат да възстановят дейностите на увредените, деполяризирани митохондрии, за да поддържат метаболитната ефективност (Mishra and Chan 2014; Twig et al. 2008). От друга страна, митохондриалната биогенеза се стимулира в отговор на увреждане на митохондриите, но също така и когато се повишат изискванията за АТФ (Frazier et al. 2006; Toyama et al. 2016). Прекомерното митохондриално делене може да причини апоптоза (Bueler 2010). Следователно регулирането на събитията на делене и сливане е от съществено значение, за да се осигури подходящ баланс между броя и качеството на митохондриите в отговор на клетъчните метаболитни нужди и/или за поддържане на метаболитния и окислителния капацитет.
9.6 SUMO и фолиево-медииран едновъглероден метаболизъм
Фолатът е В-витамин, който функционира в клетката като метаболитен кофактор, който носи и химически активира единични въглероди като три различни степени на окисление за медииран от фолат метаболизъм с един въглерод (Fox and Stover 2009). Едновъглеродният метаболизъм е метаболитна мрежа, състояща се от три взаимосвързани биосинтетични пътища: de novo синтез на пурини, de novo тимидилатен биосинтез и реметилиране на хомоцистеин за образуване на метионин (Fox and Stover 2009). Впоследствие метионинът може да бъде аденозилиран, за да образува S-аденозилметионин, който служи като кофактор за множество клетъчни реакции на метилиране в клетката, включително метилиране на хроматин (фиг. 9.3) (Fox and Stover 2009). Нарушенията в метаболизма на фолиевата киселина са свързани с множество патологии и аномалии в развитието, включително рак, сърдечно-съдови заболявания, дефекти на нервната тръба и цепнатина на небцето, въпреки че механизмите все още не са установени (Stover 2004).
Разделяне на медииран от фолат едновъглероден метаболизъм в цитоплазмата, митохондриите и ядрото. Едновъглеродният метаболизъм в цитоплазмата е необходим за de novo синтеза на пурини и тимидилат и за реметилиране на хомоцистеин до метионин. Едновъглеродният метаболизъм в ядрото синтезира dTMP от dUMP и серин. AICARTfase, аминоимидазол-4-карбоксамид рибонуклеотид трансфераза; DHFR, дихидрофолат редуктаза; GARTfase, 10-формилтетрахидрофолат: 5′-фосфорибозилглицинамид N-формилтрансфераза; MTHFD1, метилентетрахидрофолат дехидрогеназа; NADPH, никотинамид аденин динуклеотид фосфат; SHMT1, цитоплазмена серин хидроксиметилтрасфераза; TYMS, тимидилат синтаза; THF, тетрахидрофолат
Известно е, че фолат-медиираният едновъглероден метаболизъм се разделя в клетката; клетъчните фолати се намират в цитоплазмата, митохондриите и в ядрото (Shin et al. 1976). Митохондриите генерират едно въглерод под формата на формиат от катаболизма на аминокиселините серин и глицин. Форматът, получен в митохондрии, преминава към цитоплазмата, за да поддържа реакции на трансфер на един въглерод в това отделение (Fox and Stover 2009).
В клетката концентрацията на фолат-активирани едновъглеродни атоми е ограничаваща спрямо концентрацията на фолат-зависими ензими, което показва, че фолат-зависимите биосинтетични пътища се конкурират за ограничаващ пул от фолатни кофактори (Stover and Field 2011). Тази конкуренция е най-силно изразена за пътищата на биосинтез на тимидилат и метионин, които се конкурират за ограничаващ пул метилентетрахидрофолат (Herbig et al. 2002), който се генерира от редукцията на 10-формилтетрахидрофолат, катализиран от метилен-тетрахидрофолат дехидрогеназа 1 (MTHFD1) (Фиг. 9.3) (Field et al. 2014, 2015, 2016).
SHMT1 взаимодейства с няколко ядрени и свързани с ядрени пори протеини, включително Ubc9, RanBP9 и PCNA. SHMT1. Сумоилирането на SHMT1 е от съществено значение за неговото разделяне на ядрото; K38R / K39R SHMT1 мутантите не са субстрати за Ubc9-медиирано сумоилиране и тези SHMT1 мутантни протеини не се локализират в ядрото по време на S-фаза (Woeller et al. 2007). Освен това, общ вариант на SHMT1, L474F, променя интерфейса за свързване на SHMTI-Ubc9. Протеинът SHMTI L474F не е ефективен субстрат за сумоилация на Ubc9 и е нарушен при неговата ядрена локализация. Локализацията на SHMT1 в ядрото зависи от G-протеина Ran; експресията на доминиращ отрицателен RanT24N също уврежда натрупването на SHMT1 в ядрото.
SUMO-зависимото разделяне на пътя на биосинтеза на тимидилат в ядрото отчита преференциалното разделяне на метилен-тетрахидрофолат към биосинтеза на de novo тимидилат. Когато ДНК е повредена, няколко механизма за възстановяване на ДНК изискват синтез на dNTP (Mathews 2015). Излагането на култивирани клетки на ултравиолетово лъчение индуцира сумоилация на SHMT1 и локализация на ядрената пътека на биосинтеза на тимидилат, а увреждането в синтеза на ядрен тимидилат сенсибилизира клетките до индуцирана от ултравиолетовите лъчи клетъчна смърт (Fox et al. 2009; Fox and Stover 2009). Синтезата на De novo тимидилат е уникална от другите нуклеотидни биосинтетични пътища, за които се смята, че се срещат в цитоплазмата, с изключение на синтеза по време на увреждане на ДНК (Mathews 2015). Биосинтезът на ядрен тимидилат служи за ограничаване на неправилното включване на урацил в ДНК и по този начин насърчава стабилността на генома (Field et al. 2014, 2015, 2016; MacFarlane et al. 2008, 2011a, b).
9.7 Заключения
- Ролите на SUMO в метаболитното регулиране SpringerLink
- Индуцирано от пикочна киселина натрупване на липиди от хепатоцити чрез регулиране на оста miR-149-5pFGF21
- Глобалната епидемия на метаболитния синдром
- Тиреоидни хормони и метаболитен синдром - FullText - European Thyroid Journal 2013, Vol
- Възпалителният синдром Ролята на цитокините на мастната тъкан при метаболитни нарушения, свързани с