Резюме
ВЪВЕДЕНИЕ
Добре установено е, че циркулиращият хормон грелин играе важна роля в регулирането на енергийния баланс (Kojima et al. 1999; Nogueiras, Tschöp & Zigman 2008). Освободен предимно от стомаха (Dornonville de la Cour et al. 2001), грелинът предизвиква мощни орексигенни ефекти както при гризачи, така и при хора (Wren et al. 2000, 2001) чрез стимулиране на рецептора на централната нервна система (ЦНС) (Saloméet al 2009a), рецепторът на секретагога на растежния хормон (GHS-R1A) (Howard et al. 1996). Всъщност грелинът е насочен към хипоталамусните и мозъчните стволови вериги, участващи в храненето и енергийната хомеостаза (Dickson, Leng & Robinson 1993; Bailey et al. 2000; Hewson & Dickson 2000; Faulconbridge et al. 2003, 2008). Хранителното поведение обаче не е мотивирано само от необходимостта от напълване на хранителни вещества (т.е. необходимостта от възстановяване на хомеостазата); вкусните храни с високо съдържание на мазнини и/или захар могат да мотивират приема въпреки състоянието на ситост (Zheng et al. 2009). Прекомерното потребление на вкусни природни добавки като захар е основен фактор, движещ настоящата епидемия от затлъстяване. Остава да се определи дали централната система за сигнализиране на грелин е важна за нехомеостатичната консумация на захар, като по този начин осигурява потенциално важна терапевтична цел за потискане приема на калорични, вкусни и възнаграждаващи сладки храни.
Вдъхновени от скорошни открития, че грелинът взаимодейства с мезолимбични области, участващи в нехомеостатично/възнаграждаващо хранене (Jerlhag et al. 2007), ние се опитахме да оценим ролята на грелина и неговия рецептор в хранителната мотивация и целенасоченото поведение за възнаграждение на захарозата. Тези мезолимбични области отдавна са във фокуса на изследванията на наркоманиите, тъй като са основна цел за повечето злоупотреби с наркотици (Engel 1977; Koob 1992). Целевият мезолимбичен път за грелин включва допаминовата проекция от вентралната тегментална област (VTA) към ядрото на акумула (NAcc) (Jerlhag et al. 2006, 2007), път, който носи награда както от пристрастяващи химически лекарства, така и от природни награди, включително храна (Koob 1992). Интересното е, че GHS-R1A се експресира върху допаминергичните неврони (Abizaid et al. 2006), което предполага възможни директни ефекти на грелин върху VTA допаминовата система. Тези имунохистохимични данни се допълват от натрупващите се поведенчески и електрофизиологични доказателства за ефекта на грелин в VTA. Например, интра-VTA приложение на грелин увеличава активността на VTA допаминовите неврони (Abizaid et al. 2006) и увеличава освобождаването на допамин в NAcc (Jerlhag et al. 2007). Грелин също увеличава активността на холинергично-допаминергичната връзка, важен път за възнаграждение. Всъщност поне част от ефекта на грелин върху допамина изглежда се медиира от холинергичната система (Jerlhag et al. 2007).
МЕТОДИ
Животни
Възрастни мъжки плъхове Sprague-Dawley (200–250 g, река Чарлз, Германия) бяха настанени в 12-часов цикъл светлина/тъмнина с редовен чау и вода на разположение ad libitum, освен когато е посочено друго. Всички процедури с животни са извършени с етично разрешение и в съответствие с указанията на Институционалния комитет за грижа и употреба на животните в Университета в Гьотеборг.
Хирургия
Модел на кондициониране на операнта
Апарат
Експерименти с кондициониране на операнти се проведоха в осем оперантни камери за кондициониране, предназначени за плъхове (30,5 × 24,1 × 21,0 см; Medical-Associates, Джорджия, VT, САЩ), които бяха поставени в шумозаглушен, слабо осветен шкаф. Всяка камера имаше метален решетъчен под, два прибиращи се лоста с бели крушки над тях и дозатор за хранителни гранули, който може да достави пелети от 45 mg захароза (GlaxoSmithKline, Test Diet, Richmond, IN, USA) в тавата за храна. Събирането и обработката на данни се контролираха от софтуера MED-PC (Medical-Associates, Georgia, VT, USA).
Обучение
Експериментален дизайн
Всички плъхове са получили интраперитонеално (IP) или в отделна група плъхове, инжекции с трета камера (трета ICV) в началото на светлинния цикъл (за тестове за грелин) и късно в светлинния цикъл за експерименти с антагонисти на грелин 20 минути преди началото на оперантно тестване. Всички условия бяха разделени от минимум 48 часа и работеха по балансиран начин (всеки плъх получи всички условия в отделни дни за изпитване).
Експеримент 1: въздействие на периферно или централно приложение на грелин върху PR оперант, реагиращ на захароза при плъхове
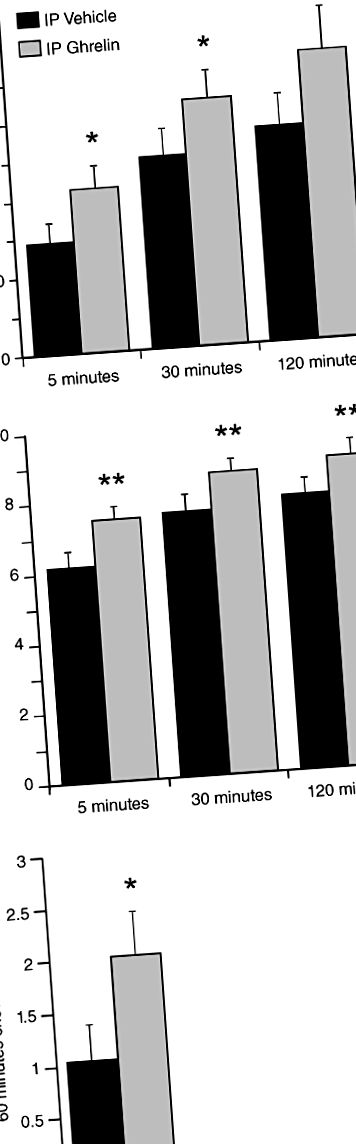
За всички плъхове реакциите на натискане на лоста бяха изследвани след две условия: IP лечение с физиологичен разтвор или ацилиран грелин от плъх (Tocris, Бристол, Великобритания; 0,33 mg/kg телесно тегло при 1 ml/kg). Досега е показано, че избраната доза IP грелин предизвиква реакция на хранене при плъхове (Wren et al. 2000) и също така предизвиква освобождаване на акумал допамин и двигателна активност при мишки (Jerlhag 2008). След тестване на операнти, на плъховете беше разрешен свободен достъп до чау и приемът на чау беше измерен след едночасов период. След това, в отделна група плъхове, ние изследвахме отговорите след целенасочено доставяне на лекарство от ЦНС след три условия, както следва: контролно състояние с физиологичен разтвор на трета камера, 0,5 µg или 1,0 µg ацилиран грелин от плъх (Tocris) в обем от 1 µl. Преди това е показано, че избраните дози грелин предизвикват реакции на хранене (Nakazato et al. 2001). Както за проучванията на ICV, така и за IP грелин, бяха проведени експерименти с натискане на лост в състояние на насищане (т.е. когато приемът на храна ще се управлява от полезните свойства на храната, а не от хомеостатичните задвижвания). Също така и в двете проучвания, след оперантно тестване, на плъховете беше разрешен свободен достъп до чау и приемът на чау беше измерен след едночасов период.
Експеримент 2: влияние на периферното или централно лечение с антагонист на грелиновия рецептор (GHS-R1A) (JMV2959) върху стимулационната мотивация за награда за захароза при плъхове
PR оперативните отговори бяха изследвани след три условия, както следва: контролно състояние с IP физиологичен разтвор, 1 mg/kg или 3 mg/kg JMV2959 (AEZS-123, AeternaZentaris GmBH, Франкфурт, Германия). Дозите JMV2959 са избрани въз основа на Jerlhag et al. (2009) и Egecioglu et al. (2010) и предварителни данни, за които преди е показано, че намаляват поведението на предпочитаното място, но не оказват независим ефект върху двигателната активност. След тестване на операнти, плъховете получиха свободен достъп до чау. За да се оценят ефектите от директното остро централно антагонистично действие, при отделна група плъхове се изследва оперантно поведение след следните три състояния: контролно състояние с инжекция с физиологичен разтвор на трета камера, 5 µg или 10 µg JMV2959 в обем от 1 µl. Избраните ICV дози от дозата JMV2959 се основават на Saloméet al. (2009a), при което е блокирано орексигенното действие на 1 µg прилаган грелин ICV. След тестване на операнти, на плъховете беше разрешен свободен достъп до чау и приемът на чау беше измерен след едночасов период, а също и на 24 часа след първоначалното инжектиране. Проучвания с GHS-R1A антагонист, за разлика от тези, извършени с грелин (вж. По-рано), са проведени на плъхове след 16-часово ограничаване на храната преди инжекциите, за да се осигурят високи нива на ендогенен циркулиращ грелин (Cummings et al . 2001).
Експеримент 3: индуцирани от грелин промени в експресията на свързани с допамин и ацетилхолин гени в VTA и NAcc
Тук определихме ефектите на хроничната инфузия на грелин с ICV за две седмици върху експресията на избрани гени, участващи в допаминергично и холинергично предаване в два ключови възли на мезолимбичен път за възнаграждение, VTA и NAcc. Избраните гени, свързани с допамин, са гени, кодиращи допаминовите рецептори (D1A, D2, D3, D5), катехол-О-метилтрансфераза, тирозин хидроксилаза (само в VTA) и моноаминова оксидаза А. Гените, свързани с ацетилхолин, са: субединици на никотиновия рецептор (α3 α6, β2, β3). Гените, които избрахме да оценим, преди това бяха замесени в ефекта на грелин и/или за възнаграждение/мотивационно поведение (Kelley et al. 2002; Figlewicz et al. 2006; Jerlhag et al. 2006, 2007; Sibilia et al. 2006; Dalley et 2007; Kuzmin et al. 2009; Lee et al. 2009; Nimitvilai & Brodie 2010; Perello et al. 2010). Използва се протокол за хронична инфузия на грелин/физиологичен разтвор за предпочитане пред острата инжекция, за да се увеличат шансовете да се види ефект върху генната експресия; освен това, ако грелинът е важен регулатор на системата за възнаграждения в дългосрочен план, насърчавайки преяждането и затлъстяването, неговите хронични ефекти за промяна на основните механизми за възнаграждение вероятно ще бъдат от голямо значение.
Прием на лекарства и дисекция на тъкани
Катетърът и осмотичната помпа бяха пълни с ацетилиран човешки грелин (подарък от Rose Pharma, Копенхаген, Дания) разтвор (8.3 µg/плъх/ден) или физиологичен разтвор (0.9% NaCl); по-рано е доказано, че тази доза и продължителността на лечението влияят върху генната експресия в хипоталамуса (Saloméet al. 2009b). Четиринадесет дни след имплантирането на минипомпите, плъховете бяха убити чрез обезглавяване. Мозъците бяха бързо отстранени и VTA и NAcc бяха дисектирани с помощта на мозъчна матрица (границите на всеки регион бяха определени въз основа на Paxinos & Watson 1986), замразени в течен азот и съхранявани при –80 ° C за по-късно определяне на експресията на иРНК.
Изолация на РНК и експресия на иРНК
Стойностите на генната експресия бяха изчислени въз основа на метода ΔΔCt (Livak & Schmittgen 2001), където третираната с физиологичен разтвор група беше определена за калибратор. Накратко, ΔCt представлява праговия цикъл (Ct) на целевия ген минус този на референтния ген и ΔΔCt представлява ΔCt на третираната с грелин група минус този на калибратора. Относителните количества бяха определени с помощта на уравнението относително количество = 2 ΔΔCt. За пробата от калибратора уравнението е относително количество = 2 −0, което е 1; следователно всяка друга извадка се изразява спрямо това. Като референтен ген се използва глицералдехид-3-фосфат дехидрогеназа.
Статистика
Експеримент 3: индуцирани от грелин промени в експресията на свързани с допамин и ацетилхолин гени в VTA и NAcc
В настоящото проучване ние също изследвахме дали гените, свързани с допамин и ацетилхолин, се променят от грелин в ключови мезолимбични възли, VTA и NAcc, чрез изследване на ефектите от лечението на хроничен централен грелин върху експресията на избрани допаминови рецептори и ензими, които участват в производството на допамин и метаболизма, в парадигма, която вече е установена за генериране на свързани с грелин промени в генната експресия в хипоталамуса (Saloméet al. 2009b). В VTA допаминовия рецептор D5 и никотиновият ацетилхолинов рецептор (nAChRβ2) имат повишена експресия на иРНК при плъхове, третирани с грелин, в сравнение с групата, лекувана с физиологичен разтвор (Фиг. 5а). В NAcc имаше намалена експресия на иРНК на гените, кодиращи допаминовите рецептори D1A, D3 и D5, както и никотиновия ацетилхолинов рецептор nAChRα3 в третираните с грелин плъхове в сравнение с групата, третирана с физиологичен разтвор (Фиг. 5b).
- Nutrition’s Vital Role in Planning Discharge Planning Gordon Food Service
- Затлъстяването и околната среда - въздействието на бързото хранене - Въпроси на общественото здраве
- Пармиджано Реджиано; s Въздействие върху хранителната култура
- Безплатни пълнотекстови интралуминални въздействия на храните Нови прозрения от MRI HTML
- NOBL Foods Кучешка храна за кучета Ние; Ве изритах глупостите!