Janice K. Kiecolt-Glaser
Департамент по психиатрия и Държавен институт за изследване на поведенческата медицина в Охайо, Медицински колеж на държавния университет в Охайо, Колумб, Охайо
Резюме
Заедно сърдечно-съдовите заболявания, ракът и диабетът представляват почти 70% от всички смъртни случаи в Съединените щати; тези заболявания споделят възпалението като обща връзка (1-2). Диетичните стратегии ясно влияят на възпалението, както е документирано както чрез проспективни наблюдателни проучвания, така и чрез рандомизирани контролирани проучвания за хранене, в които участниците се съгласяват да ядат само храната, която им е предоставена (1, 3). Всъщност, механистичните проучвания показват как различни диетични компоненти могат да модулират симпатиковата активност, оксидативния стрес, активацията на транскрипционен фактор ядрен фактор капа B (NF-кВ) и производството на възпалителни цитокини, като по този начин модифицират рисковете за здравето (4).
Поведенческите изследвания убедително демонстрират, че стресът и депресията също могат да повлияят на възпалението по същите тези пътища. Стресорите - и негативните емоции, които генерират - могат да засилят симпатиковата хиперактивност, да стимулират оксидативен стрес, да увеличат активирането на NF-κB и да стимулират производството на възпалителни цитокини (5-7).
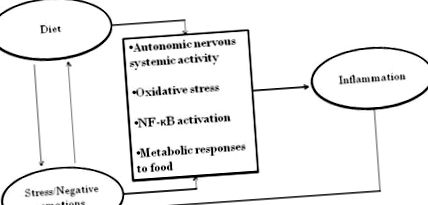
Ако съвместният принос на диетата и поведението към възпалението бяха просто добавки, те със сигурност биха били важни. След кратък преглед на независимия принос на диетата и поведението към възпалението, ще бъдат обсъдени няколко много по-интригуващи интерактивни възможности: стресът влияе върху избора на храна; стресът засилва дезадаптивните метаболитни реакции към нездравословни храни; диетата може да повлияе на настроението, както и на възпалителните реакции на стреса - и още, както е показано на фигура 1. Доказателствата, че уязвимостите не са просто добавки, предоставят прозорец за разглеждане на нови мултидисциплинарни перспективи.
Забележителни двупосочни връзки между психологически, диетични и биологични пътища до възпаление.
Диета и възпаление
Диетите, които насърчават възпалението, са с високо съдържание на рафинирани нишестета, захар, наситени и транс-мазнини и ниско съдържание на омега-3 мастни киселини, естествени антиоксиданти и фибри от плодове, зеленчуци и пълнозърнести храни (1). Например, жените в здравното проучване на медицинските сестри, които са се хранили с „западни диети“ (с високо съдържание на червено и преработено месо, сладкиши, десерти, пържени картофи и рафинирани зърнени храни) са имали по-висок CRP, IL-6, E-селектин, sVCAM- 1 и sICAM-1 от тези с „благоразумен“ модел, характеризиращи се с по-висок прием на плодове, зеленчуци, бобови растения, риба, птици и пълнозърнести храни (8).
По-нататъшната работа от здравното проучване на медицинските сестри ясно свързва консумацията на транс-мастни киселини с по-високо възпаление; например, CRP е бил 73% по-висок при жените в най-високия квинтил на потребление в сравнение с тези в най-ниския квинтил, а нивата на IL-6 са били 17% по-високи в най-високите в сравнение с най-ниските квинтили (9). Връзката между консумацията на транс-мазнини и възпалението е надеждна констатация в редица контролирани проучвания и наблюдателни проучвания (3).
Счита се, че антиоксидантните свойства на зеленчуците и плодовете са един от основните механизми в основата на техния противовъзпалителен хранителен принос (1). Оксиданти като супероксидни радикали или водороден пероксид, които се произвеждат по време на метаболизма на храната, могат да активират NF-κB пътя, стимулирайки възпалението (4). По-високият прием на плодове и зеленчуци е свързан с по-нисък оксидативен стрес и възпаление (1, 4). В действителност, някои доказателства сочат, че добавянето на антиоксиданти или зеленчуци може да ограничи или дори да обърне провъзпалителните реакции към ястия с високо съдържание на наситени мазнини (1, 10).
Пълнозърнестите храни са по-здравословни от рафинираните, тъй като процесът на рафиниране на въглехидратите води до елиминиране на голяма част от фибрите, витамините, минералите, фитонутриентите и незаменимите мастни киселини (1). Освен това, рафинираните нишестета и захари могат бързо да променят нивата на кръвната глюкоза и инсулин (1), а постпрандиалната хипергликемия може да увеличи производството на свободни радикали, както и на възпалителни цитокини (11). Лекарствата, използвани за регулиране на постпрандиалната глюкоза при диабетици, също подобряват оксидативния стрес, активирането на NF-κB и възпалението, потвърждавайки значимостта на този път (12).
Няколко направления на изследване са включили възпалението в патофизиологията на депресията (13-14). От тази гледна точка диетите за повишаване на възпалението могат да подхранват депресивните симптоми - и по този начин могат да стимулират възпалението по описаните по-долу пътища. Всъщност една скорошна статия предполага, че средиземноморският хранителен режим е потенциално защитен за предотвратяване на депресивни разстройства (15). По този начин диетата влияе върху възпалението, а свързаното с диетата възпаление от своя страна може да насърчи депресията - и, както е описано по-долу, депресията от своя страна може да ускори възпалението.
Депресия, стрес и възпаление
Психосоциалният стрес и депресията допринасят за по-голям риск от инфекция, продължителни инфекциозни епизоди и забавено заздравяване на рани, всички процеси, които могат да подхранват производството на възпалителни цитокини (16). Стресът и депресията обаче могат директно да провокират производството на възпалителни цитокини при липса на инфекция или нараняване (17-18). В допълнение, както клиничната депресия, така и субсиндромалните симптоми на депресия могат да сенсибилизират или насочат възпалителния отговор, като по този начин ефективно насърчават по-големи увеличения на цитокините в отговор на стресови фактори, както и антигенно предизвикателство (19-20). Освен това депресията и стресът променят здравословното поведение, свързано с възпалението; например нарушен сън, общ отговор на негативни емоции и емоционален стрес, насърчава производството на IL-6 (21). Съответно, депресията и стресът могат ефективно да модулират секрецията на провъзпалителни цитокини както директно, така и индиректно. По тези пътища депресията и стресовите преживявания допринасят както за острата, така и за хроничната провъзпалителна продукция на цитокини (22-23).
Изглежда, че NF-κB е основен мост за индуцираните от стреса увеличения на провъзпалителните цитокини и гените, които контролират тяхната експресия (5). Например, активността на NF-κB се повишава с 341% в рамките на 10 минути след лабораторен стрес (5). Тези промени, свързани със стреса в активността на NF-κB, са в съответствие с други доказателства, че стресът може да стимулира проинфламаторната генна експресия в мононуклеарните клетки в периферната кръв (PBMC) (24-25). Свързаното със стреса повишение на норепинефрин провокира NF-κB активиране, един пряк път от ендокринната система до възпаление (5).
Хроничните стресови фактори могат директно да провокират дългосрочни промени в производството на възпалителни цитокини, както и индиректно, чрез насърчаване на оксидативен стрес, който активира NF-κB пътя. Например, шестгодишно надлъжно проучване показа, че средногодишният темп на нарастване на серумния IL-6 е около четири пъти по-голям при мъжете и жените, които са били хронично стресирани от грижи за съпруг/съпруга с деменция, в сравнение с подобни лица без грижи отговорности (23). В извадка от майки, които се грижат за хронично болно дете, както и майки за здрави деца, по-високите съобщения за стрес са свързани с по-висока активност на оксидативен стрес, измерена чрез нива на F2-изопростани (6). По този начин стресът и депресията могат да засилят симпатиковата хиперактивност, да стимулират оксидативен стрес, да увеличат активирането на NF-κB и да стимулират производството на възпалителни цитокини (5-7). Както е описано по-долу, полиненаситените мастни киселини (PUFAs) също действат по същите пътища, за да повлияят на възпалението.
Диетични влияния върху настроението и възпалителните стресови реакции: Омега-3 и Омега-6
Ейкозаноиди, получени от арахидонова киселина (AA) (омега-6 или n-6) (предимно от рафинирани растителни масла като царевица, слънчоглед и шафран) увеличават производството на провоспалителни цитокини IL-1, TNF-α и IL-6, действащи като предшественици на провъзпалителните ейкозаноиди от простагландин (PG) 2-серия (26-27). За разлика от тях, омега-3 (n-3) ПНЖК, открити в рибите, рибеното масло, орехите, пшеничните зародиши и някои хранителни добавки като продукти от ленено семе, могат да ограничат производството на ейкозаноиди, получени от АА (26-27). N-6 и n-3 PUFAs се конкурират за едни и същи метаболитни пътища и следователно балансът им е важен (28). Съответно, не е изненадващо, че както по-високите нива на n-3 PUFA, така и по-ниските съотношения n-6: n-3 са свързани с по-ниско производство на възпалителни цитокини (29).
Въз основа на връзките между депресията и възпалението (13-14), разумно е да се очаква, че приемът на диети n-3 и n-6 може да бъде свързан с депресия. Всъщност епидемиологичните проучвания показват значителна обратна връзка между годишната консумация на риба и голяма депресия - колкото повече се яде риба, толкова по-ниска е честотата на сериозна клинична депресия (30). Редица изследователи са показали, че пациентите с депресия имат средно по-ниски плазмени нива на n-3, отколкото недепресирани индивиди; освен това те откриха доказателства, че по-голямата тежест на депресията е свързана с по-ниски нива на n-3 (31). Нещо повече, редица добре контролирани проучвания за лечение на депресия са открили терапевтични ползи след добавяне на n-3, въпреки че има и изключения (31). По този начин тези диетични пътища имат последици както за поведението, така и за възпалението.
Две ключови n-3 PUFAs, ейкозапентаенова киселина (EPA) и докозахексанова киселина (DHA), могат значително да намалят LPS-индуцираната експресия на TNF-α, като блокират активирането на NF-κB (32-33). Нещо повече, EPA може също така да намали LPS-индуцираната TNF-α mRNA in vitro, като модулацията на експресията на TNF-α се проявява на транскрипционно ниво (32). Освен това, както е описано по-рано, окислителите и окислените клетъчни компоненти могат да активират NF-κB пътя, стимулирайки възпалението (4); n-3 PUFA също намаляват оксидативния стрес (34-35). По този начин инхибирането на n-3 PUFA на транскрипционната активност на NF-κB може да повлияе на експресията на провъзпалителни гени.
Храненето с високо съдържание на мазнини може да стимулира нискостепенна ендотоксемия, т.е. повишаване на бактериалните ендотоксини, възпалителни антигени, които обикновено се намират в циркулация при ниски концентрации в кръвта (36). Ястията с високо съдържание на мазнини също могат да предизвикат NF-κB активиране в PBMC (37). Важно е, че данните от ендотоксиновите предизвикателства показват, че n-3 PUFAs могат да намалят тези реакции, като същевременно модулират промените в осите на хипоталамо-хипофизарно-надбъбречната (HPA) и симпатико-надбъбречно-медуларната (SAM) оси.
Прилагането на бактериален ендотоксин (LPS) повишава активирането на NF-κB и предизвиква остри поведенчески, невроендокринни и възпалителни промени; характерното покачване на симптомите на отрицателно настроение след ендотоксиново предизвикателство е използвано като поведенчески модел на депресия (38). Рибеното масло (което съдържа EPA и DHA) променя тези реакции (39-40). Например, повишенията на плазмените ACTH, норепинефрин и TNF-a са съответно четирикратно, седемкратно и двукратно по-ниски след интравенозна емулсия на мазнини от рибено масло преди приложението на LPS в сравнение с тези, рандомизирани за липса на лечение; рибеното масло също притъпява повишаването на телесната температура в сравнение с контролите (40). Субектите, които са получавали n-3 добавки в продължение на 3-4 седмици преди ендотоксиново предизвикателство, са имали по-ниски реакции на норепинефрин, ACTH, плазмен кортизол и телесна температура в сравнение с отговорите на същите пациенти след плацебо лечение; разликите в TNF-α и IL-6 не са били значими при тази малка извадка от 15 субекта (39). Въпреки че настроението не е оценено в нито едно от тези проучвания, диетичните n-3 мастни киселини атенюират LPS-индуцираното депресивно поведение при мишки (41).
Паралелно и разширяване на данните за ендотоксините, други доказателства предполагат, че n-3 PUFAs могат да повлияят на имунния отговор на психологически стресори. Например, студенти по медицина, които са имали по-ниски серумни n-3 или по-високи n-6: n-3 съотношения преди изпити, демонстрират по-голямо производство на TNF-α и IFN-γ чрез LPS-стимулирани периферни кръвни левкоцити (PBLs) по време на изпитите, отколкото тези с по-високи n-3 или по-ниски съотношения (26).
Освен това, друго проучване с възрастни възрастни предполага, че депресивните симптоми и съотношенията n-6: n-3 са работили заедно, за да засилят възпалението извън приноса, предоставен само от двете променливи (28). Въпреки че прогнозираните нива на цитокини са били доста последователни при съотношения n-6: n-3 с ниски депресивни симптоми, по-високи съотношения n-6: n-3 са свързани с прогресивно повишени нива на TNF-α и IL-6, тъй като симптомите на депресия се увеличават. Съответно, тези проучвания (26, 28) предполагат, че диетата може да повлияе на степента на възпалителни реакции на стрес и депресия, както и на настроението.
Стресът влияе върху избора на храна
Както лабораторните, така и епидемиологичните проучвания показват, че депресията и стресовите събития мотивират по-малко здравословен избор на храна, въпреки че може да има по-голям риск, свързан с това, че сте жени, с наднормено тегло и високи резултати при ограничаване на диетата (42-43). Например стресът и депресията са свързани с по-малко консумация на пресни плодове, както и с по-голям прием на закуска сред китайски студенти (44). Студентки (но не мъже) в Германия, Полша и България, които съобщават за по-голям стрес, ядат повече сладкиши и бързи храни и по-малко плодове и зеленчуци от тези, които са по-малко под стрес (45). Надлъжните данни от проучването на здравните специалисти показват, че мъжете намаляват приема на зеленчуци след развод или загуба и увеличават консумацията след повторен брак (46). По този начин, като цяло, стресът и депресията насърчават по-малко здравословен избор на храна, който може да засили възпалението. Стресът усложнява проблема чрез насърчаване на неблагоприятни метаболитни реакции към нездравословни ястия, описани по-долу.
Стресът влияе на метаболитните реакции на храната
В рамките на един час от яденето на храна с високо съдържание на наситени мазнини, циркулиращите триглицериди се повишават и могат да останат повишени в продължение на 5 до 8 часа (47). Постпрандиалната липемия (необичайно високи липиди след хранене) е свързана с диабет тип II, метаболитен синдром, затлъстяване и повишен сърдечно-съдов риск (47). Освен това, когато храненията с високо съдържание на мазнини заливат тялото с глюкоза и триглицериди, те провокират скокове в IL-6 и CRP, като същевременно засилват оксидативния стрес и симпатиковата хиперактивност; наречен постпрандиален дисметаболизъм, тази каскада насърчава ендотелната дисфункция и по този начин атерогенезата (48). Постпрандиалната липемия може да представлява или по-високи пикове след хранене, или закъснения в клирънса, всеки от които може да насърчи натрупването на богати на атерогенни триглицериди остатъчни липопротеини (49). Важното е, че стресът едновременно засилва пиковете след хранене и забавя изчистването.
Например, едно проучване показа, че почасовият психически стрес значително увеличава постпрандиалната липемия; общата площ на триглицерола (TG) и липопротеините-TG с много ниска плътност под кривата са 50% или повече по-високи по време на стрес, отколкото при контролни условия (50). В елегантно проучване от Стоуни и колеги, остър стрес също забавя клирънса на триглицеридите след интравенозно прилагана мастна емулсия. В сравнение със сесията без стрес, изчистването на екзогенен товар от мазнини отне средно с 14% по-дълго след лабораторен стрес (51).
В действителност стресът променя гастродуоденалната подвижност, забавя изпразването на стомаха и нарушава чревния транзит и подвижността на дебелото черво (52). Всъщност, тъй като блуждаещият нерв инервира тъканите, участващи в храносмилането, усвояването и метаболизма на хранителни вещества, включително стомаха, панкреаса и черния дроб, вагусното активиране влияе пряко и дълбоко върху метаболитните реакции към храната (53). Например, вагусното активиране е важно при регулирането на ранните и пиковите инсулинови отговори, които помагат да се регулират нивата на глюкоза след хранене (53); от своя страна, глюкозният отговор на хранене помага да се определи постпрандиалното възпаление (48). Както депресията, така и стресът имат добре документирани негативни ефекти върху вагусното активиране, индексирани от вариабилността на сърдечната честота (52, 54), осигурявайки друг път, през който отрицателните емоции могат да повлияят на възпалението след хранене. Накратко, мозъкът и червата водят енергичен, непрекъснат диалог.
Мултидисциплинарни възможности
Данните за поведението са относителна рядкост в хранителната литература, успоредно с рядкото използване на диетични мерки при поведенчески изследвания; кръстосаните разговори биха били от полза и за двете страни. Например, хроничното възпаление е една от основните метаболитни промени, свързани с прекомерен прием на калории и затлъстяване, а ограничаването на калориите (консумирането на ∼20-30% по-малко калории, като същевременно се максимизират храните с плътна микроелементи и минимизирането на храните с висока плътност) възпалителни ефекти за периоди от месеци до години (55). Въпреки това, краткосрочните промени в честотата или времето на хранене също могат да променят възпалението. Например, наблюдателните мюсюлмани не ядат и не пият през светлите часове на деня по време на Рамадан, като по този начин произвеждат едномесечно продължително периодично гладуване (56). Сравненията на IL-6 и CRP една седмица преди Рамадан, през последната седмица на Рамадан и 20 дни след Рамадан показаха, че гладуването през деня намалява нивата на IL-6 и CRP с около 50% в сравнение със стойностите от преди Рамадан, драматично намаляване при липса на промяна на теглото; група, която не е гладувала по едно и също време, не показва промени в IL-6 или CRP (56).
Тези провокативни данни предполагат, че продължителното периодично гладуване значително намалява възпалението. Има ли съпътстващи промени в настроението? Индуцира ли продължителното периодично гладуване промени в HPA или SAM отговорите? И обратно - влияе ли настроението на степента на промяна?
Постенето влияе и върху въздействието на химиотерапията. Например, няколко щамове мишки, инжектирани с агресивна клетъчна линия на невробластом, са гладували в продължение на 48-60 часа, преди да получат изключително високи дози химиотерапия (57). Сред мишки, които се хранят нормално, повече от 40% умират от химиотерапията; за разлика от това, всички гладни мишки оцеляват и нито една не показва видими признаци на токсичност. Химиотерапията уврежда ДНК в делящите се клетки, особено кръвните клетки; в нормалните клетки гладуването забавя клетъчния цикъл и по този начин е защитно. Въпреки това, туморните клетки не реагират на глад чрез забавяне на клетъчното делене и тяхната продължителна висока репликация ги прави по-уязвими към химиотерапия (57). В клиничните изпитвания, които сега се провеждат при хора (58), със сигурност би било интересно да научите как гладуването повлиява възпалителните реакции на химиотерапията и съпътстващите увеличения на депресивните симптоми и умората, както и дали гладуването променя когнитивните промени, предизвикани от химиотерапията (59).
По-широкият и по-дълбок интерфейс между поведенческите и хранителните лагери е от съществено значение за изграждането на нашите знания във всеки от отделните светове. По-силните мостове между полетата също ще хвърлят светлина върху силите, насърчаващи заболявания, свързани със затлъстяването. Най-малкото по-стриктно оценяване на диетата при поведенчески проучвания и по-рутинно оценяване на поведението при диетични проучвания би предоставило важна информация за това, което в противен случай може да се разглежда като вариация на грешките. Накратко, по-доброто разбиране на това как стресорите, негативните емоции и нездравословното хранене работят заедно за засилване на възпалението ще бъде от полза за поведенческите и хранителни изследвания, както и за по-широката биомедицинска общност.
- Значение на храненето при белодробна туберкулоза Критични отзиви в науката за храните и храненето
- Отчетено приемане на храна и разпределение на телесните мазнини, повтарящо се проучване на напречното сечение Хранене
- Връзка на стреса, съня, физическата активност и несигурността на храните от Ейми Лий Ричардс
- Хранителни консултации Храната е Vida
- Малки по размер, големи в храненето Готвене със семена - Храна и рецепти - Живот на Майката Земя