Резюме
Въведение
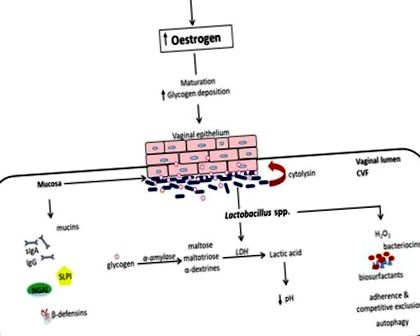
Вагиналната лигавична екосистема се състои от стратифициран плосък неератинизиран епител, покрит от лигавичен слой, непрекъснато смазан от цервиковагинална течност (CVF). Заедно те образуват обезсърчаваща физическа и биохимична бариера срещу чужди нахлуващи организми. Освен че е кисела среда, съдържаща асортимент от антимикробни молекули, включително антитела (IgA и IgG), муцини, β-дефензини, секреторен инхибитор на протеазата на левкоцитите (SLPI), асоцииран с неутрофил желатиназа липокалин (NGAL), повърхностноактивен протеин и др., CVF също улеснява затварянето на екзогенни организми (обобщено на фигура Фигура1) 1) (1-3).
Във влагалището се намират и множество микроорганизми („микробиотата“), които съществуват (заедно с техните гени и продукти) в регулирана взаимна връзка с гостоприемника („микробиомът“) (4). Някои от тези микроорганизми като видовете Lactobacillus подсилват защитата срещу инвазия и колонизация от опортюнистични патогени. Съставът на вагиналната микробиота/микробиом е динамичен и претърпява промени, съответстващи на хормонални колебания през репродуктивния живот на жената, т.е. от пубертета до менопаузата и по време на бременност (5).
Нормалната физиологична вагинална микробиота първоначално е описана през 1892 г. от Алберт Дьодерлайн като хомогенна, състояща се само от Грам-положителни бацили (бацили на Додерлайн) (6), за които се смята, че произхождат от червата и в момента е известно, че са част от рода Lactobacillus (7 ). Еволюцията на този уникален вагинален микробиом се подкрепя от две еволюционни хипотези: „хипотезата за риска от заболяване“ (8, 9) и „хипотезата за акушерска защита“ (9), които предполагат, че човешката вагина селективно се доминира от защитни видове Lactobacillus защото хората са по-податливи на полово предавани болести; а също и с по-висок риск от бременност и свързани с раждането микробни усложнения (8–10).
Редица защитни видове Lactobacillus доминират в здравата вагинална микробиота при повечето жени в репродуктивна възраст. Последният напредък в техниките за секвениране на ДНК разкри, че доминиращите видове Lactobacillus във вагиналната микробиота включват L. crispatus, L. gasseri, L. iners и L. jensenii, докато други анаероби, включително Gardnerella, Atopobium, Mobiluncus, Prevotella, Streptococcus, Ureaplasma, Megasphaera и др., Способни да причинят инфекции като бактериална вагиноза (BV), остават в латентно състояние чрез защитното действие на лактобацилите. Тези техники с висока разделителна способност позволиха класифицирането на вагиналната микробиота в пет държавни типа на общността (CST) с CSTI, II, III и V, доминирани съответно от L. crispatus, L. gasseri, L. iners и L. jensenii, докато CSTIV е доминиран от смесени анаероби, подобни на тези, открити в BV (5, 11).
Преобладаването на тези организми във вагиналната микробиота варира в различните расови/етнически групи и биогеографски местоположения, като чернокожите и латиноамериканците приютяват по-анаеробни бактериални видове (CSTIV) и показват по-високо вагинално рН при наличие или липса на клинична инфекция (11, 12) . Различията в разпространението също са свързани с разликите в начина на живот (11) и взаимодействията между гените и околната среда (12). За разлика от други вътрешни органи като червата, увеличеното разнообразие на вагиналната микробиота е свързано с повишена чувствителност към болести и отрицателни репродуктивни резултати (5, 13).
Ефектът на естрогена върху вагиналната екосистема
Препуберталният вагинален микробиом е доминиран от анаероби, Е. coli, дифтероиди и коагулаза-отрицателни стафилококи и значително по-малък гликоген (5). В пубертета нарастващите нива на естроген спомагат за узряването, пролиферацията и натрупването на гликоген във вагиналните епителни клетки. Гликогенът се катаболизира от човешка α-амилаза до малтоза, малтотриоза и α-декстрини, които след това се метаболизират до млечна киселина от видове Lactobacillus (Фигура (Фигура 1). 1). Това създава кисела среда (рН, 3,5–4,5), благоприятна за растежа на лактобацилите за сметка на други анаеробни бактериални видове (1, 5). Доминирането на лактобацилите намалява, тъй като нивата на естроген намаляват след менопаузата (16) и се увеличават с вагинална естроген-заместителна терапия.
Вагиналната микробиота при нормална бременност се преобладава от лактобацилите и е по-стабилна от тази в небременното състояние (12, 17, 18). Това може да се обясни с високото ниво на естроген по време на бременност, което води до повишено отлагане на вагинален гликоген, което засилва разпространението на вагинална микробиота, доминирана от лактобацили (2). Също така, проучванията показват, че менструацията значително обратимо променя вагиналното микробно разнообразие, с около 100-кратно намаляване на L. crispatus и увеличаване на L. iners, G. vaginalis, P. bivia и A. vaginae (19, 20) . По същество нормалното киселинно вагинално рН при жените в репродуктивна възраст се движи от естроген, гликоген и лактобацили (1, 21–23).
Съобщава се и за интригуваща пряка връзка между вагиналната острогенизация и кандидозата при жени в менопауза (24). След менопаузата, индуцираното от естроген натрупване на вагинален епителен гликоген се свързва с повишена инфекция от Candida albicans, която има гликоген като основен субстрат. За разлика от това, при жени в пременопауза активността на α-амилаза, която корелира с D- (но не и L-) млечна киселина и производството на SLPI, NGAL, хиалуронидаза-1 и матрична металопротеиназа (MMP) -8, е намалена при жени, заразени с C albicans (25). Повишената наличност на гликоген вследствие на ексфолирането и лизиса на богати на гликоген епителни клетки във вагиналния лумен чрез разграждащи екстрацелуларната матрица ензими - хиалуронидаза-1 и MMP-8, млечна киселина и цитолизин биха могли да повишат активността на а-амилазата (25) Този ефект на вагиналната острогенизация, нивото на гликоген и кандидозата във връзка с менопаузалния статус вероятно ще бъде от физиологично значение и налага по-нататъшно изследване.
Лактобацили, задължително условие за вагинална хомеостаза
Вагиналната млечна киселина е предимно от бактериален произход (26). Под въздействието на естроген вагиналният епител произвежда + при рН 3,86. Млечната киселина в нейната протонирана форма е мембранно проникваща и за разлика от лактатния анион, не изисква протон-свързаните монокарбоксилатни транспортери или лактат-свързващите GPR81 рецептори да влязат в клетките (37, 38). Млечната киселина предимно лизира бактерии, различни от видовете Lactobacillus (23, 36); и причинява бактериална клетъчна смърт чрез подкисляване на цитозола, нарушаване на вътреклетъчната функция (39), увеличаване на пропускливостта на клетъчната мембрана до H2O2, диацетил и др., като по този начин потенцира антимикробния ефект на други вещества (40). Намалената антимикробна активност на млечната киселина и повишеният риск от инфекция, свързани с незащитен полов акт и менструация, могат да се отдадат на увеличаването на вагиналното рН след отлагане на семенната течност и менструалния поток, което води до образуването на повече лактатен анион, който има по-малко антимикробни и имуномодулиращи дейности (33, 36).
В допълнение, степента на защита, предоставена на вагиналната екосистема, зависи от преобладаващия вид Lactobacillus. Например, доминирана от L. iners вагинална микробиота обикновено се свързва с дисбиоза и изглежда по-малко стабилна и по-податлива на преход. За разлика от L. crispatus, който произвежда както D-, така и L-млечна киселина, е свързан с повишена стабилност на вагиналната общност (по-малко вероятно е да премине към дисбиоза) и здраве (19, 52, 53). L. iners проявява патогенна склонност чрез неговия образуващ пори холестерол-зависим цитолизин (CDC, инеролизин) (54, 55). Той има малък геном и не е в състояние да произвежда D-млечна киселина и H2O2, необходими за насърчаване на еубиоза, за разлика от другите видове Lactobacillus (3, 13). Също така наскоро забелязахме, че преобладаването на L. jensenii (която произвежда само D-млечната киселина и по-ниска защитна способност в сравнение с L. crispatus) (27), е свързано с намаляване на лактата, сукцината и повишен риск от преждевременно раждане (56 ).
Влиянието на микробната активност върху бариерната функция на вагиналната лигавица
Стрес и вагинално здраве
Аберантна вагинална микробиота (дисбиоза)
Вагиналната микробиота е динамична общност от различни бактериални видове, многократно подложени както на вътрешни, така и на външни манипулативни стимули, като промени в нивата на половите хормони и стадия на менструалния цикъл, сексуална активност, антибиотична терапия и използване на орални контрацептиви, вагинално измиване, менопауза, бременност, кърмене, захарен диабет и стрес. Съставът на вагиналната микробиота също се определя от взаимодействията ген-среда. Наблюдавано е, че вагиналните бактериални съобщества, лишени от доминиране на Lactobacillus с по-високо рН и по-ниско ниво на H2O2, са нормални при чернокожите и испанците (11, 52, 60, 61).
Най-честата вагинална инфекция при жени в репродуктивна възраст е бактериалната вагиноза (BV). BV, с честота на разпространение 5–70% (62), се характеризира с изчерпване на лактобацили в полза на потенциално патогенни смесени анаероби като Gardnerella, Atopobium, Mobiluncus, Prevotella, Streptococcus, Mycoplasma, Ureaplasma, Dialister, Bacteroides и др. (63–65). Той създава по-хетерогенна вагинална среда, свързана с намалени нива на млечна киселина, рН> 4,5 и големи количества късоверижни мастни киселини (SCFA) като ацетат, бутират, пропионат и сукцинат, произведени от анаероби. Въпреки че явен възпалителен отговор често не се проявява, той е свързан с повишени нива на имунни медиатори като IL-1β, IL-2, IL-6, IL-8, IL-10, TNF-α, Интерферон (IFN) -γ, RANTES и др. (1, 5) и намалена концентрация на антимикробни пептиди като NGAL (47). BV е загадъчен синдром с неидентифицирана етиология. Повечето BV-позитивни жени обикновено са безсимптомни. Симптомите обаче могат да се появят под формата на не сърбящ, но дразнещ, кремообразен вагинален секрет с рибна миризма, който може да бъде по-забележим след полов акт и по време на менструация.
Критериите на Amsel се използват за диагностициране на BV в повечето клинични условия. Критериите включват оценка на вагиналната киселинност, наличието на вагинално отделяне, появата на слепи клетки (дескваматирани вагинални епителни клетки, обсипани с анаеробни бактерии) и положителен „тест за вдишване“ (характерен „рибен“ мирис, възприет при 10% калий хидроксид се добавя към микроскопичен предмет на вагиналното отделяне) (66). Най-чувствителните критерии са вагиналното рН (> 4,5) и откриването на тънки, хомогенни, млечни и прилепнали отделяния (97%), когато критериите се оценяват индивидуално (67). Въпреки това, откриването на изпускане имаше ниска специфичност (26%) и положителна прогнозна стойност (27%), докато критерият с най-висока специфичност беше наличието на следи от клетки (86%). Когато се комбинират заедно, наличието на поне три критерия значително увеличава вероятността от поставяне на точна диагноза на BV, което води до чувствителност и специфичност съответно от 97 и 90% (67, 68).
В изследователското пространство BV често се диагностицира със системата за точкуване Nugent (69). Въпреки че диагнозата изисква опитен лабораторен персонал за оценка на диапозитивите, тя е по-обективна и надеждна и има по-висока възпроизводимост и чувствителност в сравнение с критериите на Amsel (70). Той използва оцветяването на Грам, за да идентифицира микроскопски промяна във вагиналната микробиота от доминиране на здрави лактобацили (Грам-положителни пръчки) към междинно ниво на смесена Грам отрицателна/променлива микробиота (Гарднерела и Бактероиди), до липса на лактобацили и преобладаване на Грам отрицателна/променливи пръти или извити пръти (Mobiluncus) (68, 69). Резултат от 0-3 съответства на доминирането на лактобацилите и здравето на вагината, резултатът от 4-6 показва междинна, смесена вагинална бактериална общност, докато> 7 показва BV инфекция. Налице е добра корелация между клиничните характеристики на оценките на BV и Gram (70).
BV се свързва с повишен риск от придобиване на ППИ като N. гонорея, C. trachomatis, T. vaginalis, HSV, HPV и HIV и други инфекции като възпалително заболяване на таза, ендометрит, хориоамнионит и инфекция на околоплодните течности. Във връзка с бременността BV изглежда е свързана с преждевременно преждевременно разкъсване на мембраните (PPROM), преждевременно раждане (PTL) и преждевременно раждане (PTB, т.е. раждане преди 37 завършени гестационни седмици) (62, 71–81).
Вагиналната дисбиоза може да се прояви и като аеробен вагинит (AV). Това е също толкова разрушителна инфекция на нормалната вагинална доминирана от Lactobacillus микробиота, но се характеризира с явно възпаление, инфилтрация на левкоцити и парабазални клетки и разпространение на ентерогенни аеробни бактериални организми, включително Escherichia coli, Enteroccoci, Staphylococcus aureus и Streptococcus от група В (21, 82 ). Той е описан като аеробен еквивалент на BV, поради намалена концентрация на млечна киселина, вторично вследствие на изчерпаното доминиране на Lactobacillus. Тъй като обаче липсват анаероби, концентрацията на сукцинат е ниска. AV също се свързва с ППИ като C. trachomatis, N. gonorrhoeae и T. vaginalis. Клиничните характеристики на AV включват: възпаление на червената вагинална лигавица, повишени IL-1β и IL-6, вагинално рН> 6, сърбеж и парене (сърбеж), диспареуния и жълтеникаво лепкаво отделяне, лишено от рибна миризма. AV е налице при 2-25% от жените и е свързано с тежки неблагоприятни гинекологични и акушерски резултати, включително възходяща генитална инфекция/възпаление, PPROM, PTL и PTB (83, 84).
Последици от абнормна вагинална микробиота за човешката бременност
Физиологичният статус на вагиналната среда е от решаващо значение не само за общото благосъстояние на гостоприемника, но и за зачеването и евентуалния успех на бременността. Способността на Lactobacillus да предотврати инвазията и колонизацията на вагиналното пространство от патогени, без да предизвиква явен възпалителен отговор, се нарича толерантност и е особено полезна за репродукцията (3). Освен че повишава чувствителността на гостоприемника към ППИ и други гинекологични състояния, включително цервикална интраепителна неоплазия и рак на маточната шийка (85–87), дисбиотична вагинална микросреда с влошена толерантност и противовъзпалителни механизми, медиирани от лактобацили, също влияе върху хода и резултата от бременността. По същество Lactobacillus spp. е безценно за запазването на хомеостатична вагинална среда.
Зачеване и спонтанен аборт
Недоносеност
Патогенеза на инфекция/свързано с възпаление преждевременно раждане и раждане. Колонизирането на женския генитален тракт от патогенни анаеробни бактерии поради изменена вагинална микробиота предизвиква възпалителен отговор, който в крайна сметка стимулира пътищата за преждевременно раждане и раждане, т.е. свиване на матката, ремоделиране на маточната шийка и активиране на мембраната. CRH, кортикотропин-освобождаващ хормон; IL, интерлевкин; MIAC, микробна инвазия в околоплодната кухина; PGE2, простагландин Е2; PGF2α, простагландин F2α; TNF, фактор на туморна некроза.
Заключение
Авторски приноси
Този преглед е замислен, проведен, написан и прегледан от EA и DA. И двамата автори одобриха окончателния ръкопис.
Изявление за конфликт на интереси
Авторите декларират, че изследването е проведено при липса на каквито и да било търговски или финансови отношения, които биха могли да се тълкуват като потенциален конфликт на интереси.
- Синергична роля на куркумин със съвременна терапия при колоректален рак Minireview
- Измиване на родени с цезарово сечение бебета с вагинални течности, потенциално опасни и ненужни - ScienceDaily
- Диетата с високо съдържание на мазнини срещу хепатит C Ролята на витаминното обогатяване в епидемията от затлъстяване
- Диетата с високо съдържание на мазнини предизвиква миокардна фиброза при метаболитно здрави мини-прасета със затлъстяване - ролята
- МАТКА СЕ СВЪРЗВА СЛЕД ВАГИНАЛНО РАЖДАНЕ - Мама и Те