Резюме
Заден план
Транспортните протеинови частици (TRAPP) са мултипротеинов комплекс, участващ в трафика на ендоплазмен ретикулум към Голджи. Риба зебра с мутация в TRAPPC11 ортологът показа хепатомегалия със стеатоза и дефекти в развитието на зрителната система. При хората, TRAPPC11 мутации са докладвани само в три семейства, показващи мускулна дистрофия на крайника (LGMD) или миопатия с двигателни разстройства и интелектуални затруднения.
Методи
Проверихме гени на мускулна дистрофия, използвайки секвениране от следващо поколение, и извършихме свързани молекулярни и биохимични анализи при пациент с затлъстяване на черния дроб и катаракта в допълнение към инфантилна поява на мускулна слабост.
Резултати
Идентифицирахме първия азиатски пациент с TRAPPC11 мутации. Мускулната патология демонстрира типични дистрофични промени и чернодробната биопсия разкрива стеатоза. Пациентът е носил съставни хетерозиготни мутации на съобщена по-рано мисенс и нова мутация на мястото на снаждане. Промяната на мястото на сплайсинг създаде два анормално сплайсирани транскрипта, за които се очакваше, че ще доведат до транслационно изместване на кадрите и пресечени протеини. Протеинът с пълна дължина TRAPPC11 не се открива при имуноблотинг.
Заключение
Този доклад разширява фенотипа на TRAPPC11-апатия, тъй като пациентът показва следното: (1) фенотип на вродена мускулна дистрофия, а не LGMD; (2) стеатоза и детска катаракта, и двете не наблюдавани при съобщени преди това пациенти; но (3) липса на атаксия или необичайно движение, което ясно показва, че TRAPPC11 играе физиологична роля в множество тъкани при човека.
Заден план
Представяне на дело
Клинични и патологични характеристики
Понастоящем 8-годишното китайско момиче Хан, пребиваващо в Тайван, родено от родители, които не са роднини, е установено, че не може да се изправи на възраст 1 година. Хронологията на етапите на развитието преди това не беше припомнена от родителите. Тя започна да ходи самостоятелно на възраст от 1 година и 6 месеца и лесно падна. На 2-годишна възраст беше забелязано забавяне на говора, тъй като тя не можеше да произнесе нито една значима дума, въпреки че можеше да разбере и да изпълнява прости заповеди. На същата възраст е открита и двустранна катаракта. Историята на нейното раждане е безпроблемна и няма съответна семейна история. Рехабилитацията обаче не показва значително подобрение в нейните речеви и двигателни функции. На възраст 3 години и 6 месеца са открити високи нива на трансаминази непосредствено преди операцията на катаракта. Впоследствие беше установено високо ниво на креатин киназа (CK), което доведе до насочване към детски миолог. Физикалният преглед е показал лека лордоза, положителен знак на Gowers с разклащаща се походка и намалени дълбоки сухожилни рефлекси, както и хепатомегалия. Не се наблюдава нито атаксия, нито необичайно движение. Кръвната биохимия показва, че нивата на AST (180 IU/L; нормални Фиг. 1
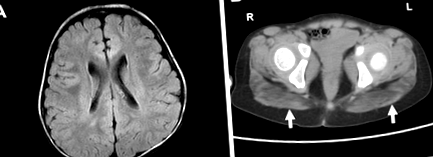
Образ на мозъка и мускулите. а Леко намален обем на перивентрикуларно бяло вещество с вентрикули с ъглова форма е показан на ЯМР на мозъка (Т2-претеглено усещане). б Глутеалните мускули са най-засегнати при мускулна КТ, както показват стрелките. (R нали, L наляво)
Поради постоянните високи нива на AST/ALT и хепатомегалия, беше извършена чернодробна биопсия и беше установено прекомерно натрупване на липиди в чернодробните клетки, предполагащо стеатохепатит (фиг. 2а). Мускулната биопсия на biceps brachii разкрива дистрофична промяна с разпръснати некротични и регенериращи влакна и умерена ендомизиална фиброза (фиг. 2б) и леко повишени липидни капчици в цитоплазмата на мускулните влакна върху оцветяване с маслено червено О (фиг. 2в ). Не са показани забележими отклонения в имунохистохимията при използване на антитела срещу С-краен, N-краен и основен домен на дистрофин (Novocastra Lab.), Алфа-, бета-, делта- и гама-саркогликани (Novocastra Lab.), Алфа - (Upstate) и бета-дистрогликани (Novocastra Lab.), Мерозин (Chemicon International), колаген VI (ICN Biomedicals, Inc), дисферлин (Novocastra Lab.), Кавеолин-3 (Transduction Lab.) И emerin (Novocastra Lab) .). В последващото 4-годишно проследяване мускулната й слабост остава неподвижна. Към днешна дата не са открити сърдечни или дихателни проблеми.
Чернодробна и мускулна патология. а Оцветяването с хематоксилин и еозин (H&E) на чернодробната биопсия показва значително липидно натрупване, съответстващо на стеатохепатит. (размер на лентата 20 μm) H&E и маслено червено O оцветяване на биопсирания мускул разкри дистрофична промяна (б) и леко натрупване на липиди (° С). (размер на лентата 50 μm за б и 20 μm за ° С)
Молекулярни и протеинови анализи
Молекулярни и протеинови анализи. а Последователността на Sanger потвърди съединенията хетерозиготни мутации c.661-1G> T и c.2938G> A в TRAPPC11. б Анализ на кДНК на скелетните мускули, фланкиращи екзони 6 и 7 от TRAPPC11 показа два мутантни транскрипта (1 и 2) в допълнение към 234-bp нормален ампликон. ° С Романът c.661-1G> T мутация на мястото на сплайсинг води до две мутантни транскрипти; мутант 1 с пресечен екзон 7 и мутант 2 с пресечен екзон 7 и криптичен екзон в интрон 6, като се очаква и двата да причинят транслационно изместване на кадрите, p.Leu240Alafs * 10 и p.Leu240Valfs * 7, съответно. Променените аминокиселини са получер. д Анализът на протеини с помощта на биопсиран мускул разкрива липсата на TRAPPC11 протеин при 130 kDa, докато TRAPPC2 и тубулин са сравними с контролните мускули
Дискусия
Демонстрирахме, че новата мутация на мястото на снаждане c.661-1G> T води до две различни аберантни транскрипти, за които се предвижда да произведат два пресечени протеина. Липсата на протеин TRAPPC11 с пълна дължина чрез Western blot анализ предполага възможността мутацията на Gly980Arg да дестабилизира протеина, което също е показано в предишния доклад, описващ Gly980Arg по хомозиготен начин, или може да засили неговото разграждане [6].
Заключения
Колективно, това проучване разширява фенотипа на TRAPPC11-апатия. Въпреки че подробният механизъм, причиняващ вътреклетъчно съхранение на липиди в черния дроб, все още е неизвестен, фенотипът на пациента в това проучване ясно показва, че TRAPPC11 играе физиологична роля в множество тъкани при хората, включително черния дроб, мускулите, окото, мозъка и костите. Това може да се дължи на нарушаване на функциите на TRAPPC11 в множество пътища за трафик на мембрана или други процеси.
Съгласие
Получено е писмено информирано съгласие от майката на пациента за публикуване на този доклад за случая и всички придружаващи изображения. Копие от писменото съгласие е на разположение на редакторите на това списание при поискване.
Съкращения
транспортни протеинови частици
мускулна дистрофия на крайник-пояс
свързан с лизозома мембранен протеин
вродена мускулна дистрофия
Препратки
Kim YG, Raunser S, Munger C, Wagner J, Song YL, Cygler M, et al. Архитектурата на многоблоковия комплекс TRAPP I предлага модел за връзване на везикули. Клетка. 2006; 127: 817–30.
Wendler F, Gillingham AK, Sinka R, Rosa-Ferreira C, Gordon DE, Franch-Marro X, et al. Екран с интерференция на РНК с широк геном идентифицира два нови компонента на метазойния секреторен път. EMBO J. 2010; 29: 304–14.
Scrivens PJ, Noueihed B, Shahrzad N, Hul S, Brunet S, Sacher M. C4orf41 и TTC-15 са компоненти на TRAPP за бозайници с роля на ранен етап в трафика от ER до Голджи. Mol Biol Cell. 2011; 22: 2083–93.
Sadler KC, Amsterdam A, Soroka C, Boyer J, Hopkins N. Генетичен скрининг при зебрафи идентифицира мутантите vps18, nf2 и foie gras като модели на чернодробно заболяване. Развитие. 2005; 132: 3561–72.
Gross JM, Perkins BD, Amsterdam A, Egaña A, Darland T, Matsui JI, et al. Идентифициране на мутанти на вмъкване на рибки зебра с дефекти в развитието и функцията на зрителната система. Генетика. 2005; 170: 245–61.
Bögershausen N, Shahrzad N, Chong JX, von Kleist-Retzow JC, Stanga D, Li Y, et al. Рецесивните мутации на TRAPPC11 причиняват болестен спектър на мускулна дистрофия на пояса на крайниците и миопатия с двигателни разстройства и интелектуални увреждания. Am J Hum Genet. 2013; 93: 181–90.
Scrivens PJ, Shahrzad N, Moores A, Morin A, Brunet S, Sacher M. TRAPPC2L е нов, силно консервиран TRAPP-взаимодействащ протеин. Трафик. 2009; 10: 724–36.
Haynes RL, Billiards SS, Borenstein NS, Volpe JJ, Kinney HC. Дифузно аксонално увреждане при перивентрикуларна левкомалация, определено чрез апоптотичен маркер фрактин. Pediat Res. 2008; 63: 656–61.
Alam GCA, Sahu WCS. Ядрено-магнитен резонанс при оценка на перивентрикуларна левкомалация. MJAFI. 2010; 66: 374–80.
Steenweg NE, Vanderver A, Blaser S, Bizzi A, de Koning TJ, Mancini GMS, et al. Разпознаване на образи на магнитен резонанс при хипомиелинизиращи нарушения. Мозък. 2010; 133: 2971–82.
Dupuis N, Fafouri A, Bayot A, Kumar M, Lecharpentier T, Ball G, et al. Недостигът на димеклин причинява постнатална микроцефалия, хипомелинизация и дефекти на трафика на ретикулум към Голджи при мишки и хора. Hum Mol Genet. 2015; 24: 2771–83.
Благодарности
Това проучване беше подкрепено отчасти от Интрамурален грант за научни изследвания (26-7, 26-8) за неврологични и психиатрични разстройства на NCNP, Изследователски грантове за здравни и трудови науки за цялостно изследване на хора с увреждания (H25-Shinkei Kin-Ippan-004) и Практически изследователски проект за редки/неразрешими заболявания (H26-Itaku (Nan) -Ippan-081) от Японската агенция за медицински изследвания и развитие, AMED. WZ се поддържа от Държавния фонд за стипендии от Съвета за стипендии на Китай (CSC_201406105045). МС се подкрепя от Канадските институти за здравни изследвания, Съветът за природни науки и инженерни изследвания на Канада и Канадската фондация за иновации и е член на мрежата Groupe de Recherche Axé sur la Structure des Protéines (GRASP).
Информация за автора
Принадлежности
Катедри по педиатрия, Медицинска университетска болница в Гаосюн, Медицински университет в Гаосюн, Гаосюн, Тайван
Wen-Chen Liang, Hsiang-Hung Shih & Yuh-Jyh Jong
Катедра по лабораторна медицина, Медицинска университетска болница в Гаосюн, Медицински университет в Гаосюн, Гаосюн, Тайван
Катедра по педиатрия, Медицински факултет, Медицински колеж, Медицински университет Гаосюн, Гаосюн, Тайван
Wen-Chen Liang & Hsiang-Hung Shih
Завършил Медицински институт, Медицински колеж, Медицински университет в Гаосюн, Гаосюн, Тайван
Отдел за невромускулни изследвания, Национален институт по неврология, Национален център по неврология и психиатрия, Токио, Япония
Уенхуа Жу, Сатоми Мицухаши, Сатору Ногучи, Мегуму Огава и Ичизо Нишино
Отдел за развитие на геномна медицина, Център за медицински геном, Национален център по неврология и психиатрия, Токио, Япония
Wenhua Zhu, Satomi Mitsuhashi, Satoru Noguchi & Ichizo Nishino
Отделение по неврология, болница Хуашан, Университет Фудан, Шанхай, Китай
Департамент по биология, Университет Конкордия, Монреал, QC, H4B 1R6, Канада
Катедра по анатомия и клетъчна биология, Университет Макгил, Монреал, QC, H3A 2B2, Канада
Департамент по биологични науки и технологии, Колеж по биологични науки и технологии, Национален университет Чиао Тунг, Синчу, Тайван
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Автора за кореспонденция
Допълнителна информация
Конкуриращи се интереси
Авторите заявяват, че нямат конкуриращи се интереси.
Принос на авторите
Wen-Chen Liang и Wenhua Zhu допринесоха еднакво за тази работа.
- Честота и предиктори на неалкохолна мастна чернодробна болест при миотонична дистрофия - Shieh - 2010
- Мастен черен дроб Броколи, яйца, пиле и риба в диетата - Humanitasalute
- Причини за дебелия черен дроб, симптоми, дози и дон и план за диета
- Диета с мазни черен дроб Симптоми, причини, диетични съвети и храни, които трябва да избягвате - NDTV Food
- Затлъстяване на черния дроб - CHOC деца; s, окръг Ориндж