Институт по молекулярна биология, Университет на Орегон, Юджийн, OR 97403, САЩ.
Институт по молекулярна биология, Университет на Орегон, Юджийн, OR 97403, САЩ.
Институт по молекулярна биология, Университет на Орегон, Юджийн, OR 97403, САЩ.
Институт по молекулярна биология, Университет на Орегон, Юджийн, OR 97403, САЩ.
Обобщение
Helicobacter pylori е специфичен за човека стомашен патоген, който колонизира над половината от световното население. Инфекцията с тази бактерия е свързана със спектър от стомашни патологии, вариращи от лек гастрит до пептична язва и рак на стомаха. Силен предиктор за тежкия изход на заболяването е инфекцията с бактериален щам, приютяващ cag (свързан с цитотоксин ген) остров за патогенност (PAI), 40 kb участък от ДНК, който кодира хомолози на няколко компонента на система за секреция от тип IV (TFSS). Един ген в рамките на cag PAI, cagA, е показано, че кодира субстрат за TFSS, който се премества в клетки гостоприемник и причинява множество промени в сигнализирането на клетката гостоприемник. Тук правим преглед на последните постижения в характеризирането на секреция от тип IV, дейностите на независимите от CagA и CagA ефекти на TFSS, които допринасят за нашето разбиране за H. pylori патогенеза.
Helicobacter pylori и неговите асоциации с хората
От изолирането му от биопсии на човешкия стомах през 1983 г. (Marshall and Warren, 1984), H. pylori е бил фокус на интензивна изследователска дейност. Открита за първи път като инфекциозна причина за язвена болест, H. pylori оттогава е установено, че има много по-разнообразна и нюансирана връзка с човешкия си домакин (Blaser and Atherton, 2004). Сега знаем, че инфекцията е свързана с набор от резултати от болести. Над половината от населението на света е заразено с H. pylori, с най-високи нива в развиващите се страни (Rothenbacher and Brenner, 2003). Инфекциите се появяват в ранна детска възраст и продължават десетилетия при липса на целенасочена антимикробна терапия. Докато много H. pylori заразените индивиди са клинично асимптоматични, повечето ще проявят някаква степен на гастрит. Приблизително 10% от заразените субекти ще развият по-тежки стомашни патологии като язвена болест и атрофичен гастрит. Ракът на стомаха се развива при приблизително 1% от заразените лица, корелация, която накара Световната здравна организация да декларира H. pylori първият бактериален канцероген от клас 1 през 1994 г.
Изследвания на H. pylori са разкрили не само способността му да съжителства в продължение на много десетилетия в рамките на един гостоприемник, но също така, че видът е съжителствал със своя гостоприемник през голяма част от човешката история. Всъщност модели на полиморфизъм на последователността сред H. pylori изолатите са използвани за проследяване на модели на човешка миграция (Falush и др., 2003). Един изглед на H. pylori Постоянното съжителство на хората постулира това в исторически план H. pylori беше коменсал и едва наскоро стана по-патогенен поради съвременните обстоятелства (Blaser and Atherton, 2004). Те включват увеличаване на продължителността на човешкия живот, неотдавнашни промени в човешката диета и променени човешки имунологични реакции поради съвременните санитарни условия и появата на антибиотици. Независимо дали се разглежда като патоген или коменсал, H. pylori очевидно е имал възможността да развие сложни механизми за манипулиране на пътните сигнали на клетките на своите гостоприемници.
Helicobacter pylori експериментални модели и предизвикателства
Да проучи подробностите на cag PAI-медиирани взаимодействия между гостоприемници и бактерии, много изследователи са използвали модели на тъканни култури, най-често стомашната аденокарциномна линия AGS. Докато такива модели ни научиха много на това как H. pylori променя сигналните пътища на приемната клетка, нито една от наличните стомашни клетъчни линии не се организира в поляризиран епител. Адаптация на H. pylori към модела поляризирани клетки на Madin-Darby Canine Bidney (MDCK) разкриха нови аспекти на H. pylori биология, включително способността й да съществува във вакуоли вътре в клетките (Amieva и др., 2002) и неговите ефекти върху клетъчните връзки (Amieva и др., 2003). Освен това, анализ на H. pylori взаимодействието с култивирани имунни клетки също разкри ново H. pylori имуномодулиращи ефекти (прегледани в Monack и др., 2004). Клетъчната култура обаче не може да рекапитулира сложните взаимодействия на множество видове клетки, открити в стомаха.
Друго голямо предизвикателство за H. pylori полето е разнообразието от щамове, използвани от различни лаборатории, което затруднява обобщаването на резултатите. Естествени изолати на H. pylori могат да се различават по своето геномно съдържание с повече от 20% (Salama и др., 2000). Дори един щам ще претърпи бърза лабораторна адаптация; например щамът 26695, чиято геномна последователност е първата, която се определя (Tomb и др., 1997), беше установено, че са загубили черти на вирулентност (като подвижност и доставка на CagA) след преминаване в лаборатория (Fischer и др., 2001; Хофман и др., 2003). Вторият щам, за който е определена последователността, J99, е скорошен клиничен изолат от пациент с язва, който е избран, за да се избегнат геномни промени, въведени чрез лабораторно преминаване (Alm и др., 1999). Докато сравнителният анализ на последователността е информативен, се оказва, че J99 има по-малко вирулентна, нефосфорилируема форма на важния детерминант на вирулентност CagA и следователно не е полезен за изучаване на тази важна черта на вирулентност на H. pylori.
Системите за секреция тип IV разкриват своите тайни
Последните няколко години дадоха вълнуваща нова представа за механизмите на TFSS, които са открити в редица бактериални патогени и симбионти и са еволюционно свързани със системите за конюгация на бактерии (Cascales и Christie, 2003). Най-добре проученият модел е TFSS на Agrobacterium tumefaciens, система за секреция, използвана от този разбъркан растителен патоген за доставяне на ДНК и протеини в растителните клетки в процес, който въвежда бактериална ДНК в растителния геном и причинява образуването на тумор. Използвайки ДНК анализ на кръстосано свързване и имунопреципитация, комбиниран със специфични мутанти и антитела за протеиновите компоненти, Кристи и колеги са успели да определят точната траектория на транспортираната ДНК през секретиращия апарат. Функционалната протеинова карта на секреционния апарат, която се получава от тези проучвания, се подкрепя от проучвания за взаимодействие между протеини и протеини и имунохистохимия (прегледано в Christie, 2004).
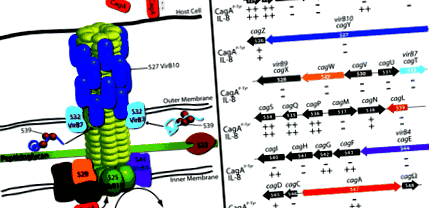
Хипотетично cag PAI TFSS е изобразен на фиг. 1. В H. pylori запазените TFSS компоненти включват локализирани вътрешни мембрани ATPases VirB4 (HP0544/CagE) и VirB11 (HP0525), които осигуряват енергия за транслокация на субстрата. The cag PAI също така кодира хомолог на свързващия протеин VirD4 (HP0524), който в A. tumefaciens и се смята, че конюгационните системи доставят TFSS субстратите до секретиращата машина. В H. pylori VirD4/HP0524 е необходим за транслокация на CagA, но е необходим за индукция на IL ‐ 8 (Fischer и др., 2001; Селбах и др., 2002а).
The cag PAI TFSS. А. Хипотетична конфигурация на cag PAI TFSS въз основа на A. tumefaciens и електронна микроскопия. Б. Графично представяне на cag PAI от H. pylori щам 26695, показващ относителен размер на гена и ориентация. Доставянето на CagA и IL-8 индуциращият фенотип на изогенни мутанти са обобщени под всеки ген, от Fischer и др. (2001).
Само по последователност, H. pylori също изглежда липсва VirB8; топологичният анализ обаче предполага, че HP0530 може да функционира подобно на този свързан с вътрешната мембрана протеин (Buhrdorf и др., 2003). По подобен начин се предлага HP0529 да функционира като VirB6 въз основа на мутантния фенотип и наличието на пет или шест предсказвани трансмембранни спирали. Краен ген, предложен да функционира като A. tumefaciens Vir генът е HP0523, който, подобно на VirB1, се смята за трансгликозилаза, която разгражда пептидогликановия слой, за да улесни сглобяването на TFSS през бактериалната клетъчна стена (Rohde и др., 2003). HP0523 не е в състояние да допълни A. tumefaciens virB1 мутант (Hoppner и др., 2004), но е необходимо за узряване на свързани с pilus HP0527/VirB10 и HP0532/VirB7, както е HP0539, постулиран шаперон за тези протеини (Rohde и др., 2003).
Helicobacter pylori TFSS субстрат: CagA
За разлика от тези други системи, единственият протеинов субстрат на cag Идентифицираният досега PAI TFSS е CagA (Segal и др., 1999; Асахи и др., 2000; Backert и др., 2000; Оденбройт и др., 2000; Щайн и др., 2000). Изследванията на клетъчната активност на CagA в епителните клетки разкриват, че CagA взаимодейства с голям брой протеини на гостоприемника и има множество ефекти върху пътищата на трансдукция на сигнала на гостоприемника, цитоскелтона и клетъчните връзки (фиг. 2).
Клетъчни дейности на CagA. (1) CagA се доставя в клетки гостоприемници чрез система за секреция от тип IV. (2) CagA се свързва с протеините с плътно свързване JAM и ZO ‐ 1 независимо от състоянието му на фосфорилиране на тирозин. (3) c-Src тирозин фосфорилира CagA в местата на EPIYA. (4) В отрицателна обратна връзка, CagA P-Tyr инхибира c-Src директно и чрез активиране на Csk. (5) Инхибирането на c-Src води до дефосфорилиране на коктактин и езрин, което може да допринесе за промени в клетъчната морфология и подвижност. (6) CagA P-Tyr се свързва и активира SHP-2 чрез взаимодействие с SH2 домейни. (7) CagA се свързва с c-Met рецептора, разположен на базолатералната клетъчна повърхност и с PLCγ. (8) SHP ‐ 2 стимулира продължителна ERK киназна активност. Активиране на SHP-2, c-Met. PLCγ и ERK са необходими за индуцирано от CagA удължаване и подвижност на клетките.
Когато се доставя в клетката гостоприемник, CagA се локализира в клетъчната мембрана под точката на бактериално прикрепване (Segal и др., 1999; Танака и др., 2003) и се колокализира с протеините ZO-1 и JAM, които обикновено се намират в клетъчните връзки (Amieva и др., 2003). CagA е разпознат като субстрат от Src кинази, които го фосфорилират върху тирозинови остатъци в уникални мотиви на EPIYA от С-крайната област (Selbach и др., 2002b; Щайн и др., 2002). Преразпределението на свързващите протеини се извършва независимо от фосфорилирането на CagA и насърчава течането на стегнатите връзки (Amieva и др., 2003), докато други клетъчни промени, включително удължаване на клетките, се медиират от фосфорилираната форма на CagA. В допълнение H. pylori инфекцията предизвиква клетъчна подвижност на AGS, наричана също клетъчно разсейване. Докато компонентът на подвижния отговор е независим от CagA (Churin и др., 2003), експресията на фосфорилиран CagA е достатъчна, за да предизвика клетъчно разсейване на AGS и е в тясна корелация с фенотипа на удължаване на клетките (Higashi и др., 2004).
Фосфорилираният CagA взаимодейства с редица протеини гостоприемници. Най-добре проучено от тези взаимодействия е с домена Src-хомология 2 (SH2), съдържащ тирозин фосфатаза, SHP ‐ 2 (Higashi и др., 2002а). SHP ‐ 2 е преобразувател на рецепторни тирозин кинази (RTK), като хепатоцитния растежен фактор/разсейващ фактор рецептор c-Met, който насърчава клетъчната подвижност и пролиферация (прегледано в Neel и др., 2003). SHP-2 се активира чрез взаимодействия с тирозин-фосфорилирани субстрати чрез двата му SH2 домена, което причинява конформационна промяна в молекулата, която излага своя фосфатазен домен. По време на H. pylori инфекция на AGS клетки, SHP-2 се набира в клетъчната мембрана и се активира по CagA-зависим начин (Higashi и др., 2002а). SHP ‐ 2 – CagA комплексите също са ко-имунопреципитирани от стомашна биопсична тъкан (Yamazaki и др., 2003), показваща значимостта на това взаимодействие in vivo. Знаем, че индукцията на CagA за удължаване на клетките се медиира чрез SHP-2, тъй като изчерпването на SHP-2 от siRNA блокира фенотипа на колибри (Higashi и др., 2004; Хигучи и др., 2004). Освен това, активирането на SHP-2 е достатъчно, за да предизвика удължаване на клетките, както е показано с насочена към мембрана версия на SHP-2 (Higashi и др., 2002а). Едно от последиците от активирането на SHP-2, което е важно за удължаването на клетките, е продължителната стимулация на извънклетъчната регулирана киназа на сигнала (ERK) (Churin и др., 2003; Хигаши и др., 2004).
Освен взаимодействието си с SHP ‐ 2, е доказано, че CagA взаимодейства и с други компоненти на пътищата за трансдукция на сигнала RTK. Те включват RTK c-Met и неговия ефектор PLCγ, фосфолипаза, чийто продукт PIP2 активира гелсолин, профилин и кофилин, което води до промени в динамиката на актина (Churin и др., 2003). Съобщава се също така, че CagA взаимодейства с молекулата на адаптера RTK Grb2 (Mimuro и др., 2002), въпреки че други не са успели да възпроизведат това последно взаимодействие (Higashi и др., 2004). Въз основа на тази мрежа от протеинови взаимодействия, беше предложено CagA да функционира като имитация на докинг/скеле адаптер протеин Gab, който набира SHP-2 към мембраната, активирайки RTK сигнални компоненти (Hatakeyama, 2003). В такъв модел ключова разлика между Gab и CagA е, че докато Gab се регулира от активирането на RTK, фосфорилираният CagA създава състояние на конститутивна c-Met стимулация чрез непрекъснато активиране на SHP-2. Фосфорилираният CagA обаче не е напълно нерегулиран, тъй като изглежда инактивира своята киназа c-Src в отрицателна обратна връзка. Съобщава се, че това се случва чрез директно свързване на фосфорилиран CagA с c-Src (Selbach и др., 2003) и чрез свързване и активиране на CagA на С-терминална Src киназа (Csk), която след това тирозин фосфорилира и инактивира кинази от семейство Src (Tsutsumi и др., 2003).
Инактивирането на CagA на Src кинази е важно не само за ограничаване на активността на CagA, но също така води до дефосфорилиране на други AGS клетъчни протеини като езрин и кортактин (Selbach и др., 2003; 2004), което може да насърчи удължаването на клетките. Както езрин, така и коктактин модулират актиновата организация и е доказано, че регулират динамиката на актина по време на клетъчен контакт с патогени, включително ентеропатогенни Ешерихия коли, Салмонела и Криптоспоридий (Daly, 2004). Кортактинът свързва F-актин и Arp2/3 и в неговата нетирозин-фосфорилирана форма увеличава способността за кръстосано свързване на актин, което може да бъде важно за стабилизиране на актиновите снопове при индуцирано от CagA клетъчно удължаване. Ezrin е член на семейството на протеините ERM (ezrin-radixin-moesin) и се намира в специализирани мембранни области, като microvilli, където свързва F-актина с мембранните протеини (Bretscher и др., 2002). Докато е доказано, че фосфорилирането на треонин активира езрин, последицата от фосфорилирането на тирозин на езрин от Src и последващото му дефосфорилиране след инактивиране на Src е слабо разбрана.
Не само фосфорилирането на CagA е необходимо за голяма част от неговата активност в еукариотни клетки, но също така наличието, видът и броят на местата за фосфорилиране в CagA могат да обяснят разликите в щамовете във вирулентността. Мотивите са класифицирани като A, B, C или D, като мотиви A и B присъстват в почти всички клинични cagA+ изолати, докато мотивите C и D са специфични за щама (Higashi и др., 2002b). Мотив С се намира в изолати от западни страни и се нарича специфична за западната CagA последователност. Източните изолати не съдържат С мотива; вместо това те имат специфична за Източна Азия последователност CagA, наричана също EPIYA-D. Броят и видът на EPIYA мотивите са в положителна корелация с количеството фосфорилиран CagA в клетката и способността му да активира SHP ‐ 2 (Higashi и др., 2002b). Освен това, ефикасността на CagA активирането на SHP ‐ 2 е в положителна корелация с образуването на рак на стомаха (Azuma и др., 2004).
Независими от CagA ефекти на cag PAI
Заключения
По-непосредствени проучвания на H. pylori–Взаимодействията на хостовите клетки трябва да могат да отговорят на следните въпроси:
(i) Има ли протеинови субстрати на cag PAI TFSS различен от CagA и какъв е сигналът за секреция на TFSS? Може да се приложат стратегии за синтез на протеини, които са били успешни при идентифицирането на TFSS субстрати в други системи H. pylori.
(ii) Действа ли CagA като протеин-адаптер на скеле в еукариотни клетки и какви протеини гостоприемници са необходими за неговата сигнализация? По-специално какви субстрати на SHP-2 са необходими за ефектите на CagA върху клетките гостоприемници?
(iii) Как се пренася пептидогликан в цитоплазмата на гостоприемника? Изисква ли трансферът TFSS pilus? Ендоцитоза на гостоприемника? Мембранно сливане?
Само чрез изследване на механистичните детайли на взаимодействието между H. pylori и еукариотни клетки можем ли да се опитаме да разберем как се развиват тези клетъчни взаимодействия на тъканно и организмно ниво по време на съжителството през целия живот на бактерията и гостоприемника.
- Helicobacter Pylori Johns Hopkins Medicine
- Helicobacter pylori (H
- Helicobacter pylori, какво е това и как да се лекува
- Инфекцията с хеликобактер пилори влошава дисбиозата на чревния микробиом при деца с гастрит
- Нередовното време на хранене е свързано с инфекция с хеликобактер пилори и гастрит