Норико Каная
отдел по биология на рака, Изследователски институт Бекман, град Хоуп, Дуарте, Калифорния, САЩ
Стивън Вондерфехт
b Отдел по сравнителна медицина, Изследователски институт Beckman, City of Hope, Duarte, CA, USA
Шиуан Чен
отдел по биология на рака, Изследователски институт Бекман, град Хоуп, Дуарте, Калифорния, САЩ
Резюме
За да разберем по-добре как повишените нива на андроген регулират приема на храна и затлъстяването при жените, лекувахме овариектомирани женски мишки с дихидротестостерон (неароматизируем андроген), измервахме приема на храна и телесно тегло и оценявахме физиологичните промени в чернодробната функция, глюкозния толеранс и лептиновата резистентност.
Овариектомирани мишки бяха третирани с DHT или плацебо. След това мишките бяха хранени с високо съдържание на мазнини при условия на свободно хранене или хранене по двойки в продължение на 3 месеца. Установихме, че когато третираните с DHT мишки с овариектомия имат свободен достъп до храна (безплатно хранене), те имат увеличен прием на храна и по-високо телесно тегло в сравнение с контролните животни. Тези мишки също имат значително по-голямо натрупване на мазнини в черния дроб и показват повишена глюкоза на гладно, нарушен глюкозен толеранс и резистентност към лептин. Въпреки това, когато тези мишки бяха поставени на ограничена диета и хранени със същите калории като контролните (хранене по двойки), телесното им тегло се увеличава със същата скорост като контролните животни. Това предполага, че андрогенът регулира приема на храна чрез променена чувствителност към лептин и това увеличаване на приема на храна може значително да допринесе за фонотипа на затлъстяването.
В обобщение, демонстрирахме ролята на андрогена в регулирането на приема на храна и увеличаването на теглото при жените, използвайки модел на мишка. Този модел ще бъде полезен за допълнително изясняване на ролята на повишения андроген при жените.
1. Въведение
За да разберем по-добре как повишеният андроген регулира приема на храна и затлъстяването при жените, ние разработихме важен модел на мишка, като лекувахме OVX мишки с DHT и изследвахме приема на храна, телесното тегло, биосинтеза на мастни киселини, толерантността към глюкозата и чувствителността към лептин.
2. Материали и методи
2.1 Мишки
Мишките C57Bl/6J са получени от лабораторията Jackson (Bar Harbor, ME) и настанени в Центъра за животински ресурси на City of Hope във вентилирани багажни клетки със свободен достъп до вода. Мишките се поддържат в 12-часов цикъл светлина/тъмнина. Бяха спазени всички институционални насоки за грижи и употреба на животните. Всички процедури за изследване на животни, използвани в това проучване, бяха одобрени от институционалната комисия за грижи и употреба на животните (IACUC) в City of Hope за оценка и акредитация на лабораторни грижи за животните и бяха в съответствие с насоките на NIH.
Шестнадесет женски мишки C57B1/6J бяха овариектомизирани (OVX мишки) на 7-седмична възраст и 8 мишки са имали фалшива операция съгласно установен протокол (контролни фалшиви мишки). Фиктивната операция беше точно същата като процедурата за овариектомия, но яйчниците не бяха отстранени от мишките. OVX мишките бяха разделени на две групи: OVX-DHT и OVX-контрол (8 мишки на група) и подкожно имплантирани или с 12,5 mg/90 дневни пелетни 5α-DHT пелети (Innovative Research of America, Sarosota, FL) [ 13, 14] (OVX-DHT група) или плацебо пелети (OVX-контролна група). Фалшиви мишки бяха имплантирани с плацебо гранули (Sham група). Имплантирането на пелети се извършва по време на овариектомия (OVX-DHT; OVX-контрол) или фалшива операция (фалшива група). Всички мишки бяха хранени с 45 kcal% диета с високо съдържание на мазнини (Research Diet, Inc., New Brunswick, NJ).
2.1.1 Проучвания за свободно хранене
Започвайки една седмица след имплантирането на пелети и продължавайки в продължение на 3 месеца, мишките се хранеха според дизайна на „свободно хранене“ със свободен достъп до храна. Приемът на храна се измерва ежедневно и телесното тегло се измерва веднъж седмично в продължение на 3 месеца.
2.1.2 Проучвания за хранене по двойки
Започвайки една седмица след имплантирането на пелети и продължавайки в продължение на 3 месеца, мишките бяха хранени според дизайна на „хранене по двойки“. Въз основа на приема на храна в проучванията за безплатно хранене, ние идентифицирахме групата, която се храни най-малко (OVX-контрол). За проучванията за хранене по двойки, приемът на храна от OVX контролната група се определя ежедневно чрез изваждане на теглото на храната при измерването от първоначално добавеното тегло и на всички групи се дава същото количество храна (по тегло); OVX-DHT и фалшивите групи бяха хранени един ден след OVX-контролната група, за да се осигури идентичен калориен прием между групите. Теглото на тялото се измерва веднъж седмично в продължение на 3 месеца.
2.2 Събиране на тъкани и патологичен анализ
Всички мишки са гладували 4 часа преди евтаназия. От всички мишки се получава и претегля гонадална и ингвинална бяла мастна тъкан (WAT). Черният дроб се събира от всички мишки и се измерва мокрото тегло. След това левите дялове на черния дроб бяха фиксирани с 10% формалин за една нощ, обработени и вградени в парафин. Бяха получени 5 μm тъканни срезове, оцветени с хематоксилин и еозин и изследвани чрез светлинна микроскопия. (Десните дялове на черния дроб бяха използвани за PCR в реално време, както е описано в раздел 2.4).
Вакуолацията на хепатоцитите се оценява по 6-точкова полуколичествена, многостепенна скала, където 0 = по същество няма вакуолация и нарастващите резултати от 1 до 5 представляват нарастваща тежест на хепатоцелуларната вакуолация. Точкуването се извършва на сляпо (без знания за групата на лечението) в 3 различни сесии, разделени от поне 4 дни. Крайният вакулационен резултат представлява средната стойност на резултатите от 3 сесии. Всички хистопатологични анализи са проведени от сертифициран от борда ветеринарен патолог.
2.3 Измерване на чернодробните ензими
Всички мишки се гладуват в продължение на 4 часа, евтаназират се и кръвта се събира чрез сърдечна пункция и се центрофугира при 4000 rpm в продължение на 10 минути, за да се получи серум. Нивата на серумна аланин аминотрансфераза (ALT) са измерени чрез Antech Diagnostics (Irvine, CA).
2.4 PCR в реално време
2.5 Тест за толерантност към глюкоза
Тестове за толерантност към глюкоза се провеждат при мишки със свободно хранене след 2 месеца лечение. Мишките са гладували със свободен достъп до питейна вода в продължение на 18 часа преди теста. Изходните нива на глюкоза се записват за всяка мишка. След това на мишките се инжектира натоварване с глюкоза от 1,5 mg глюкоза/грам телесно тегло. Нивата на глюкозата преди и след инжектирането (30, 60, 120 и 180 минути) са измервани с помощта на глюкомер (Bayer, Германия).
2.6 In vivo тест за чувствителност към лептин
Проведени са in vivo тестове за чувствителност към лептин при мишки със свободно хранене на възраст от 3 месеца. Дни 1-3: измерва се телесното тегло и всички групи мишки се инжектират с носител (PBS) сутрин (8.00 ч. Сутринта) и следобед (16.30 ч.). Първоначалното телесно тегло беше изчислено като средно тегло по време на първоначалните (3 дни) PBS инжекции. Дни 4-6: измерва се телесно тегло и всички мишки се инжектират интраперитониално с рекомбинантен миши лептин (1 mg/kg) (PeproTech, Rocky Hill, NJ) сутрин (8.00 ч. Сутринта) и следобед (16.30 ч.). Дни 7-8: измерва се телесното тегло и на всички мишки се инжектира PBS сутрин (8.00 ч. Сутринта) и следобед (16.30 ч.).
2.7 Статистически анализ
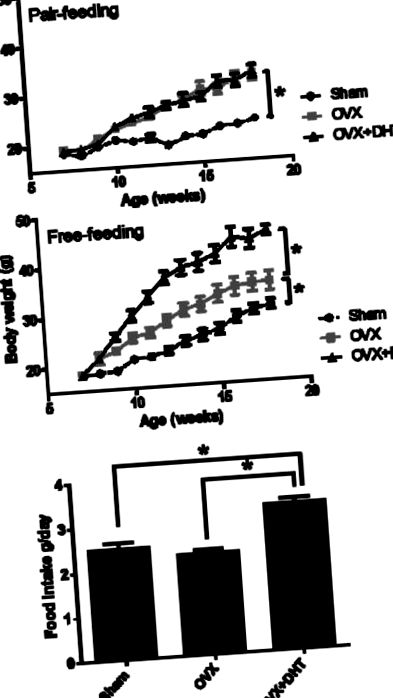
За многобройни сравнения анализът беше последван от сравнение на всички лекувани групи с контролната група (тест на Dunnett) или чрез сравняване на всички двойки лечение (тест на Tukey). Статистическата значимост е определена като P Фигура 1. След хранене по двойки, OVX-контролните мишки претеглят повече от фиктивни мишки, обаче, няма разлика в телесното тегло между OVX-DHT мишки и OVX-контролни мишки (Фигура 1А). След безплатно хранене, OVX-контролните мишки тежат повече от фиктивни мишки и лечението с DHT значително увеличава телесното тегло при OVX-DHT мишки в сравнение с OVX-контролите (Фигура 1В). По време на безплатното хранене приемът на храна с 45% ккал диета с високо съдържание на мазнини не се различава между фиктивни и OVX контролни мишки, но OVX-DHT мишките имат значително по-голям прием на храна, отколкото OVX контролните и фалшивите мишки (Фигура 1C).
(A) Средно телесно тегло при мишки с двойно хранене. (Б) Средно телесно тегло мишки без храна. (C) Среден прием на храна при свободно хранени мишки. Стойностите са изразени като средна стойност и стандартна грешка за 8 мишки. * P Фигура 2. Чернодробното тегло е леко увеличено при OVX-контролни и OVX-DHT мишки в сравнение с фиктивни мишки по време на хранене по двойки; ALT, маркер за чернодробно увреждане, не се променя (Фигура 2А и 2В). Въпреки това, по време на свободно хранене, чернодробното тегло и нивата на ALT при OVX-DHT мишки са значително по-високи от OVX контролни и фалшиви мишки. Няма разлика в теглото на черния дроб и нивата на ALT между OVX контролни и фалшиви мишки (Фигура 2А и 2В).
(А) Средно чернодробно тегло. (B) Средни серумни нива на ALT. (C) Вакуолация на черния дроб след свободно хранене. * P Фигура 2C). Тежестта на вакуолация сред черния дроб от OVX-контролната група е по-променлива, отколкото сред тези от фалшивата група; обаче средната тежест е била само минимално по-висока в OVX контролната група (2,00 ± 1,22), отколкото в фалшивата група. Вакуолацията в OVX контролната група обикновено се намира в средната зона на чернодробната лобула (Фигура 2С). Тежестта на вакуолацията в хепатоцитите от групата OVX-DHT е значително по-лоша, отколкото при другите лекувани групи (4.62 ± 0.40). Вакуолацията в черния дроб от тази група беше най-интензивна в центробуларните и средно-зоналните региони и понякога се простираше в порталните области на чернодробните лобули (Фигура 2С).
3.2.2 Биосинтез на мастни киселини и пътища на глюконеогнезис
Експресията на гени за биосинтез на мастни киселини и глюконеогнезис (Fas, SCD, ACC1, ACC2, SREBPc1, PEPCK и G6Pase) във всяка група мишки (OVX-DHT, OVX-контрол и фалшиво) след свободно хранене е показана на фигура 3 . Експресията на всички ензими за биосинтез на мастни киселини (Fas, SCD, ACC1 и ACC2) беше значително увеличена в черния дроб на OVX-DHT мишки в сравнение с OVX контролни мишки чрез PCR в реално време. Няма разлика в чернодробната експресия на тези ензими между OVX-контрола и фиктивни мишки. За ензимите на глюконеогенезата нивото на SREBPc1 е повишено при OVX-контролни мишки в сравнение с фиктивни мишки; и допълнително увеличение се наблюдава в черния дроб на OVX-DHT мишки. Експресията на PEPCK и G6Pase е увеличена в черния дроб на OVX-контролни мишки в сравнение с фалшиви мишки; експресията на тези гени обаче не се увеличава при мишките на OVX-DHT в сравнение с фалшивите мишки.
Експресията на гена се нормализира до β-актин. * P Фигура 4. WAT се увеличава при OVX-контролни мишки в сравнение с фиктивни мишки както при хранене по двойки, така и при свободно хранене, а лечението с DHT не променя теглото на WAD на гонадите при OVX-DHT мишки (Фигура 4А). Ингвиналният WAT беше увеличен при OVX контролни мишки в сравнение с фиктивни мишки както при хранене по двойки, така и при свободно хранене. Лечението с DHT не променя ингвиналното WAT тегло при свободно хранене, но ингвиналното WAT тегло намалява при OVX-DHT мишки по време на хранене по двойки (Фигура 4В).
(A) Средно тегло на гонадите и (B) ингвинално WAT. Стойностите са изразени като средна стойност и стандартна грешка за 8 мишки. * P Фигура 5. При OVX-DHT мишките изходните концентрации на глюкоза са значително по-високи, отколкото при OVX контролните мишки. В сравнение с фалшивата група, OVX-контролните мишки показват по-високи серумни концентрации на глюкоза 30 и 60 минути след инжектиране на глюкоза, но няма значителна разлика между серумните концентрации на глюкоза в тези групи. OVX-DHT мишките имаха значително по-високи нива на глюкоза след инжектиране в сравнение с OVX контролните мишки и имаше значителни разлики между тези групи в способността да изчистват глюкозата с течение на времето.
Стойностите са изразени като средна стойност и стандартна грешка за 8 мишки. * P Фигура 6. След инжектиране на лептин, телесното тегло на фалшиви мишки значително намалява (до ден 7) в сравнение с изходното ниво (ден 1). Мишките с OVX-контрол показват по-малко намаляване на телесното тегло след лечение с лептин (в сравнение с фиктивни мишки). Лечението с лептин обаче не променя телесното тегло при OVX-DHT мишки. Имаше значителни разлики в телесното тегло между фалшивите/OVX-контролни групи и OVX-DHT групата на ден 7 (Фигура 6).
Първоначалното телесно тегло се изчислява като средно тегло по време на първоначалните (3 дни) PBS инжекции преди инжектирането на лептин. Стойностите са изразени като средна стойност и стандартна грешка за 8 мишки. * P Naessen S, Carlstrom K, Garoff L, Glant R, Hirschberg AL. Синдром на поликистозните яйчници при булимични жени - оценка, базирана на новите диагностични критерии. Гинекол ендокринол. 2006; 22: 388–394. [PubMed] [Google Scholar]
- Асоциация на честотата на приема на пикантна храна и риска от коремно затлъстяване в селските райони
- Променена секреция на грелин при мишки в отговор на индуцирано затлъстяване и стомашен байпас на Roux-en-Y
- Сравнителен анализ на различни флавоноиди при регулирането на затлъстяването и диабета In vitro
- Антропометричен метод за определяне на „маскирано затлъстяване“ в младото японско женско население
- Забрана на реклами за нездравословна храна за борба с детското затлъстяване - Consumer Choice Center