1 Катедра по експериментална медицина, Секция по човешка физиология и клинична диетична служба, Втори университет в Неапол, Via Costantinopoli 16, 80138 Неапол, Италия
2 Медицински факултет, Университет в Салерно, Салерно, Италия
3 Факултет по двигателни науки, Университет в Неапол „Партеноп“, Неапол, Италия
Резюме
Разпространението на затлъстяването се увеличава в индустриализирания свят, така че Световната здравна организация разглежда затлъстяването като „пандемия“ при богатите популации. Автономната нервна система играе решаваща роля в контрола на енергийния баланс и телесното тегло. Този преглед обобщава нашите собствени данни и перспективи, като подчертава влиянието на автономната нервна система върху енергийните разходи и приема на храна, които са в състояние да определят телесното тегло. Активирането на симпатиковия разряд води до увеличаване на енергийните разходи и намаляване на приема на храна, докато намаляването на приема на храна и загубата на телесно тегло определя намаляване на симпатиковата активност. От друга страна, патофизиологичните механизми на затлъстяването включват промени в симпатиковата нервна система в съответствие с „Хипотезата на Мона Лиза“, съкращение от „повечето затлъстявания, известни с ниска симпатикова активност“. Освен това в този преглед се анализират парасимпатиковите влияния върху енергийните разходи, показващи, че увеличаването на парасимпатиковата активност може да предизвика парадоксално повишаване на енергийната консумация.
1. Въведение
Стабилността на телесното тегло и свързаните с това регулаторни процеси зависят от приема на хранителни вещества, но също така се влияят от компенсаторни генетично зависими метаболитни и невроендокринни механизми [1–4].
Контролът на поддържането на телесния състав е предмет на редица теории или пътища. Системите, които контролират приема на храна и/или разхода на енергия, могат да повлияят на телесното тегло. Няколко вещества са в състояние да повлияят на приема на храна. „Глюкостатичната хипотеза“ подчертава ролята на кръвната глюкоза, като се има предвид, че повишаването на нивото на кръвната захар предизвиква намаляване на приема на храна [5]. Лептинът, пептид, секретиран от бяла мастна тъкан, действа върху зоните на хипоталамуса, предизвиквайки намаляване на поглъщането на храна. Това е в съгласие с „липостатичната хипотеза“ на приема на храна [6, 7]. Стомашно-чревните хормони също намаляват приема на храна; това влияние е известно като „хипотезата за стомашно-чревен контрол на приема на храна“ [8, 9]. Вегетативната нервна система участва в контрола на хранителното поведение чрез влияния, оказвани върху производството и загубата на топлина [10, 11]. По този начин контролът на телесната температура е строго свързан с контрола на телесното тегло; това е в съгласие с „хипотезата за терморегулация” на приема на храна [12].
От друга страна, метаболитният баланс се контролира от автономната нервна система, така че вегетативните влияния влияят върху съхранението и консумацията на енергия.
Мастната тъкан действа като ендокринен орган, като произвежда различни сигнални цитокини, наречени адипокини (включително лептин, свободни мастни киселини, фактор на туморна некроза-
Въпреки че се съобщава, че нискочестотната лента (LF-HRV) представлява неинвазивен маркер на симпатиковата активност, има скорошни проучвания, които съобщават, че това предположение е противоречиво. LF мощността може да корелира повече с барорефлексната функция и/или стреса със сърдечната симпатикова инервация [15, 16]. Тази визия трябва да модифицира интерпретациите за симпатиковата функция в патофизиологията на затлъстяването.
Тъй като честотата на телесно тегло, превишаващо нормалните стойности, се увеличава в индустриализирания свят, Световната здравна организация разглежда затлъстяването като „пандемия“ при богатите популации. Изследването на механизмите, които контролират телесното тегло, придава все по-голямо значение на възможностите на новите стратегии за намаляване на случаите на наднормено тегло и затлъстяване, които често са свързани с метаболитни и сърдечно-съдови заболявания.
Този преглед представя нашите доказателства, показващи, че вегетативната нервна система контролира телесното тегло, като влияе върху приема на храна и консумацията на енергия. Общият изследователски проект беше да се тества влиянието на вегетативната нервна система върху енергийния баланс при различни условия, които променят симпатиковите и/или парасимпатиковите дейности.
2. Експериментални доказателства
2.1. Изследвания върху животни
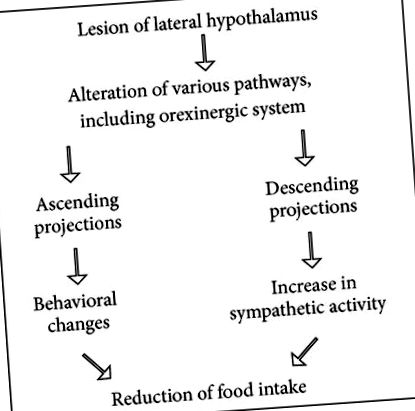
Ефектът от интраперитонеално инжектиране на лизин ацетилсалицилат е тестван върху (1) прием на храна и (2) усилване на симпатиката, индуцирано от лезия на страничния хипоталамус. Лизин ацетилсалицилат модифицира афагията чрез увеличаване на приема на храна и намалява усилването на симпатиковия разряд, индуцирано от страничната хипоталамусна лезия [17]. Електролитичната лезия в страничния хипоталамус регулира телесното тегло на по-ниско ниво. Лезираните плъхове губят телесно тегло по-бързо, отколкото фалшивите контроли, подложени на същата степен на лишаване от храна [18]. Този експеримент потвърждава, че увеличаването на симпатиковата активност намалява приема на храна (виж Схема 1), в съответствие с констатациите на Bray [19]. От друга страна, тези данни показват, че инхибиторът на синтеза на простагландин може да модифицира афагия, индуцирана от лезията на страничния хипоталамус, по време на намаляване на симпатиковия разряд.
 |
Скоростта на изстрелване на симпатиковите нерви към интерскапуларната кафява мастна тъкан и приема на храна се наблюдават при 24-часови мъжки плъхове Sprague-Dawley на гладно преди и след представянето на храната. Пироген (500 ng простагландин Е1) или физиологичен разтвор се инжектира в страничната мозъчна камера непосредствено преди представянето на храната. Увеличаването на симпатиковия разряд поради простагландин Е1 е свързано с намаляване на приема на храна [21]. Едновременното измерване на симпатиковата скорост на изпичане и приема на храна е най-хубавата демонстрация на обратната връзка между симпатиковата нервна система и приема на храна. Симпатиковата активност се повишава, преди да се прекрати приема на храна. Това предполага, че повишаването на симпатиковия разряд служи като ендогенен сигнал за ситост (вж. Схема 3).
2.2. Човешки изследвания
3. Дискусия и заключение
От друга страна, други фактори, различни от „хипотезата на Мона Лиза“, трябва да бъдат взети предвид при генезиса на затлъстяването. „Липостатичната хипотеза“ показва, че адипокините като лептин могат да играят решаваща роля за увеличаването на телесното тегло. Намаляването на нивото на лептин сигнализира на мозъка за увеличаване на храненето и намаляване на енергийните разходи. Лептинът е важен фактор, свързващ енергийните запаси с хранителното поведение [35]. „Хипотезата за стомашно-чревни хормони“ предполага, че чревните хормони са замесени в контрола на телесното тегло. Тези хормони регулират апетита, енергийните разходи и глюкозната хомеостаза. Те могат да действат или чрез циркулацията в прицелните периферни тъкани, чрез активиране на блуждаещия нерв, или чрез въздействие върху ключови мозъчни области, замесени в енергийната хомеостаза като хипоталамуса и мозъчния ствол [36, 37]. В заключение, всички фактори на докладваните хипотези могат да си сътрудничат синергично, за да предизвикат промяна в телесното тегло [38].
Препратки
- Тяло в баланс TCM; s Перспектива за отслабване TCM World
- Закуската ползва енергия, контрол на теглото и др
- Сладък начин да кажете „не“ на наддаването на тегло и терапия на базата на захарен диабет за контрол на телесното тегло,
- 20 000 стъпки на ден Отслабване марш към тялото на вашите мечти
- 5-HTP за контрол на теглото PeaceHealth
