Лу Джуанг
1 Свързана детска болница Bayi, Седмият медицински център на Обща болница PLA, Пекин 100700, Китай
4 Национална инженерна лаборатория за предотвратяване на вродени дефекти и контрол на ключовите технологии, Пекин 100700, Китай
5 Пекинска ключова лаборатория за детска органна недостатъчност, Пекин 100700, Китай
Хайхуа Чен
1 Свързана детска болница Bayi, Седмият медицински център на Обща болница PLA, Пекин 100700, Китай
2 Първата клинична академия на Медицинския университет в Далиан, Далиан 116011, Китай
Шън Джанг
1 Свързана детска болница Bayi, Седмият медицински център на Обща болница PLA, Пекин 100700, Китай
4 Национална инженерна лаборатория за предотвратяване на вродени дефекти и контрол на ключовите технологии, Пекин 100700, Китай
5 Пекинска ключова лаборатория за детска органна недостатъчност, Пекин 100700, Китай
Jiahui Zhuang
3 Колеж по околна среда, Североизточен нормален университет, Чанчун 130117, Китай
Qiuping Li
1 Свързана детска болница Bayi, Седмият медицински център на Обща болница PLA, Пекин 100700, Китай
4 Национална инженерна лаборатория за предотвратяване на вродени дефекти и контрол на ключовите технологии, Пекин 100700, Китай
5 Пекинска ключова лаборатория за детска органна недостатъчност, Пекин 100700, Китай
Жичун Фън
1 Свързана детска болница Bayi, Седмият медицински център на Обща болница PLA, Пекин 100700, Китай
4 Национална инженерна лаборатория за предотвратяване на вродени дефекти и контрол на ключовите технологии, Пекин 100700, Китай
5 Пекинска ключова лаборатория за детска органна недостатъчност, Пекин 100700, Китай
Резюме
Трилиони микроби се намират в човешкото тяло и участват в множество физиологични и патофизиологични процеси, които засягат здравето на гостоприемника през целия жизнен цикъл. Микробиомът се отличава с отличителни композиционни и функционални характеристики през различни периоди от живота. Натрупващите се доказателства показват, че микробите, пребиваващи в човешкото тяло, могат да играят фундаментална роля в развитието на бебето и съзряването на имунната система. Смята се, че чревните микроби са от съществено значение за улесняването на детското и детското развитие и имунитет чрез подпомагане на разграждането на хранителните вещества за освобождаване на хранителни вещества, защита срещу патогени, стимулиране или модулиране на имунната система и упражняване на контрол над оста хипоталамус-хипофиза-надбъбречна жлеза. Този преглед има за цел да обобщи сегашното разбиране за колонизацията и развитието на чревната микробиота през ранен живот, подчертавайки последните констатации относно ролята на чревните микроби в педиатрията заболявания. Освен това, ние също обсъждаме медикаментите, медиирани от микробиота, които могат да преконфигурират бактериални съобщества за лечение на дисбиоза.
Въведение
Следващите раздели обобщават наскоро придобити доказателства относно формирането и развитието на човешката инфантилна чревна микрофлора, обсъждат се промените в човешкия чревен микробиом при педиатрични заболявания и се представят стратегии, които могат да бъдат използвани за директна манипулация на чревната микробиота през ранните етапи на живота в хората.
Колонизация и развитие на чревната микробиота през ранния живот
Колонизация на чревната микробиота преди раждането
Фактори, оформящи чревната микробиота по време на ранен живот и развитие
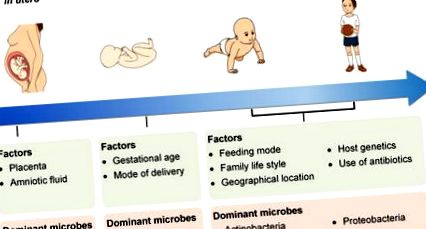
Наличието на микроби в плацентата и околоплодната течност предполага колонизация на плода вътреутробно с доминиран от протеобактерии микробиом. По време на неонаталния период гестационната възраст и начинът на раждане влияят върху микробната колонизация при новороденото. Промените във възрастта и режима на хранене, семейния начин на живот, географското местоположение, генетиката на бебето, както и използването на антибиотици допълнително конфигурират микробиома в ранния живот. Микробиотата става все по-разнообразна с течение на времето, а доминиращите микроби са Actinobacteria и Proteobacteria.
Въпреки това, въпреки че натрупващите се данни сочат, че плодът може да наследи микробите на майката още преди раждането, има противоречия относно микробната колонизация преди раждането. Може да се наложи преразглеждане на хипотезата за „вътреутробна колонизация“, тъй като тези проучвания са проведени предимно с помощта на молекулярни методи, които не са подходящи за изследване на микробни съобщества с ниско изобилие, поради липсата на подходящ контрол за оценка на замърсяването [16], [17].
Развитие на микробиотата след раждането
В допълнение към режимите на раждане и хранене, други фактори, включително гестационната възраст при раждане, географското местоположение, семейния начин на живот, генетиката на приемника и употребата на антибиотици, също са отговорни за колонизацията на микробиотата на бебето в червата (Фигура 1). Недоносените бебета обикновено се представят с незрели стомашно-чревни, дихателни, неврологични и имунологични системи. Следователно недоносените деца често са изложени на медикаментозно лечение, особено широкото използване на антибиотици. Тези новородени обикновено се нуждаят от дългосрочна хоспитализация и получават парентерално хранене и механична вентилация, което може да повлияе на естествения процес на колонизация и развитие на микробиотата и може да доведе до отклонение в установяването на чревната микробиота или отклонен състав на чревна микробна флора [39]. При недоносените новородени колонизацията на червата на коменсалните анаеробни микроби се забавя. Следователно, фекалният материал на недоносените бебета съдържа значително по-високи нива на Enterococcus, Enterobacteriaceae и опортюнистични патогени от фекалния материал на новородени новородени [25], [40], [41], [42], [43], [44].
Географското местоположение може да повлияе на модела на колонизация на чревната микробиота на бебето [37] поради различни културни практики и регионални диети. Едно проучване съобщава за наличието на „географски градиент“ в чревната микробна флора на европейските бебета. Тоест, бебетата от северноевропейските страни имат по-високи нива на бифидобактерии, докато бебетата от южноевропейските страни имат по-разнообразна микробиота с по-голямо разпространение на Bacteroides [45].
Освен това, доказателства от едно проучване, проведено в Холандия, разкриват, че делът на Bifidobacterium spp. при бебета с братя и сестри е по-високо от това при бебета без братя и сестри [46]. Освен това присъствието на домашни любимци в домакинството оказва влияние върху състава на чревната микробиота [47].
Интересното е, че голямо кохортно проучване, в което се включват 1514 субекта за оценка на въздействието на генетиката на гостоприемника върху чревната микробиота, пътищата и категориите на генната онтология, разкрива връзка между генотипа на гостоприемника и таксономията на чревната микробиота в зряла възраст [48]. Следователно трябва да се има предвид въздействието на генотипа гостоприемник върху колонизацията и развитието на чревната микробна флора на бебето. Установено е също така, че наличието на функционален единичен нуклеотиден полиморфизъм (SNP) в гена, кодиращ лактаза-флоризин хидролаза (LCT), е свързано с изобилието от Bifidobacterium, като по този начин предоставя доказателства за взаимодействие между гените и диетите при регулирането на изобилието на Bifidobacterium.
И накрая, хищничеството на фаги е друга мощна сила, която влияе върху структурата и динамиката на състава на микробиотата [39].
Чревна микробиота и детски заболявания
Риск от неонатални патологии
Некротизиращият ентероколит (NEC) и късното начало на сепсиса (LOS) са две основни заплахи за живота на новороденото и тяхното възникване е тясно свързано с чревната микробиота (Фигура 2). При недоносени новородени рискът от развитие на НЕК и сепсис се засилва [49], [50]. Освен това, бебетата с NEC са по-склонни да развият LOS, главно поради транслокацията на чревни бактерии, като ентеробактерии [42], [43]. Спекулира се, че обостреният имунен отговор на Enterobacteriaceae на високо ниво може да насърчи бактериалната транслокация и да увеличи риска от развитие на NEC, сепсис и други възпалителни състояния [51]. Много метагеномни проучвания показват, че в сравнение със здрави бебета, бебетата, които са развили LOS, приютяват по-малко разнообразна микробиота и имат по-ниски нива на Bacteroides и Bifidobacterium и преобладаване на ентеробактерии в червата [52], [53], [54]. В допълнение, констатацията, че голяма част от бебетата с LOS споделят едни и същи бактерии в изпражненията им, дава силен аргумент за бактериална транслокация [55], [56]. Освен това, някои изследвания показват, че разнообразието на чревната флора намалява, докато изобилието от специфични патогени се увеличава при бебета, които са развили NEC [57], [58]. Понастоящем обаче няма консенсус по този въпрос.
Схематично представяне на връзката между чревния микробиом и мозъка-оста на червата
Чревната микробиота участва в стимулирането или модулирането на имунната система на червата и непряко упражнява контрол над оста хипоталамус-хипофиза-надбъбречна жлеза. Смята се, че дисбиозата на чревната микробиота е отговорна за редица педиатрични заболявания, включително некротизиращ ентероколит, късно настъпващ сепсис, екзема, астма, хранителна алергия, T1DM, затлъстяване, синдром на раздразнените черва, възпалителни заболявания на червата и невропсихични разстройства. T1DM, захарен диабет тип 1.
При недоносени бебета микробната дисбиоза, предшестваща NEC, се характеризира с повишено ниво на протеобактерии и намалени нива на Firmicutes и Bacteroidetes [59]. Stewart et al. са докладвали, че няма значителна разлика в средния брой на всички бактериални видове между кърмачета с NEC и здрави бебета. Въпреки това, бактериалният състав се различава между тези две групи бебета, като се установява, че Sphingomonas преобладава при бебета, които са диагностицирани с NEC по-късно [60], [61]. Освен това ниското микробно разнообразие може да предизвика свръхрастеж на патогенни бактерии, което също се счита за важен фактор, който допринася за развитието на NEC. Изглежда обаче, че няма особен състав на чревна микробиота, който предразполага новородено към NEC.
Екзема
Астма
Хранителна алергия
Захарен диабет тип 1
Затлъстяване
Затлъстяването влияе не само върху появата, но и върху развитието на метаболитни заболявания, като сърдечно-съдови заболявания, захарен диабет тип II (DM2), ракови заболявания и остеоартрит [101]. Последните проучвания, включващи хора и животински модели, демонстрират, че дисбиозата на чревната микробиота участва в развитието на затлъстяване (Фигура 2). Броят на бифидобактериите във фекални проби по време на ранна детска възраст е по-висок при деца с нормално тегло, докато количеството на Staphylococcus aureus е по-голямо при деца с наднормено тегло [102]. В допълнение, кохортно проучване, включващо 909 едномесечни деца, които са били проследявани от едномесечна до 10-годишна възраст, разкрива, че нивото на колонизация на Bacteroides fragilis на едномесечна възраст е свързано с повишен индекс на телесна маса (ИТМ ) z-резултати при деца до 10-годишна възраст [103]. Експериментални модели предполагат няколко механизма, лежащи в основата на корелацията на чревните микроби със затлъстяването и други метаболитни заболявания. Те включват повишено усвояване на диетична енергия, насърчаване на отлагането на мазнини, модификация на двигателната активност, ефекти на ситост и системно активиране на възпалението [104], [105], [106], [107]. Ролята на микробиотата в генезиса на затлъстяването може да разшири възгледите за контрол на теглото и лечение на затлъстяването.
Синдром на раздразнените черва
Възпалително заболяване на червата
Невропсихиатрични разстройства
Манипулация на чревни микроби
Антибиотици
Антибиотиците, които обикновено се използват за предотвратяване или лечение на инфекции, които не са непременно причинени от определен патоген, могат ефективно да изчерпят чревната микробиота. Новородените с NEC имат висок риск от инфекция, причинена от микроби в червата, и антибиотиците често се използват за предотвратяване или лечение на тези инфекции [141]. За лечение на детска IBD, прилагането на единичен антибиотик е от полза за пациенти с усложнения, като фистули и абсцеси, докато широките антибиотични комбинации могат да подобрят клиничните резултати [142], [143]. Съществува обаче голям риск, свързан с употребата на антибиотици при малки деца. Многобройни доказателства показват, че антибиотиците влияят върху способността ни да се противопоставяме на инфекцията, функцията на имунната система и способността ни да преработваме храната [144]. Нарушаването на чревната микробиота може да доведе до дългосрочни последици за здравето, включително намалено производство на витамини, намалена абсорбция на хранителни вещества и повишени рискове от диабет, астма, затлъстяване и инфекции [145].
Пребиотици и пробиотици
Диетична модификация
Трансплантация на фекална микробиота
Перспективи
Балансираната симбиоза на чревната микробиота е тясно свързана със здравето на човека, въпреки че тази голяма, разнообразна и динамична популация отдавна е пренебрегвана. С подобряването на техниките за наблюдение и разследване беше установено, че симбиотичните микробни общности взаимодействат с повечето органи на гостоприемника и имат уникален състав и функционални характеристики на различни етапи от живота. Чревната микробиота играе важна роля за съзряването на имунната система, особено в ранните етапи от живота и по време на растежа и развитието на бебето.
Предполага се, че процесът на колонизация и развитие на чревната микробиота в ранен живот е свързан със заболявания в по-късния живот. Натрупващите се доказателства от различни проучвания показват, че появата на заболяване често се предшества от ранни изменения на микробиотата. Предвид потенциалната индивидуална физиологична роля, се препоръчва микробиомът да бъде добър предиктор за риска от заболяване. Предвиждаме, че рискът от редица сложни, свързани с начина на живот и свързани с възрастта човешки нарушения, като метаболитни, възпалителни и невродегенеративни заболявания, може да бъде предвиден и стратифициран чрез характеризиране на нарушена микробиота. Природата и механизмите, чрез които микробиотата се променя по време на живота и средствата, чрез които тези промени засягат биологичните пътища, трябва да бъдат по-добре разбрани.
Конкуриращи се интереси
Авторите не са декларирали конкуриращи се интереси.
Благодарности
Това проучване беше подкрепено от Националната фондация за естествени науки на Китай (грант № 81671504 и 81401248) и медицинския проект Sanming в Шенжен, Китай (грант № SZSM201606088). Благодарим на проф. Шунсинг Джанг и проф. Абхай К. Лода за полирането на ръкописа.
Бележки
Обработва се от Канг Нинг
Бележки под линия
Партньорска проверка под отговорността на Пекинския институт по геномика, Китайска академия на науките и Обществото на генетиците на Китай.
- Високи пържоли Масивни ползи за здравето от яденето на говеждо месо - нашият палео живот
- Месец за информираност за гинекологичния рак Ранната диагностика предоставя на пациентите по-добро качество на живот,
- Диетата с ниско съдържание на протеини в ранен живот увеличава продължителността на живота на плодовите мухи
- Чревен тон Жизнена сила Международен преглед Баланс на тялото Течни витамини Цялостни хранителни добавки
- Здравето ми има значение Моята чревна сага, част 5 Monastyrsky и Kwasniewski