Свързани данни
РЕЗЮМЕ
ВЪВЕДЕНИЕ
Усъвършенстваното натрупване на крайния продукт на гликиране (AGE) е източник за усложнения на СД и е известно, че увеличава риска от артросклероза (Saremi et al., 2017), ретинопатия и бъбречна недостатъчност (Beisswenger et al., 1995). AGEs също се натрупват в по-голяма степен при IVD на хора с диабет, където са свързани с повишени ензими, разграждащи матрицата (Tsai et al., 2014). При плъхове СД тип II се свързва с дегенеративни промени в IVD, включително загуба на гликозаминогликан и втвърдяване на IVD, които отново се дължат на натрупване на AGE (Fields et al., 2015). По-рано демонстрирахме, че DM мишки тип I са имали повишено структурно разрушаване на IVD и провъзпалителни цитокини, които са свързани с натрупване на AGE (Illien-Jünger et al., 2013). Ние вярваме, че AGE са вероятно източник на омрежване и катаболизъм при IVD, но не е ясно дали AGE могат да се натрупват в аваскуларната IVD от поглъщане на диети с висок AGE или да изискват хипергликемични състояния от DM.
AGE са силно окислителни съединения, които могат да се натрупват в тъканите чрез ендогенни (т.е. хипергликемия) и екзогенни (т.е. термично обработени храни) източници; 10% от хранителните AGE се абсорбират през червата и се освобождават в кръвта (Koschinsky et al., 1997). Тревожно е, че през последните 20 години консумацията на западни диети, състоящи се от силно преработени храни, значително се е увеличила, като също така е увеличила разпространението на затлъстяването и DM (Cordain et al., 2005).
Наскоро показахме при застаряващи преддиабетни мишки, че хроничното поглъщане на диети, обогатени със специфичния AGE предшественик (метилглиоксал), ускорява загубата на кост на гръбначните кости и предизвиква натрупване на AGE в крайната плоча (Illien-Jünger et al., 2015). При по-нататъшно проучване, поглъщането на диетични AGEs предизвиква сексуално зависима костна загуба с по-ниски биомеханични свойства при млади (6-месечни) женски мишки (Illien-Jünger et al., 2018). Тези проучвания предоставят първите доказателства, че хранителните AGEs имат пряк ефект върху вертебралната структура и функция и също така показват, че този ефект зависи от пола. Освен това, въпреки че крайната плоча има силно имунооцветяване за AGEs, остава неясно дали AGEs на диетата могат да се натрупват в IVD и да допринасят за структурни или катаболни промени, за които е известно, че присъстват при дегенерация. Следователно целта на настоящото проучване е да се оценят ефектите на диетите AGE върху структурата и функцията на IVD при женски и мъжки мишки. Предполагаме, че хроничното поглъщане на диета с висок AGE ще се натрупва в IVD и ще доведе до структурно нарушение на IVD, специфично за пола, и функционални промени, включващи повишено AGE омрежване и увреждане на колагена.
РЕЗУЛТАТИ
Общо наблюдение
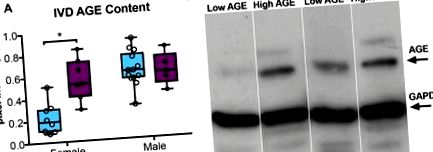
Въпреки че няма значителни разлики между женски мишки с ниско (L) -AGE и високо (H) -AGE [телесно тегло: L-AGE = 26.6 ± 4.1 g, H-AGE = 26.3 ± 2.6 g, незначително (n.s.); кръвна глюкоза на гладно: L-AGE = 79,2 ± 15,3 mg/dl, H-AGE = 84,2 ± 18,7 mg/dl, ns], мъжките H-AGE мишки имат леко намалено телесно тегло и повишена кръвна глюкоза на гладно в сравнение с L-AGE при мъжете мишки (телесно тегло: L-AGE = 29,6 ± 1,2 g, H-AGE = 27,3 ± 1,3 g, P = 0,002; кръвна захар на гладно: L-AGE = 71,2 ± 10,6 mg/dl, H-AGE = 88,4 ± 11,6 mg/dl, P = 0,006). Консумацията на храна, записана през последния месец преди жертвоприношение, показва значително по-нисък прием на чау в H-AGE в сравнение с L-AGE мишки от двата пола (жени: L-AGE = 4,6 ± 0,4 g/ден, H-AGE = 3,1 ± 0,3 g/ден, P Фиг. 1) от женски H-AGE в сравнение с женски L-AGE мишки, както се вижда от Western blot анализ. Докато се очакват множество AGEs в серума и IVD, данните от Western blot разкриват най-забележимата лента при приблизително 70 kDa, което е прогнозният размер на карбоксиметил лизин, един от най-разпространените и разпространени AGEs, открити in vivo (Ikeda et al., 1996; Schleicher et al., 1997). Ние вярваме, че карбоксиметил лизинът е основният AGE, който се открива чрез този метод на Western blot. Увеличението на AGEs е в съответствие с наблюдаваното нарастване на общите AGEs в циркулация, открити в H-AGE в сравнение с L-AGE жени, както се вижда чрез анализ на серумен ELISA (16,9 ± 4,3 U/ml срещу 9,5 ± 4,8 U/ml, P = 0,01 ). Не се наблюдават разлики в нивата на AGE в IVD или серум при мъжки мишки (серумен AGE, мъжки: 11,7 ± 4,2 U/ml (H-AGE) срещу 8,3 ± 1,6 1,6 U/ml (L-AGE), n.s.). Тези данни предполагат, че хранителните AGEs се натрупват системно и вероятно също се натрупват в IVD тъкан при липса на DM или затлъстяване при женски мишки. Диетичният ефект от натрупването на AGE се подкрепя допълнително от нашето предишно проучване, при което диетата H-AGE увеличава съдържанието на AGE в серума с 80%, докато стареенето води само до 60% натрупване на AGE в серума при женски мишки (Illien-Jünger et al., 2018 ). Не са наблюдавани разлики при мъжки мишки.
Възрастово натрупване в IVD. (A) Western blot анализ показва по-голямо съдържание на AGE протеин в H-AGE женски (n = 7) IVD в сравнение с L-AGE жени (n = 9), без разлики между H-AGE (n = 5) и L-AGE (n = 13) мъже. Данните са представени като графики от минимум до максимум ± sd. P-стойностите се основават на двустранен несдвоен t-тест на Student с корекция на Bonferroni и значителен, ако P≤0,05 (*). (Б) Представителен AGE уестърн блот с представителни ленти за AGE и GAPDH (вътрешен контрол). Положителна контрола AGE-BSA беше използвана за валидиране на измерените AGE ленти. Поради ниската концентрация на протеин в някои проби, някои проби трябваше да бъдат обединени, за да се гарантират правилни измервания.
Диетичните AGEs променят биомеханичните свойства на женските IVD
Функционалната оценка на IVD беше извършена чрез аксиално компресионно-напрегнато и торсионно биомеханично изпитване на каудални сегменти на IVD движение. Биомеханичните свойства, както е показано на фиг. 2, са изчислени от втория до последния цикъл на кривите на въртене на въртящия момент (фиг. 3) и изместване на силата (фиг. 4). IVD на женски H-AGE мишки са имали значително повишена скованост на натиск (+ 70%, P Фиг. 5 A) и увеличен обхват на въртящия момент (+ 47%, P = 0,031, Фиг. 5 E) в сравнение с женски L-AGE мишки. Анализът на отказите показва, че крайният отказ е настъпил при по-голям въртящ момент при женски H-AGE в сравнение с L-AGE мишки (+ 46%, P = 0,05, фиг. 5 F) и по подобен начин извършената работа до отказ, която е сравнима с материала жилавост, също се увеличава при женски H-AGE в сравнение с L-AGE мишки (+ 129%, P = 0,04, фиг. 5 H). Не са наблюдавани разлики за твърдост на опън, аксиален обхват на движение, твърдост на усукване (фиг. 5 BD) или зони на напречно сечение на IVD (площ на напречното сечение: L-AGE: 1,89 ± 0,24 mm 2; H-AGE: 1,75 ± 0,28 mm 2, P> 0,05). Мъжки IVD не са били засегнати от диета в нито един от измерените биомеханични параметри (фиг. 5; площ на напречното сечение: L-AGE = 1,65 ± 0,39 mm 2, H-AGE = 1,78 ± 0,17 mm 2, P> 0,05). Тези данни показват, че поведението на сегмента на движение при компресия и усукване се променя при женски мишки на диета H-AGE.
Биомеханични тестови анализи. (А) Схема на кривите на изместване на силата за аксиално компресиране на опън и усукване, показващи линейни области, използвани за измерване на твърдост, области, измерени за аксиален обхват на движение и обхват на въртящия момент. CW, по посока на часовниковата стрелка; CCW, обратно на часовниковата стрелка. (B) Схема на кривата на усукване до повреда, показваща точката на краен отказ и площ под кривата, изчислена като извършена работа до отказ.
Представителни криви на изместване на въртящия момент. Тези криви представляват втори до последен цикъл на торсионно натоварване на (A, B) женски и (C, D) мъжки L-AGE и H-AGE сегменти на движение, съответно.
Представителни криви на изместване на силата. Тези криви представляват втория до последния цикъл на аксиално натоварване с компресионно напрежение на (A, B) женски и (C, D) мъжки сегменти на движение L-AGE и H-AGE, съответно.
Биомеханично изпитване на опън-компресия и усукване. (A) Повишена твърдост на сгъстяване при H-AGE женски ('F') (n = 11) в сравнение с L-AGE F (n = 10), без разлики в (B) якост на опън, (C) аксиален обхват на движение или (D) твърдост при усукване. (E) Диапазонът на въртящия момент е увеличен в H-AGE F (n = 8) в сравнение с L-AGE F (n = 7). Анализът на отказите разкрива, че въртящият момент на въртене (F) и (H) работа до повреда се увеличават в H-AGE F (n = 7) в сравнение с L-AGE F (n = 6), без разлика в крайната повреда (G) степен. Не бяха открити разлики между L-AGE мъже (‘M’) (n = 5) и H-AGE M (n = 7). Данните са представени като графични полета от минимум до максимум ± sd. P-стойностите се основават на двустранен несдвоен t-тест на Student с корекция на Bonferroni и значим, ако P≤0.05. * P≤0,05, ** P≤0,001.
Диетичните AGEs променят организацията на пръстеновидния фиброз при IVD на жени
За оценка на морфологичните промени в IVD, изображенията на Picrosirius Red и Alcian Blue (PR/AB) бяха изобразени под диференциален интерференционен контраст (DIC) и поляризирани филтри. DIC изобразяването не показва значителни промени в морфологията на ядрото пулпос или крайната плоча (фиг. 6 А). Въпреки това, когато се изобразяват под поляризирани филтри, колагеновите влакна на пръстеновидни фибрози (AF) на женски мишки изглеждат по-ярки в H-AGE в сравнение с L-AGE групата, без разлики между мъжки IVD (фиг. 6 B). Тези разлики се забелязват най-видно при предния AF, където колагеновите ламели се появяват като зелен/жълт цвят. Тези данни показват разлика в двойното пречупване на колагеновите влакна при женските H-AGE и L-AGE.
Хистологичен анализ на IVD морфология. Представителни сагитални участъци, оцветени с Picrosirius Red/Alcian Blue (PR/AB), изобразени под (A) диференциална контрастна разлика (DIC) и (B) поляризирана светлина. Не са наблюдавани разлики в крайната плоча и ядрото на пулпоза между жените от двете диети. Поляризираните изображения показват разлика в яркостта на колагеновите влакна на пръстеновидно фиброзно (AF) между L-AGE (n = 5) и H-AGE (n = 8) женски. Не са наблюдавани разлики между L-AGE (n = 5) и H-AGE (n = 7) мъже. Скала: 100 μm.
Диетичните AGEs нарушават качеството на колагена при IVD при жени
За да изследваме качеството на колагена, използвахме двуфотонно изобразяване, за да определим количествено интензивността на втората хармонична генерация на колаген (SHG) и хибридизиращия колаген пептид (CHP), който разкрива увредени молекули на колаген. При женски, но не и при мъжки мишки, SHG, измерен в предния AF, изглежда по-малко ярък в H-AGE в сравнение с L-AGE фотомикрографиите (фиг. 7 А). Това беше потвърдено с количествени измервания на интензивността на SHG, която беше значително намалена при женски H-AGE в сравнение с IVD на L-AGE (P = 0,037, фиг. 7 С). Освен това, в същия регион, измерването на двуфотонната възбудителна флуоресценция (TPEF)/SHG или общата AGE автофлуоресценция (Marturano et al., 2014) е увеличено при H-AGE при жените в сравнение с IVD на L-AGE (P = 0,03, фиг. 7 Б). CHP оцветяването на същите хистологични разрези разкрива значително повишено CHP (зелена флуоресценция) оцветяване в AF на женски H-AGE в сравнение с L-AGE IVD (P = 0,03, фиг. 8), което показва по-голямо увреждане на колагена. Изравняването на колагеновите влакна (измерено чрез кохерентност на влакната) или организацията на ламелите (измерено чрез фактор на изкривяване) изглежда не се влияе от натрупването на AGE. Не са наблюдавани разлики за който и да е параметър при мъжки мишки. Тези данни показват, че диетата H-AGE е довела до натрупване на AGE и увреждане на колаген в AF само на женски мишки.
SHG на колаген в тъканта на пръстеновиден фиброз (AF). (А) Представителни изображения с район на интерес, очертан в синьо. (B) AGE автофлуоресценцията се увеличава и (C) SHG интензивността е намалена при H-AGE женски ('F') (n = 6) в сравнение с L-AGE F (n = 7), без разлики в (D) относителния колаген ориентация на влакната или (E) ламеларно извиване на ламелите. Не са открити разлики между мъжете (L-AGE M и H-AGE M, n = 5 на група). Данните са представени като графични полета от минимум до максимум ± sd. P-стойностите се основават на двустранен несдвоен t-тест на Student с корекция на Bonferroni и значими, ако P≤0.05 (*).
Молекулярна оценка на колагена. (A) Оцветените с CHP флуоресцентни изображения на предния AF показват повишено CHP оцветяване в H-AGE в сравнение с L-AGE при жени („F“) и мъже („M“). Областта на интерес е очертана в синьо. (B) Количественото определяне на средната интензивност на CHP показва значително увреждане на колагена в H-AGE F (n = 5) в сравнение с L-AGE F (n = 7). Не са открити разлики при мъжете (L-AGE M n = 4, H-AGE M n = 5). Данните са представени като графични полета от минимум до максимум ± sd. P-стойностите се основават на двустранен несдвоен t-тест на Student с корекция на Bonferroni и значими, ако P≤0,05 (*).
ДИСКУСИЯ
Биомеханични тестове
Всички проби преминаха само един цикъл на замразяване-размразяване, тъй като това може да повлияе на IVD механичните свойства (Azarnoosh et al., 2017). Преди механичното изпитване сегментите на движение бяха размразени и хидратирани в студена 1 × PBS за 5-10 минути и диаметрите на IVD бяха измерени с помощта на дебеломер. Сегментите на каудалното движение бяха използвани за биомеханични тестове поради тяхната цилиндрична геометрия и относително големи височини на IVD и гръбначните прешлени, които правят захващането и тестването по-прости, отколкото използването на сегменти на лумбалното движение за тези малки проби на мишката. Предишни проучвания сравняват торсионното и компресионно механично поведение на лумбалните и опашните дискове на плъхове и показват, че каудалните IVD имат малко по-голяма неутрална зона и по-ниска скованост от лумбалните гръбначни области (Espinoza Orías et al., 2009; Sarver и Elliott, 2005).
Хистологична оценка
IVD морфология
Фиксираните, калцирани лумбални сегменти се вграждат в поли (метилметакрилат) (PMMA) и се изрязват 5 μm сагитални участъци. Средните сагитални срезове бяха оцветени с PR/AB, за да се оцени съответно съдържанието на колаген и протеогликан. След това се изобразяват PR/AB оцветени разрези под DIC, използвайки Axio Imager Z1 (Zeiss, Oberkochen, Германия), за да се оцени цялостната IVD морфология и състав. След това същите проби бяха изобразени под поляризирана светлина с помощта на LEICA DM6 B (Leica Microsystems, IL, САЩ) за качествена оценка на организацията и подреждането на AF колаген. За всички хистологични анализи, докато размерите на пробите първоначално са били балансирани между групите, крайните числа варират във всяка група, тъй като за сравнение са използвани само срединни сагитални участъци и всички несагитални участъци са изключени от анализа; всички изключения поради технически грешки с оцветяване също бяха изключени.
Молекулярна оценка на колагена
Вградените в PMMA средно-сагитални лумбални секции бяха оцветени с помощта на хибридизиращ колаген пептид-биотин конюгат (B-CHP; BIO300, 3Helix Inc; Salt Lake City, UT, USA), за да се установи наличието на увреждане на колагена, както е описано по-горе (Hwang et al., 2017; Zitnay et al., 2017). Тази процедура включва създаването на 2 µM CHP разтвор, нагряване на разтвора при 80 ° С в продължение на 5 минути за мономеризиране на пептидите, охлаждане в ледена баня за 30 s и прилагане на разтвора върху тъканта. Тъканта се инкубира през нощта и след това се открива положително свързване, като се използва маркиран с GFP стрептавидин (Dylight 488 Strepavidin; Vector Laboratories Inc., Burlingame, CA, USA).
SHG изображения
Неподдържаните секции, вградени в смола, са заснети с микроскоп за лазерно сканиране Olympus FV1000 MPE (Olympus Corporation, Токио, Япония) в Медицинското училище Icahn в ядрото на планината Синай. Двуфотонното възбуждане беше направено с регулируемия лагер Coherent Chameleon Vision II. Разпространението на обратния сигнал се събира с помощта на специалната водопотапяща 25-кратна обектив на Olympus WLPLN с числена апертура 1,05. Беше използван поетапен подход за улавяне на SHG сигнала на фибриларен колаген и TPEF сигнала за обща AGE автофлуоресценция (Tang et al., 2007; Vashishth, 2009) в предния AF на всяка проба. Възбуждането за обратен SHG (B-SHG) се извършва при 910 nm и се записва чрез фотоумножителна тръба (PMT) при 440 ± 10 nm. След това лазерът беше настроен на 740 nm и TPEF беше записан със същия детектор при 440 ± 10 mm. Всички параметри (т.е. интензитет на лазера, усилване, напрежение, време на престой, пропорция) се поддържат постоянни за изображенията на SHG и TPEF, за да се позволи сравнение на интензивността на изображението. Оптичните срезове бяха взети през цялата секция при размер на стъпка от 1,5 µm и беше извършена максимална интензивност z-проекция както за SHG, така и за TPEF. Интензитетите на B-SHG и TPEF бяха оценени чрез измерване на средната интензивност на пикселите/площта на предния AF с помощта на NIH-ImageJ (http://rsbweb.nih.gov/ij/).
Анализ на ориентацията на влакната
Статистика
Всички данни са представени като графики с минимални, първи квартил, медиана, трети квартил и максимални стойности, като лентите за грешки представляват стандартното отклонение. Двустранният несдвоен t-тест на Student с корекция на Bonferroni е приложен между L-AGE и H-AGE жени и между L-AGE и H-AGE мъже. Всички данни се считат за значими, ако P≤0.05 и тенденция, ако P≤0.10.
- Диетичен прием на крайни продукти за гликиране (AGEs) и промени в телесното тегло в Европа
- Диетични крайни продукти за гликация и тяхната потенциална роля при кардиометаболитни заболявания през
- Диетично разнообразие и консумация на хранителни групи при деца, консумиращи крави; диета за изключване на мляко -
- Консумацията на диета с високо съдържание на млечни продукти води до по-високи 15 0 в холестериловите естери на здрави хора
- Диетични навици, консумация на храна и прием на хранителни вещества през юношеството - ScienceDirect