Кейт Кеог
1 Отдел за изследвания на животни и биология, Център за изследвания и иновации на животни и пасища, Teagasc, Grange, Dunsany, Co. Мит, Ирландия
Синеад М. Уотърс
1 Отдел за изследвания на животни и биология, Център за изследвания и иновации на животни и пасища, Teagasc, Grange, Dunsany, Co. Мит, Ирландия
Пол Кормикан
1 Отдел за изследвания на животни и биология, Център за изследвания и иновации на животни и пасища, Teagasc, Grange, Dunsany, Co. Мит, Ирландия
Алън К. Кели
2 Училище по земеделие и хранителни науки, Университетски колеж Дъблин, Белфийлд, Дъблин 4, Ирландия
Дейвид А. Кени
1 Отдел за изследвания на животни и биология, Център за изследвания и иновации на животни и пасища, Teagasc, Grange, Dunsany, Co. Мит, Ирландия
Свързани данни
Всички RNA-seq файлове са достъпни от базата данни на NCBI Gene Expression Omnibus (номер за присъединяванеGSE94004).
Резюме
Въведение
Многократно е показано, че органи, включващи компоненти на стомашно-чревния тракт, показват ускорен растеж при възстановяване на храната след предварително диетично ограничение [3–6].
Материали и методи
Комитетът по етика на Университетския колеж в Дъблин одобри всички процедури с използване на животни и настоящото проучване е лицензирано от Ирландския департамент по здравеопазване и деца в съответствие с Директива 86/609/ЕО на Европейската общност.
Управление на животните
Вземане на проби от тъкани
Всички животни бяха заклани хуманно в лицензирана от ЕС кланица (Euro Farm Foods Ltd, Cooksgrove, Duleek, Co. Meath, Ирландия) чрез зашеметяване на затворени болтове, последвано от обезкървяване и всички проби от тъкани бяха събрани след клането. Иеюналната тъкан (10 cm) е събрана на около 30 cm дистално от дуоденално-йеюналната връзка. Пробите бяха събрани и поставени в солен разтвор, буфериран с Dulbecco фосфат (DPBS), за да се отстрани всяка дигеста. Срезите на йеюнума първоначално се измиват в DPBS и впоследствие се изрязват по надлъжната ос, за да се даде възможност на тъканта да бъде положена плоско. След отваряне на тъканта, проби от еютел на йеюнум бяха промити за втори път в DPBS, за да се гарантира, че върху тъканта не остава дигеста. След това епителната тъкан се остъргва от подлежащата съединителна и мускулна тъкан с помощта на стъклен микроскоп. След това тъканта се поставя в епруветка за събиране, замразена в течен азот и впоследствие се съхранява при -80 ° C.
Изолация на РНК, секвениране и анализ на биоинформатиката
Изолирането на РНК, подготовката и последователността на библиотеката на cDNA, както и биоинформатичният анализ са описани по-рано [8, 9] и са описани тук само накратко. Общо РНК се изолира от приблизително 30 mg замразени йеюнални епители с помощта на RNeasy Mini Kit (Qiagen, UK), съгласно инструкциите на производителя. Количеството на РНК и целостта на РНК бяха определени с помощта на Nanodrop спектрофотометър ND-1000 (Nanodrop Technologies, Wilmington, DE, USA) и RNA 6000 Nano Lab Chip kit (Agilent Technologies Ireland Ltd., Dublin, Ireland), съответно. Само проби с високо качество на РНК (номера на целостта на РНК> 8) са избрани за последващо секвениране на РНК (10 проби от всяка обработена група във всеки момент от клането). cDNA библиотеките бяха приготвени от 3 μg висококачествена обща РНК, използвайки комплекта за подготовка на проби на Illumina TruSeq RNA, следвайки инструкциите на производителя (Illumina, Сан Диего, Калифорния, САЩ). Общо 40 индивидуални RNAseq библиотеки бяха мултиплексирани в съответствие със съответните им специфични адаптерни адаптери и беше извършено 100 последователност от единични краища на базови двойки в 4 ленти на Flowcell на секвенсор Illumina HiSeq 2000.
Анализ на пътя
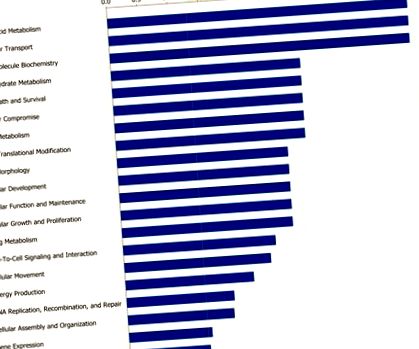
Лентите показват вероятността [-log (P стойност)], че специфичната функция е била засегната от диетични ограничения в сравнение с други, представени в списъка с диференциално експресирани гени.
Лентите показват вероятността [-log (P стойност)], че специфичната функция е била засегната от диетични ограничения в сравнение с други, представени в списъка с диференциално експресирани гени.
маса 1
| ANPEP | Аланил (мембранна) аминопептидаза | -26.2 |
| ANXA10 | Анексин А10 | -4.4 |
| AP3B2 | Свързан с адаптер протеинов комплекс 3, бета 2 субединица | -8.7 |
| ASIC3 | Киселинно-чувствителен (с протон) йонен канал 3 | -11.3 |
| ASNS | Аспарагин синтетаза (хидролизираща глутамин) | 2.3 |
| АВТОМОБИЛИ | Цистеинил-тРНК синтетаза | 1.6 |
| CTSW | Катепсин W | 1.9 |
| DAPL1 | Свързани със смъртта протеиноподобни 1 | -6.7 |
| ELL3 | Фактор на удължаване РНК-полимераза II-подобна 3 | -3.9 |
| INSIG1 | Индуциран от инсулин ген 1 | -1.9 |
| OLFML3 | Подобни на олфактомедин 3 | 2.0 |
| PAPSS2 | 3'-фосфоаденозин 5'-фосфосулфат синтаза 2 | -3.5 |
| PGA3 | Пепсиноген-3 | -2.8 |
| S100A2 | S100 калций свързващ протеин А2 | -2.8 |
| SDS | Серин дехидратаза | -3.1 |
| SLC1A5 | Семейство разтворени носители 1 (неутрален аминокиселинен транспортер), член 5 | 2.0 |
| SLC7A5 | Семейство носители на разтворени вещества 7 (аминокиселинна лека верига, L система), член 5 | 2.1 |
| WNT2 | Член на семейството на сайт за интеграция на безкрил тип MMTV 2 | 2.2 |
1 Промените в сгъване са нагоре или надолу при ограничено хранени животни в сравнение с контролирани животни, хранени по желание
Таблица 2
| ADIRF | Регулаторен фактор на адипогенезата | -3.2 |
| ANXA10 | Анексин А10 | 3.9 |
| ASNS | Аспарагин синтетаза (хидролизираща глутамин) | -2.4 |
| CMA1 | Химаза 1, мастоцит | -3.1 |
| DAPL1 | Свързани със смъртта протеиноподобни 1 | 6.6 |
| DDAH1 | Диметиларгинин диметиламинохидролаза 1 | 2.3 |
| DNAH2 | Dynein, аксонемална, тежка верига 2 | 2.6 |
| EFR3B | EFR3 хомолог В (S. cerevisiae) | 2.3 |
| GCNT3 | Глюкозаминил (N-ацетил) трансфераза 3, тип муцин | 8.9 |
| GSTA1 | Глутатион S-трансфераза алфа 1 | 16.7 |
| ХЕРПУД1 | Индуцируем от хомоцистеин ендоплазмен ретикулум, индуцируем стрес, подобен на убиквитин домейн член 1 | -1.7 |
| IL17RB | Интерлевкин 17 рецептор В | -1.9 |
| INSIG1 | Индуциран от инсулин ген 1 | 2.4 |
| IRG1 | Имунореагиращ 1 хомолог (мишка) | 3.0 |
| LRRC17 | Богат на левцин повтор, съдържащ 17 | -2.9 |
| LTC4S | Левкотриен С4 синтаза | -2.3 |
| LTF | Лактотрансферин | 2.9 |
| MAP1LC3C | Свързан с микротубули протеин 1 лека верига 3 гама | -2.9 |
| PFKFB3 | 6-фосфофрукто-2-киназа/фруктоза-2,6-бифосфатаза 3 | 2.2 |
| PGA3 | Пепсиноген-3 | 4.9 |
| PLP1 | Протеолипиден протеин 1 | -2.8 |
| PRLR | Пролактинов рецептор | 2.1 |
| PSAT1 | Фосфосерин аминотрансфераза 1 | -2.6 |
| S100A2 | S100 калций свързващ протеин А2 | 5.1 |
| SCG2 | Секретогранин II | -3.2 |
| SDS | Серин дехидратаза | 4.8 |
| SDSL | Подобно на серин дехидратаза | 3.1 |
| SLAMF7 | Член на семейството на SLAM 7 | -1.9 |
| TFF2 | Фактор на трилистника 2 | 18. |
| TNFRSF11B | Суперсемейство на тумор некрозис фактор рецептор, член 11b | 2.1 |
1 Промените в гънките са в рамките на групата за третиране на ВЕИ при компенсиращи животни в сравнение с ограничено хранени животни.
Дискусия
Храносмилане и метаболизъм
В допълнение към своята функционалност в храносмилателните и метаболитните процеси, йеюнумът е и основно място за усвояване на усвоените хранителни вещества през чревната стена за усвояване и по-нататъшен метаболизъм в черния дроб [30]. В края на Период 1 беше очевидна регулация на два гена, кодиращи транспортьори на аминокиселини, подобни на разтворено вещество, а именно SLC1A5 и SLC7A5. По-рано йеюнумът е идентифициран като основно място на абсорбция на аминокиселини и пептиди в тънките черва [30, 31]. По-голямата експресия на SLC1A5 и SLC7A5, наблюдавана в настоящото проучване, може да отразява засилено изискване за усвояване на аминокиселини и по-голямо използване на хранителни вещества, получени от диетата по време на диетични ограничения.
В настоящото проучване периодът на диетични ограничения е свързан с регулиране надолу на гените, участващи в метаболизма и храносмилането. Обратно, обаче, по време на възстановяването на ДЕГ, участващи в метаболизма и храносмилането, впоследствие бяха регулирани нагоре. Например по време на ре-алиментационните гени, участващи в метаболизма, включително PGA3, PFKB3, SDS и SDSL, се регулират нагоре при животни, подложени на CG, спрямо наблюдаваните по време на диетични ограничения (RES Период 2 в сравнение с RES Период 1). PFKFB3 кодира ензим, участващ в гликолизата [32], докато SDS и SDSL кодират гени, участващи в метаболизма на серина и глицина. В съответствие с това, Connor et al. [21] и Keogh et al. [8] и двамата наблюдават по-голяма експресия на гени, участващи в метаболизма по време на ре-алиментация, индуцирана CG в чернодробната тъкан. По-голяма експресия на гените на метаболизма през Период 2 настъпи с по-голям прием на диета при животните, подложени на CG [6], индуцирана от повторна алиментация, което може да е отразило по-голямо изискване за метаболитни процеси, съпътстващи по-голям хранителен прием в йеюнален епител през това време. Необходими са обаче допълнителни проучвания за оценка на метаболитното състояние на метаболитните органи в отговор както на диетичните ограничения, така и на CG.
Клетъчен растеж и диференциация
Имунна функция и клетъчна детоксикация
Заключения
- Ефект от диетичното ограничение и последващо възстановяване върху транскрипционния профил на
- Ефект на диетичните нива на протеини върху ефективността на растежа, хематологичния профил и биохимичните
- Ефект на диетичния кефир върху ефективността на растежа, използването на фуражите и профила на мастните киселини на
- Covid-19 и последващото блокиране Модифицирани хранителни навици на почти половината от населението в
- Диетично поведение и преяждане в Anorexia Nervosa, Bulimia Nervosa и Binge