Свързани данни
Резюме
Целта на това проучване беше да се изследва влиянието на два вида основни японски основни храни, бял ориз и бял хляб, върху чревната микробиота на фона, в който участниците ядат общи гарнитури. Седем здрави субекта завършиха диетичната интервенция с два едноседмични периода на изпитване с 1-седмичен период на измиване в кръстосан дизайн (UMIN регистрация UMIN000023142). По време на тестовите периоди бяха консумирани бял хляб или бял ориз и 21 замразени готови гарнитури. В началото и в края на всеки период бяха взети кръвни проби на гладно, проби от дишане и фекални проби. За фекални проби се използва 16S рРНК генно секвениране за анализ на чревната микробиота. След периода на хляба, изобилието от фекален род Bifidobacterium (19,2 ± 14,5 срещу 6,2 ± 6,6 (%), p = 0,03), глюкагоноподобен пептид 1 (GLP-1) на гладно (13,6 ± 2,0 срещу 10,5 ± 2,9 ( pg/mL), p = 0,03) и водородният дъх (23,4 ± 9,9 срещу 8,2 ± 5,5 (ppm), p = 0,02) са значително по-високи от тези след периода на ориза. SCFA на плазмата също има тенденция да бъде по-висока след периода на хляба. Белият хляб съдържа повече диетични фибри, отколкото рафинираният късозърнест ориз. Тези открития предполагат, че приемът на несмилаеми въглехидрати от ориз с къси зърна като основна храна може да бъде по-малък от този на белия хляб.
1. Въведение
Оризът е традиционна основна храна от японската диета, но консумацията на ориз на глава от населението в Япония е намаляла през последните 50 години [1,2]. Междувременно потреблението на хляб в Япония се е увеличило и оризът и хлябът сега са двете основни основни храни, които осигуряват основния дял от японския енергиен прием [3].
Диетичният модел на ядене на ориз като основна храна включва по-нисък прием на мазнини и наситени мазнини и по-висок прием на диетични фибри в сравнение с яденето на продукти от пшенично брашно като основни храни [4]. Предишно проучване на напречното сечение показва, че по-високият прием на ориз и по-ниският прием на хляб са свързани с по-ниско разпространение на функционалния запек [5]. Остава обаче неясно дали този ефект се дължи главно на разликата в основните храни или хранителните съставки, включително гарнитурите.
Приблизително 10% от приетите въглехидрати се противопоставят на панкреатичната амилаза и избягват храносмилането в тънките черва и остават основен субстрат за ферментация в дебелото черво [6]. По време на ферментацията на тези несмилаеми въглехидрати чревната микробиота произвежда късоверижни мастни киселини (SCFA) [7,8]. Според някои предишни проучвания SCFAs, произведени от чревната микробиота, са свързани с липидния метаболизъм [9] и метаболизма на глюкозата при хората [10,11,12].
В ежедневните ни ястия гарнитурите се различават при хранене, но основните храни се консумират многократно. Ние предположихме, че приемането на храната на несмилаеми въглехидрати, получени от основни храни, ще има ефект върху метаболизма на гостоприемника чрез състава на чревната микробиота. В настоящото пилотно проучване ние се фокусираме върху разликата на основните храни и тяхното влияние върху състава на микробиотата в червата и метаболизма на глюкозата и липидите в двупериоден дизайн на кросоувър, използвайки търговски пакет от гарнитури.
2. Метод
2.1. Субекти
За това проучване бяха наети здрави доброволци от нашия изследователски отдел (студенти, технически и изследователски персонал). Критериите за включване бяха следните: (1) тези, които в момента не приемаха никакви лекарства; (2) тези, които не са имали аномалии при физически преглед през последната година. Субектите, които са имали треска, диария или възпаление на горните дихателни пътища по време на периода на изследване, са били изключени от анализа. Протоколът (UMIN регистрация UMIN000023142) е одобрен от Университетско училище в Киото и Медицински факултет, Комитет по етика. Изследването е проведено в университетската болница в Киото в съответствие с принципите на Декларацията от Хелзинки. Всички субекти са дали писмено информирано съгласие.
2.2. Уча дизайн
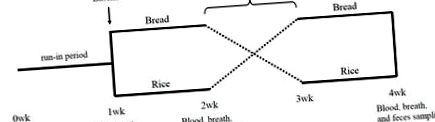
Проучването е рандомизирано, кръстосано проучване. След 1-седмичен период на въвеждане, субектите бяха рандомизирани по начин 1: 1 на една от двете интервенционни последователности: период на хляб с доставени гарнитури за 1 седмица, последван от оризов период с доставени гарнитури за 1 седмица или период на ориз с доставени гарнитури за 1 седмица, последван от период на хляб с доставени гарнитури за 1 седмица (Фигура 1). Между двата периода на изпитване е включен 1-седмичен период на измиване. На изходното ниво и в края на всеки тестов период бяха събрани проби от кръв, дъх и фекалии (Фигура 1).
В периодите на навлизане и измиване субектите са инструктирани да избягват да ядат пробиотици, кисело мляко, олигозахариди и култивирана млечна напитка. По време на тестовите периоди субектите не консумираха нищо друго освен основна храна (бял хляб или бял ориз) и предоставените гарнитури. Бял хляб и бял ориз на пазара бяха приготвени от всеки субект. Доставените гарнитури представляват пакет от замразените приготвени 21 комплекта гарнитури (TOKATSU FOODS Corporation, Йокохама, Япония). Субектите избраха един комплект гарнитури за всяко хранене в реда, който им хареса през първите 6 дни, но през последния ден бяха фиксирани три комплекта гарнитури и през двата периода. Субектите записват количеството хляб или ориз, което са изяли през първия период на изпитване, и са яли еквивалентната енергия на ориз или хляб през втория период на изпитване. Хранителното съдържание на хляба и ориза е изчислено въз основа на базата данни за състава на храните, публикувана от Министерството на образованието, културата, спорта, науката и технологиите, Япония [13], а хранителното съдържание на гарнитурите е предоставено от производителя.
2.3. Оценка на фекални проби
Фекалните проби бяха събрани от субекти вкъщи. Субектите са инструктирани да поставят фекални проби в епруветките и да ги поставят в кутии със сух лед (-78 ° C) веднага след събирането и да носят кутиите в лабораторията. Събраните фекални проби се съхраняват при -80 ° C до анализ.
Анализите на секвенцията на 16S рРНК на структурата на микробната общност във фекални проби бяха проведени с помощта на MiSeq (Illumina, Сан Диего, Калифорния, САЩ) в TechnoSuruga Laboratory Co., Ltd. (Shizuoka, Япония), съгласно метода, описан по-рано [14]. Накратко, PCR амплификация беше извършена чрез използване на 341F (5′-CCTACGGGAGGCAGCAG-3 ′) [15] и 806R (5′-GGACTACHVGGGTWTCTAAT-3 ′) [16], които бяха праймери за усилване на V3-V4 областта в бактериални 16S рДНК. В допълнение към специфичните за грундиране V3 – V4 региони, тези грундове допълваха стандартните праймери и реверсивни праймери Illumina. Обратният грунд също съдържаше 6-bp индексираща последователност (CAGATC, ACTTGA, GATCAG, TAGCTT, GGCTAC, CTTGTA, ATCACG, CGATGT, TTAGGC и TGACCA), за да позволи мултиплексиране. Методът на PCR за тъчдаун за термично циклиране е използван със система за генериране на PCR GeneAmp 9700 (ABI, Фостър Сити, Калифорния, САЩ). Всяка PCR реакционна смес (25 μL) съдържа 20 ng геномна ДНК, 2 × MightyAmp Buffer Ver.2 (Takara, Otsu, Япония), 0,25 μM от всеки праймер и 1,25 единици MightyAmp ДНК полимераза (Takara, Otsu, Япония). Всяка PCR реакция и приготвяне на ампликонов пул се извършват, както е описано по-рано [14].
Всеки мултиплексиран библиотечен пул беше снабден с 12,5% phiX контрол за подобряване на базовото извикване по време на секвениране, както се препоръчва от Illumina за обединяването на две библиотеки [14]. Секвенирането беше проведено с използване на сдвоен край, 2 × 281-bp цикъл, изпълнен на система за последователност Illumina MiSeq и химия на MiSeq Reagent Kit версия 2 (500 цикъла). Извършено е секвениране на сдвоени краища с дължини на четене от 281 bp. След демултиплексиране се наблюдава ясно припокриване в четените сдвоени краища. Това припокриване позволи на сдвоени четения да бъдат обединени заедно с програмата fastq-join (http://code.google.com/p/ea-utils/). Методът за качествено филтриране на последователностите беше следният: Извлечени са само четения, които са имали стойности на качеството (QV) ≥20 за повече от 99% от последователността за по-нататъшни анализи.
Софтуерът Metagenome @ KIN (World Fusion Co., Ltd., Токио, Япония) е използван за извършване на хомологично търсене с определените 16S рДНК последователности срещу TechnoSuruga Lab Microbial Identification Databese DB-BA10.0 (TechnoSuruga Laboratory, Co., Ltd ., Токио, Япония), който съдържа само бактерии, стоящи в таксономичната номенклатура [17,18]. Бактериалните видове бяха идентифицирани въз основа на данни от 97% прекъсване на сходството с DB-BA 10.0 [17,18].
2.4. Измерване на кръвни проби
Кръвните проби бяха взети след едно нощно гладуване (12 часа). Във всички точки кръвни проби за измерване на плазмена глюкоза се събират в епруветки, съдържащи натриев флуорид (NaF) и етилендиамин тетраоцетна киселина (EDTA); кръвни проби за серумен инсулин, безсерумни мастни киселини (FFA) и серумен триглицерид (TG) бяха събрани в епруветки, съдържащи ускорител на кръвосъсирването; и кръвни проби за инкретин бяха събрани в епруветки, съдържащи инхибитор на дипептидил пептидаза-4 (DPP-4) (BD P800; Becton Dickinson, Сан Хосе, Калифорния, САЩ). Тези кръвни проби се центрофугират (3000 rpm, 20 min, 4 ° C) и събраните проби от плазма и серум се съхраняват при -80 ° C до анализ. Кръвни проби за късоверижни мастни киселини (SCFA) се събират в ледено охладени епруветки, съдържащи EDTA, и веднага се центрофугират (3000 rpm, 10 min, 4 ° C). Събраните плазмени проби се замразяват незабавно в течен азот и се съхраняват при -80 ° C до анализ.
Плазмената глюкоза беше измерена чрез ултравиолетова абсорбционна спектрофотометрия в SRL, Inc., Токио, Япония. Серумният инсулин се определя с помощта на хемилуминесцентен ензимен имунен анализ в SRL, Япония. Серумните FFA и серумните триглицериди се определят, като се използват ензимни колориметрични комплекти и глицерол-3-фосфат оксидазен метод, съответно, в SRL, Япония. Общият глюкагоноподобен пептид 1 (GLP-1) се измерва чрез набор от човешки общ GLP-1 (версия 2) (K150JVC-1; Mesoscale Discovery, Gaithersburg, MD, USA); общ глюкозозависим инсулинотропен полипептид (GIP) се измерва чрез човешки GIP (общ) ELISA (EZHGIP-54K; Merck Millipore, Дармщат, Германия). SCFA на плазмата беше измерена чрез течна хроматография, съчетана с тандемна масспектрометрия (LC-MS/MS) в LSI Medience Corporation, Токио, Япония.
2.5. Анализи на водородния дъх
Проби от вдишване от крайния край се събират в алуминиеви торбички по едно и също време с вземането на кръвни проби, за да се измери водородът, който е индикатор за ферментация на дебелото черво [10,11,19,20,21]. Водородът за дишане беше измерен чрез обикновен газов хроматограф (Breath Gas Analyzer BGA1000D) в Лаборатория за изтичане на биохимия, хранителен метаболизъм Co., Ltd., Нара, Япония [22,23].
2.6. Статистически анализ
Изчисляването на размера на пробата се основава на стандартизиран размер на ефекта от 2,5 (дъх водород), изчислен от предишно проучване [10]. Необходим беше размер на извадката от пет, за да се осигури 80% мощност за откриване на тази разлика при двустранно ниво на значимост от 0,05.
Всички данни са изразени като средна стойност със стандартно отклонение. Сравненията между пробите в края на периодите на хляб и тези в края на оризовите периоди бяха извършени с помощта на сдвоен t тест. Анализирани са двустранни р 2) 21,0 ± 1,5 (обхват 18,6–23,1)). Плазмената глюкоза и серумният инсулин на всички субекти са в нормални граници (съответно 91,2 ± 2,9 mg/dL, 5,2 ± 1,6 µIU/ml) (Таблица 1). Пет от седемте субекта (двама мъже и три жени; средна (± SD) възраст 36.2 ± 3.9 години и ИТМ (kg/m 2) 20.4 ± 1.3) са анализирани за SCFA в плазмата, водород в дъха и чревна микробиота.
маса 1
Характеристики на субектите на изходно ниво.
- Бял хляб срещу бял ориз - Присъдата е изтекла; Clear Cut Fitness
- Диета за диабет тип 2 Кафяв хляб срещу бял хляб - тук е най-добрият хляб за диабетици за понижаване на кръвта
- Твърдението, че пикантните храни повишават метаболизма - The New York Times
- Ефектът на сините сливи върху отделянето на изпражнения, времето за транзит в червата и стомашно-чревната микробиота A рандомизирано
- Какво; s Най-здравословният ориз за кафяв, бял, див ориз, още