Institut National de la Recherche Agronomique, UMR1067 Nutrition Aquaculture et Génomique, Saint-Pée-sur-Nivelle, Франция;
Laboratorio de Fisioloxía Animal, Departamento de Bioloxía Funcional e Ciencias da Saúde, Facultade de Bioloxía, Universidade de Vigo, Vigo, Испания; и
Адрес за заявки за повторно отпечатване и друга кореспонденция: S. Polakof, INRA, UMR1067 Nutrition Aquaculture and Génomique, Pôle d'hydrobiologie, CD918, F-64310 St-Pée-sur-Nivelle, Франция (имейл: [имейл защитен]).
Департамент по биология и Център за напреднали изследвания в геномиката на околната среда, Университет на Отава, Отава, Онтарио, Канада
Institut National de la Recherche Agronomique, UMR1067 Nutrition Aquaculture et Génomique, Saint-Pée-sur-Nivelle, Франция;
Institut National de la Recherche Agronomique, UMR1067 Nutrition Aquaculture et Génomique, Saint-Pée-sur-Nivelle, Франция;
Institut National de la Recherche Agronomique, UMR1067 Nutrition Aquaculture et Génomique, Saint-Pée-sur-Nivelle, Франция;
Резюме
Дъгова пъстърва (Oncorhynchus mykiss Walbaum) е получена от експерименталните съоръжения за рибовъдни стопанства на Donzacq (Landes, Франция) на Institut National de la Recherche Agronomique (INRA). Рибите се отглеждат в резервоари, държани в отворени кръгове, снабдени с добре аерирана вода 17 ° C, под контролиран фотопериод (12: 12-часов цикъл светлина-тъмнина) и хранени с търговска диета през периода на аклиматизация (T-3P classic, Trouw Франция). Теглото на рибата е 200 ± 10 g. Експериментите са проведени в съответствие с насоките на националното законодателство за грижата за животните на френското министерство на научните изследвания (Декрет № 2001–464 0 от 29 май 2001 г.) и са одобрени от Комитета по етика на INRA (съгласно INRA 2002–36 от 14 април 2002 г.).
Експериментални протоколи.
Вземане на проби от тъкани.
Пъстървите бяха убити с остър удар в главата. Кръвта се отстранява от опашната вена и се центрофугира при 3000 ж в продължение на 5 минути и възстановената плазма веднага се замразява при -20 ° C, докато се анализира. Съдържанието на червата във всяка риба се проверява систематично, за да се гарантира, че рибата, взета от пробите, е консумирала диетата. Черен дроб, перивисцерална бяла мастна тъкан и проба от дорзо-вентрален бял мускул веднага се дисектират, претеглят и замразяват в течен азот и се държат при -80 ° C в очакване на анализи.
Биохимични и молекулярни анализи.
Нивата на плазмената глюкоза се определят с помощта на търговски комплект (Biomérieux, Франция), адаптиран към формат на микроплаки. Нивата на говежди инсулин се измерват с помощта на търговски комплект ELISA (Mercodia, Швеция), както в Polakof et al. (33). Нивата на гликогена в тъканите се определят по метода на Keppler et al. (15). Ензимните дейности бяха оценени, както беше представено по-рано (30).
нивата на иРНК за протеини, участващи в транспорта и метаболизма на глюкозата, бяха определени чрез количествена RT-PCR в реално време (q-PCR) (33), включително GLUT4, хексокиназа (HK), глюкоза 6-фосфатаза (G6Pase), фосфоенолпируват карбоксикиназа (PEPCK), синтаза на мастни киселини (FAS), глюкоза 6-фосфат дехидрогеназа (G6PDH) и регулаторен елемент на стерол, свързващ протеин 1с-подобен (SREBP-1c-подобен). Праймерите са проектирани да припокриват интрон, където е възможно (софтуер Primer3), използвайки известни последователности в базата данни на пъстървови нуклеотидни бази (GenBank и INRA-Sigenae), както е описано по-рано (33). Количествено определяне на целевите генни транскрипти беше направено с използване ef1α генна експресия като референция (28), за която беше установено, че е стабилно изразена в това проучване. Относително количествено определяне на целевата генна транскрипция с ef1α референтна генна транскрипция е направена по метода Pfaffl (28).
Екстракция на протеини (20 μg протеин за черния дроб и WAT и 40 μg за мускулите) и Western blot анализ бяха оценени с помощта на анти-фосфо-Akt Ser 473 и анти-Akt антитела (Cell Signaling Technology, Париж, Франция), което беше демонстрирано преди това за кръстосана реакция с дъговата пъстърва Akt протеин (33).
Статистически анализ.
Резултатите са изразени като средни стойности ± SE (н = 6). Данните бяха анализирани чрез еднопосочна ANOVA. Когато е необходимо, данните се трансформират в дневник, за да отговарят на условията на ANOVA. Post hoc сравненията бяха направени с помощта на тест на Student-Newman-Keuls и разликите бяха счетени за статистически значими при P 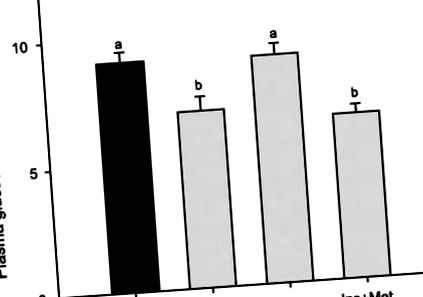
Фиг. 1.Плазмени нива на глюкоза в дъговата пъстърва, хранена с обогатена с въглехидрати диета в продължение на 5 дни и евтаназирана 6 часа след последното хранене. Рибите са имплантирани с помпи, съдържащи физиологичен разтвор (Con), метформин (Met; 20 mg · kg -1 ден дневно -1), инсулин [Ins; 26 μg инсулин · kg −1 · ден -1 (0.7 IU инсулин · kg -1 ден · -1)] или разтвор инсулин + метформин (Ins + Met) за 5 дни. Резултатите са изразени като средни стойности ± SE (н = 6) и бяха анализирани чрез еднопосочен ANOVA, последван от тест за многократно сравнение на Student-Newman-Keuls. a, b Различните букви показват значителни разлики между групите (P
Състоянието на фосфорилиране на Akt (серин 473) в черния дроб, скелетните мускули и WAT е представено на фиг. 2. Чернодробен pAkt (фиг. 2A) нивата са били постоянни в различните групи, с изключение на групата, имплантирана с инсулин + метформин помпи, които демонстрират по-висок статус на фосфорилиране от контролната (физиологичен разтвор) група. За мускулите (фиг. 2Б.) и WAT (фиг. 2° С), резултатите за pAkt са сходни с имплантираната инсулин група, показваща по-високи нива на фосфорилиране от солевата група (съответно три- и двукратно).
Фиг. 2.Ефекти на физиологичен разтвор, метформин, инсулин или инсулин + инфузия на метформин (5 дни) върху черния дроб (A), бял мускул (Б.) и бяла мастна тъкан (WAT) (° С) Akt състояние на фосфорилиране (Western blot анализ) при пъстърва, хранена с високо въглехидратна диета (5 дни). Геловете бяха заредени с 20 μg общ протеин на лента. Нивата на протеин и фосфорилиране са нормализирани до нивата на β-тубулин в тъканите и са посочени като промяна в пъти в сравнение с групата за лечение с физиологичен разтвор. Резултатите са изразени като средни стойности ± SE (н = 6) и бяха анализирани чрез еднопосочен ANOVA, последван от сравнителен тест на Student-Newman-Keuls. a, b Различните букви показват значителни разлики между групите (P
Фиг. 3.Ефекти на физиологичен разтвор, метформин, инсулин или инсулин + инфузия на метформин (5 дни) върху нивата на транскриптите на иРНК, кодиращи чернодробни гени и ензимни активности при пъстърва, хранена с високо въглехидратна диета (5 дни). Нива на иРНК на глюкоза 6-фосфатаза (G6Pase) (A), G6Pase дейности (Б.), нива на иРНК на фосфоенолпируват карбоксикиназа (PEPCK) (° С), PEPCK дейности (д), нива на иРНК на синтаза на мастна киселина (FAS) (Е.), FAS дейности (F), нива на иРНК на глюкоза 6-фосфат дехидрогеназа (G6PDH) (G), G6PDH дейности (З.) и стерол регулаторен елемент, свързващ протеин 1-подобен (SREBP-1c-подобен) (Аз) нива на иРНК. нивата на тРНК бяха изчислени с помощта на RT-PCR в реално време и нормализирани до транскриптите на фактор на удължаване 1α (EF1α), които не се променят при експерименталните условия и са представени като кратна промяна спрямо групата за лечение с физиологичен разтвор, зададена на 1. Единици на ензимна активност (mU, дефинирани като наномоли от субстрата, превърнати в продукт, за минута, при 20 ° C) на милиграм протеин. Резултатите са представени като средни стойности ± SE (н = 6) и бяха анализирани чрез еднопосочен ANOVA, последван от сравнителен тест на Student-Newman-Keuls. a, b, c Различните букви показват значителни разлики между групите (P
нивата на mRNA, кодиращи мускулни GLUT4 и HK, както и HK дейности са представени на фиг. 4. Нивата на mRNA и за двете GLUT4 (фиг. 4A) и HK (фиг. 4Б.) са значително увеличени при рибите с метформин помпи. За HK дейности (фиг. 4° С), резултатите са подобни на тези за нивата на иРНК с изключение на повишена активност и в групата инсулин + метформин.
Фиг. 4.Ефекти на физиологичен разтвор, метформин, инсулин или инсулин + инфузия на метформин (5 дни) върху нивата на транскриптите на иРНК, кодиращи гени на белите скелетни мускули и ензимни активности при пъстърва, хранена с високо въглехидратна диета (5 дни). Транспортер за улесняване на глюкозата тип 4 (GLUT4; A) нива на иРНК, хексокиназа (HK; Б.) нива на иРНК и HK дейности (° С). Резултатите са представени като средни стойности ± SE (н = 6) и бяха анализирани чрез еднопосочен ANOVA, последван от сравнителен тест на Student-Newman-Keuls. a, b Различните букви показват значителни разлики между групите (P
нивата на иРНК, кодиращи WAT ензимите, участващи в метаболизма на въглехидратите, и техните съответни специфични дейности са представени на фиг. 5. Нива на иРНК на GLUT4 (фиг. 5A) са се увеличили значително при тези лечения, които включват метформин, като се регулират около два пъти по отношение на контролната група. Докато HK mRNA нива (Фиг. 5Б.) остана непроменен по време на лечението, HK дейности (Фиг. 5° С) се увеличава в групата, инфузирана с инсулин + метформин. FAS нива на иРНК (Фиг. 5д) и дейности (Фиг. 5Е.) са били повлияни по различен начин от леченията. Докато нивата на иРНК бяха регулирани при всички лечения в сравнение с контролната група, активностите бяха повишени само при риби, получаващи инфузия на инсулин. Нива на иРНК на G6PDH (фиг. 5F) и дейности (Фиг. 5G) бяха регулирани по различни начини. Нивата на тРНК на G6PDH бяха понижени при рибите, получаващи само метформин или инсулин, докато дейностите бяха засилени в групите, инфузирани само с метформин или в комбинация с инсулин. И накрая, нивата на mRNA на транскрипционния фактор SREBP-1c-подобен (Фиг. 5З.) са особено чувствителни към присъствието на метформин в инфузионната среда, която е регулирана както при лечение с метформин, така и при инсулин + метформин, докато самостоятелният инсулин води до намалени нива на иРНК.
Фиг. 5.Ефекти на физиологичен разтвор, метформин, инсулин или инсулин + инфузия на метформин (5 дни) върху нивата на транскриптите на иРНК, кодиращи гени на бяла мастна тъкан (WAT) и ензимни активности при пъстърва, хранена с високо въглехидратна диета (5 дни). Нива на mRNA на GLUT4 (A), HK mRNA нива (Б.), HK дейности (° С), Нива на иРНК на FAS (д), FAS дейности (Е.), Нива на иРНК на G6PDH (F), G6PDH дейности (G) и стерол регулаторен елемент, свързващ протеин 1-подобни (SREBP-1c-подобни) нива на иРНК (З.). Резултатите са представени като средни стойности ± SE (н = 6) и бяха анализирани чрез еднопосочен ANOVA, последван от сравнителен тест на Student-Newman-Keuls. a, b, c Различните букви показват значителни разлики между групите (P
Нивата на гликоген в черния дроб, скелетните мускули и WAT са представени на фиг. 6. Нива на гликоген в черния дроб (фиг. 6A) се повишават предимно при наличие на инсулин, включително инсулин самостоятелно и в комбинация с метформин. Напротив, нивата на гликоген в скелетните мускули (фиг. 6Б.) и WAT (фиг. 6° С) намалява в сравнение с контролната група при риби, получаващи метформин самостоятелно или в комбинация с инсулин.
Фиг. 6.Ефекти на физиологичен разтвор, метформин, инсулин или инсулин + инфузия на метформин (5 дни) върху черния дроб (A), бял скелетен мускул (Б.) и бяла мастна тъкан (WAT) (° С) нива на гликоген в пъстърва, хранена с високо въглехидратна диета (5 дни). Резултатите са изразени като средни стойности ± SE (н = 6) и бяха анализирани чрез еднопосочен ANOVA, последван от сравнителен тест на Student-Newman-Keuls. a, b, c Различните букви показват значителни разлики между групите (P
Действията на метформин в дъговата пъстърва, рибен вид, непоносим към глюкоза, преди това не са били известни. Докато някои от действията, документирани по-рано при бозайници, като инхибиране на изхода на чернодробна глюкоза, не се откриват при пъстърва, преди това показахме подобрен гликемичен профил след хранене при хранена с метформин пъстърва, вероятно свързана с повишена липогенна активност (26). Освен това, на пъстърва пъстърва, метформин упражнява парадоксален и отрицателен ефект върху инсулиновото действие (33). За да разгадаем този парадокс, ние изследвахме в настоящото проучване дали метформинът самостоятелно или в комбинация с инсулин понижава плазмените нива на глюкоза в дъговата пъстърва, хранена с високо въглехидратна диета. Оригиналността на настоящия експериментален дизайн е да се използват двете съединения заедно, за да се максимизират описаните по-рано действия, когато се вливат самостоятелно при подходящи хранителни условия (26, 33). Ние анализирахме основните цели на метформин, съобщени при бозайници и риби, както на биохимични, така и на молекулни нива в три тъкани, за които е известно, че модифицират глюкозната хомеостаза, т.е. черния дроб, скелетните мускули и WAT. Като цяло се наблюдава забавяне между молекулярния и биохимичния отговор на леченията, което показва, че за пълния функционален отговор на лечението, времето на индукция е важно.
По-ниски нива на гликемия в пъстърва, хранена с въглехидрати и инфузирана с метформин.
Дъговата пъстърва, вливана с метформин в продължение на 5 дни и хранена с високо въглехидратна диета, показва по-ниска гликемия от рибите, хранени със същата диета и вливани само с физиологичен разтвор (носител). Този понижаващ ефект върху гликемията, упражняван от метформин, е в съгласие с употребата му като антидиабетно лекарство при бозайници (17, 36). Доколкото ни е известно, този експеримент е първият, при който стомашно-чревният тракт не е участвал в лечението с метформин в хронично проучване. По този начин резултатите, получени в настоящото проучване, се дължат изключително на промени в усвояването и усвояването на глюкозата от периферните тъкани, премахвайки известните ефекти на това лекарство върху абсорбцията и окисляването на глюкоза в червата (1). Този гликемичен ефект на метформин се наблюдава преди това при рибите, въпреки че методът на приложение е различен: трансдермално за ембриони от риба зебра (8), в храната за пъстърва (26) или интаперитонеално (остър) за шаран (13). Фактът, че понижаващите ефекти върху гликемията са наблюдавани при пъстърва, хранена с въглехидрати, за разлика от предишно проучване, използващо пъстърва, инжектирана остро (интраперитонеално) с глюкоза (33), потвърждава, че хранителният статус на животното е ключов за действието на метформин и подкрепя възможно непряко участие на стомашно-чревния тракт в глюкозната хомеостаза (29).
Приложението на метформин в пъстърва в това проучване и в проучването на пъстърва на гладно (25) не повлиява състоянието на фосфорилиране на Akt в черния дроб, скелетните мускули или WAT (не е тествано преди това). Това не е твърде изненадващо, тъй като основният сигнален път, използван от метформин за упражняване на своите действия при бозайници, се смята за LKB1 и AMP-зависимата протеин киназа (37). За съжаление, никой от тези протеини не може да бъде открит в нашето in vivo проучване, използващо антитела на бозайници.
Вливаният инсулин няма ефект върху плазмените нива на глюкоза във въглехидратите, хранени с пъстърва.
Ефектите на инсулин плюс метформин върху пъстърва, хранена с въглехидрати, са тъканно зависими.
Перспективи и значение
Това проучване беше подкрепено от безвъзмездни средства за изследователска дейност от Agence Nationale de la Recherche (ANR-08-JCJC-0025-01), Национален институт за агрономическа фаза на Recherche PHASE и безвъзмездна помощ от Френско-канадския изследователски фонд за T. W. Moon и S. Panserat. С. Полакоф е получил постдокторска стипендия от Xunta de Galicia (Програма Ángeles Alvariño).
Не се декларират конфликти на интереси, финансови или други, от авторите.
ПРИЗНАВАНИЯ
Признаваме техническия персонал (Y. Hontang, F. Sandres и F. Terrier) от Institut National de la Recherche Agronomique експериментална рибна ферма на Donzacq за снабдяване на опитни животни.
- Излагането на студ насърчава затлъстяването и уврежда хомеостазата на глюкозата при мишки, подложени на диета с високо съдържание на мазнини
- Ефект на диетата върху нивата на серумния хормон на щитовидната жлеза при дъгова пъстърва (Salmo gairdneri Richardson) -
- Консумацията на изяснен сок от грейпфрут подобрява инсулиновата резистентност, предизвикана от диети с високо съдържание на мазнини и
- Диета при хиперинсулинемия (индийски хранителен план за висок инсулин) - Dietburrp
- Създаване на оптимална диета чрез проследяване на глюкозата с непрекъснат глюкозен монитор (CGM) - Нива
